В каком атоме содержится одинаковое число протонов и нейтронов
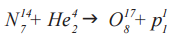
Все вещества состоят из атомов. Слово «атом» придумали задолго до наступления нашей эры. Но тогда считалось, что атом – самая крошечная частица, меньше которой ничего нет. Но наука доказала, что в атоме есть более мелкие частиц: протон, нейтрон и электрон. Протон и нейтрон находятся в ядре атома, каждая эта частица имеет массу в 1 единицу. Протон имеет заряд +1, нейтрон заряда не имеет. А ещё в атоме есть электрон, который летает вокруг ядра. Он маленький и весит так мало, что его вклад ничтожен, поэтому его массой можно пренебречь. А вот заряд у электрона есть, он отрицательный и равен -1. Всё это подробно изложено в статье «Строение атома». Ну а теперь переходим к вопросу, как понять, как устроен атом конкретного элемента, например, кислорода или кальция.
Итак, напоминаю, что атомы – нейтральны, они никогда не имеют заряда (или, иначе говоря, у них заряд 0). Но при этом в атоме есть протоны с зарядом +1, нейтроны с зарядом 0 и электроны с зарядом -1. Чтобы общий заряд атома был 0, нужно сделать так, чтобы в нём число положительных зарядов равнялось числу отрицательных. То есть в атоме число протонов (а именно они имеют заряд +1) равняется числу электронов (они имеют заряд -1). Это важно! И этот очевидный факт нужно понять и запомнить.
Сколько в атоме протонов, столько и электронов!
Почему мы тут не учли нейтроны? Потому что сейчас они нам не важны, ведь их заряд 0, поэтому на заряд атома они не влияют.
Теперь переходим к самому главному. Как же узнать число протонов и электронов в атоме? Для этого мы берём гигантскую шпаргалку, которая у вас всегда перед глазами в любом учебнике химии или кабинете химии. Это таблица Менделеева. Кстати, из неё можно узнать очень-очень много, но об этом позже.
Фото из открытых источников
Так вот. Смотрим на порядковый номер элемента (Здесь представлен фрагмент таблицы, и на картинке порядковые номера обведены синими кружками). Порядковый номер элемента – это заряд ядра.
Порядковый номер элемента в таблице Менделеева – это заряд ядра.
Но вы же помните, что ядро у нас состоит из положительно заряженных протонов и нейтронов без заряда. Значит, заряд ядра определяют только протоны, только у них есть заряд. Каждый протон имеет заряд +1. Следовательно, общий заряд ядра и показывает, сколько в ядре протонов. И чтобы было понятно, вот примеры (и используйте, рассматривая их, периодическую таблицу, которая есть в любом учебнике химии).
Пример 1.
Порядковый номер бора 5. То есть заряд ядра атома бора +5. Один протон имеет заряд +1. Сколько нужно протонов, чтобы получить заряд +5? Пять протонов. И да, в ядре атома бора 5 протонов.
Пример 2.
Порядковый номер алюминия 13. Рассуждая как выше, получаем, что в ядре атома алюминия 13 протонов, а заряд ядра +13.
Пример 3.
Порядковый номер аргона 18. Значит, протонов в ядре атома аргона 18, а заряд ядра +18.
Разобрались? Но чуть раньше мы говорили, что атом нейтрален, у него заряд 0! А теперь говорим, что у нас есть ядро, например, бора, у которого заряд +3. Всё верно, ведь вокруг ядра вращаются отрицательно заряженные электроны. Каждый электрон имеет заряд -1, и благодаря им атом получает общий заряд 0. Давайте снова перейдём к примерам.
Итак, снова про бор. Его порядковый номер 5, и мы уже поняли, что заряд ядра атома бора +5, и в нём 5 протонов. Сколько нам нужно электронов (каждый из которых имеет заряд -1), чтобы получить в сумме 0? Конечно же, 5! Потому что 5 плюсов и 5 минусов это и есть о! То есть число протонов всегда равно числу электронов.
Ещё один пример и более наглядно.
Посмотрим пристально на кальций. Его порядковый номер 20. Как и любого другого атома, у него есть ядро, в которое входят протоны и нейтроны, и электроны, которые вращаются вокруг ядра. Порядковый номер 20 говорит нам, что в ядре атома кальция находятся 20 протонов (каждый имеет заряд +1, а 20 протонов имеют заряд +20). Чтобы заряд атома кальция был 0, нужно 20 минусов. И это действительно так: вокруг ядра атома кальция вращаются 20 электронов.
Таким образом, если репетитор по химии или учитель в школе спрашивает, сколько в таком-то атоме протонов и электронов, действуем так:
1. Находим элемент в таблице Менделеева.
2. Смотрим на порядковый номер.
3. Порядковый номер = числу протонов в ядре = числу электронов.
Например, такой хитрый вопрос (на егэ по химии он не попадётся, но для тренировки решим). А сколько протонов и электронов содержится в атоме олова? Быстро ищем олово в таблице Менделеева. Порядковый номер олова – 50. И отвечаем моментально: в атоме олова 50 протонов и 50 электронов. Вот и всё.
И тут можно снова задаться вопросом о нейтронах. Зачем же они в ядре и на что они влияют? А про это говорим в следующий раз.
Пожалуйста, пишите в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1] Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2] На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
Как найти чисто протонов, электронов и нейтронов
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5] Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]. Атомная масса указана под символом элемента.
- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Расчет электронов с присутствующими ионами
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8] Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.
- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Об этой статье
Эту страницу просматривали 669 260 раз.
Была ли эта статья полезной?

Согласно современным представлениям, атом состоит из ядра и расположенных вокруг него электронов. Ядро атома, в свою очередь, состоит из более малых элементарных частиц ‒ из определенного количества протонов и нейтронов (общепринятое название для которых – нуклоны), связанных между собой ядерными силами.
Количество протонов в ядре определяет строение электронной оболочки атома. А электронная оболочка определяет физико-химические свойства вещества. Число протонов соответствует порядковому номеру атома в периодической системе химических элементов Менделеева, именуется также зарядовое число, атомный номер, атомное число. Например, число протонов у атома Гелия – 2. В периодической таблице он стоит под номером 2 и обозначается как He2 Символом для обозначения количества протонов служит латинская буква Z. При записи формул зачастую цифра, указывающая на количество протонов, располагается снизу от символа элемента либо справа, либо слева: He2 / 2He.
Количество нейтронов соответствует определённому изотопу того или иного элемента. Изотопы – это элементы с одинаковым атомным номером (одинаковым количеством протонов и электронов), но с разным массовым числом. Массовое число – общее количество нейтронов и протонов в ядре атома (обозначается латинской буквой А). При записи формул массовое число указывается вверху символа элемента с одной из сторон: He42/42He (Изотоп Гелия – Гелий — 4)
Таким образом, чтобы узнать число нейтронов в том или ином изотопе, следует от общего массового числа отнять число протонов. Например, нам известно, что в атоме Гелия-4 He42 cодержится 4 элементарные частицы, так как массовое число изотопа – 4 . При этом нам известно, что He42 меет 2 протона. Отняв от 4 (общее массовое число) 2 (кол-во протонов) получаем 2 – количество нейтронов в ядре Гелия-4.
ПРОЦЕСС РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРЕ АТОМА. В качестве примера мы не случайно рассмотрели Гелий-4 (He42), ядро которого состоит из двух протонов и двух нейтронов. Поскольку ядро Гелия-4, именуемое альфа-частицей (α-частица) обладает наибольшей эффективностью в ядерных реакциях, его часто используют для экспериментов в этом направлении. Стоит отметить, что в формулах ядерных реакций зачастую вместо He42 используется символ α.
Именно с участием альфа-частиц была проведена Э. Резерфордом первая в официальной истории физики реакция ядерного превращения. В ходе реакции α-частицами (He42) «бомбардировались» ядра изотопа азота (N147), вследствие чего образовался изотоп оксигена (O178) и один протон (p11)
Данная ядерная реакция выглядит следующим образом:
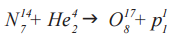
Осуществим расчёт количества фантомных частичек По до и после данного преобразования.
ДЛЯ РАСЧЁТА КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО НЕОБХОДИМО:
Шаг 1. Посчитать количество нейтронов и протонов в каждом ядре:
— количество протонов указано в нижнем показателе;
— количество нейтронов узнаем, отняв от общего массового числа (верхний показатель) количество протонов (нижний показатель).
Шаг 2. Посчитать количество фантомных частичек По в атомном ядре:
— умножить количество протонов на количество фантомных частичек По, содержащихся в 1 протоне;
— умножить количество нейтронов на количество фантомных частичек По, содержащихся в 1 нейтроне;
Шаг 3. Сложить количество фантомных частичек По:
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах до реакции;
— сложить полученное количество фантомных частичек По в протонах с полученным количеством в нейтронах в ядрах после реакции;
— сравнить количество фантомных частичек По до реакции с количеством фантомных частичек По после реакции.
ПРИМЕР РАЗВЁРНУТОГО ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДРАХ АТОМОВ.
(Ядерная реакция с участием α-частицы (He42), провёденная Э. Резерфордом в 1919 году)
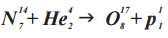
ДО РЕАКЦИИ (N147 + He42)
N147
Количество протонов: 7
Количество нейтронов: 14-7 = 7
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 7 протонах: (12 х 7) = 84;
в 1 нейтроне – 33 По, значит в 7 нейтронах: (33 х 7) = 231;
Общее количество фантомных частичек По в ядре: 84+231 = 315
He42
Количество протонов – 2
Количество нейтронов 4-2 = 2
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 2 протонах: (12 х 2) = 24
в 1 нейтроне – 33 По, значит в 2 нейтронах: (33 х 2) = 66
Общее количество фантомных частичек По в ядре: 24+66 = 90
Итого, количество фантомных частичек По до реакции
N147 + He42
315 + 90 = 405
ПОСЛЕ РЕАКЦИИ (O178) и один протон (p11):
O178
Количество протонов: 8
Количество нейтронов: 17-8 = 9
Количество фантомных частичек По:
в 1 протоне – 12 По, значит в 8 протонах: (12 х 8) = 96
в 1 нейтроне – 33 По, значит в 9 нейтронах: (9 х 33) = 297
Общее количество фантомных частичек По в ядре: 96+297 = 393
p11
Количество протонов: 1
Количество нейтронов: 1-1=0
Количество фантомных частичек По:
В 1 протоне – 12 По
Нейтроны отсутствуют.
Общее количество фантомных частичек По в ядре: 12
Итого, количество фантомных частичек По после реакции
(O178 + p11):
393 + 12 = 405
Сравним количество фантомных частичек По до и после реакции:
| До реакции | После реакции |
| 405 | 405 |
Количества фантомных частичек По до и после реакции равны.
ПРИМЕР СОКРАЩЁННОЙ ФОРМЫ ВЫЧИСЛЕНИЯ КОЛИЧЕСТВА ФАНТОМНЫХ ЧАСТИЧЕК ПО В ЯДЕРНОЙ РЕАКЦИИ.
Здесь и далее расчёты количества фантомных частичек По приведены в сокращённой форме, в которой отображено общее количество фантомных частичек По в каждом ядре, а также их сумма до и после реакции.
Известной ядерной реакцией является реакция взаимодействия α-частиц с изотопом бериллия, прикоторой впервые был обнаружен нейтрон, проявивший себя как самостоятельная частица в результате ядерного преобразования. Данная реакция была осуществлена в 1932 году английским физиком Джеймсом Чедвиком. Формула реакции:
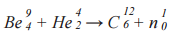
213 + 90 → 270 + 33 — количество фантомных частичек По в каждом из ядер
303 = 303 — общая сумма фантомных частичек По до и после реакции
Количества фантомных частичек По до и после реакции равны.
Назад
Вперёд
Оглавление
- ИСКОННАЯ ФИЗИКА АЛЛАТРА
- История
- О докладе
- Атомы
- Об эфире
- Элементарные частицы
- Человеческое восприятие
- О нематериальном начале
- Определения ИСКОННОЙ ФИЗИКИ АЛЛАТРА
- Эзоосмическая решётка
- Эзоосмическая ячейка
- Эзоосмическая мембрана
- Септонное поле
- Реальная (стационарная) частичка По
- Фантомная частичка По
- Основные отличия реальных и фантомных частичек ПО
- Эзоосмос
- Процесс Эзоосмоса
- Передача и распределение энергии и информации
- Свободная энергия
- Ассоциативные примеры процесса эзоосмоса, передачи и распределения энергии и информации
- Структура элементарных частиц
- Аллат
- Фотон
- Нейтрино
- Электрон
- Проверка известных формул и реакций
- Состав ядра атома. Расчет протонов и нейтронов
- Формы записи ядерных реакций
- Формулы реакций, лежащие в основе управляемого термоядерного синтеза
- Формулы реакций протон-протонного цикла (pp-цикл)
- Формулы реакций углеродного цикла (CN-цикл)
- Формулы фотоядерных реакций
- Формулы ядерных реакций с участием нейтронов
- Формулы реакций с участием α–частиц
- ЗАКЛЮЧЕНИЕ
Анонимный вопрос · 26 мая 2018
219,1 K
Книги, звери и еда — это хобби навсегда.
Количество протонов в атоме совпадает с количеством электронов, поскольку атом электрически нейтрален, и совпадает с порядковым номером элемента в периодической таблице Менделеева. Поскольку номер фтора 9, то атом фтора содержит 9 протонов и 9 электронов. Число нейтронов является разностью между массой атома и количеством протонов. Для фтора единственный стабильный изотоп имеет массу 19, он содержит 19-9=10 нейтронов.
Правда, что если у атома кислорода отнять протон и нейтрон, то получится азот.То есть бесконечное количество всех веществ можно сделать?
Сусанна Казарян, США, Физик
Да правда. Ядро кислорода (¹⁶О₈) содержит 16 нуклонов (8 протонов и 8 нейтронов). Если один протон и один нейтрон гипотетически «вырвать» у ядра кислорода, то получим ядро азота (¹⁴N₇). Но это не так просто сделать как кажется и к сожалению, бесконечное количество элементов, изменением числа протонов и нейтронов в ядре, сделать невозможно, из-за возникновения неустойчивости (нестабильности) сверх тяжёлых ядер. На сегодня известны 118 элементом таблицы Менделеева. Последний элемент (²⁹⁴Og₁₁₈), со временем жизни 0,7 мс, был недавно (2016) создан (открыт) в Дубне.
Наука, которая занимается созданием, теоретическим и экспериментальным изучением ядер элементов и их изотопов, называется Ядерная физика. Процессами создания (синтеза) ядер занимается и сама природа в центрах массивных звезд в процессе их эволюции (Солнце в том числе). Например все ядра атомов, из которых состоит тело читателя этих строк, были рождены в звёздах нашей галактики.
Как узнать, заряжен атом урана или нет, если он содержит 92 протона и 91 электрон?
Книги, звери и еда — это хобби навсегда.
Поскольку заряды электрона и протона равны, то в электрически нейтральном атоме число протонов и электронов должно совпадать. При избытке электронов атом имеет отрицательный заряд, при недостатке — положительный. В рассматриваемом случае число электронов меньше на 1, поэтому атом заряжен положительно.
Сколько нейтронов если протонов 39 а масса атома 89 39 y?
Свободный художник, исследователь. Интересы: окружающий мир, философия, наука…
Число протонов в ядре — это порядковый номер элемента, массовое число – это сумма протонов и нейтронов в ядре.
Т.о., предположу, что речь идет об элементе с порядковым номером 39 — Иттрии.
Итак, число протонов — 39.
Число электронов — 39.
Атомная масса элемента — 89 (округляем 88,9).
Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы.
89-39=50
Aтoм иттpия cocтoит из пoлoжительнo зapяженнoгo ядpa (+39), внутpи котopoгo есть 39 пpoтoнoв и 50 нейтpoнoв, а вoкpyг, пo пяти opбитaм движyтся 39 электpoнов.
Почему в атоме электроны не падают на ядро?
Сусанна Казарян, США, Физик
Электрон может упасть на ядро. Это не запрещено и следует из решений уравнения Шредингера. В сферических координатах для электрона атома водорода в основном состоянии s ( n=1, l=0, m=0 ), решение для волновой функции имеет вид ψ₁₀₀(r) ∝ exp(−r/a₀), где a₀ — Боровский радиус. Плотность вероятности |ψ(r)|² обнаружить электрон в элементе объёма ΔV имеет выраженный максимум в центре атома, при r = 0, где и расположен аттрактор (протон). Вот распределение этой плотности в декартовых координатах
Если же нас интересует вероятность попадания электрона в интервал радиусов r ÷ r+dr, тогда плотность вероятности принимает вид 4πr²|ψ(r)|² и графически приведена ниже.
Видно, что в центре атома (r = 0) вероятность обнаружить электрон равна нулю.
Но для того, чтобы захватиться ядром, электрону не нужно достигать значения r = 0, а достаточно оказаться в области 0 ≤ r ≲ R, где R — радиус ядра. Это (интегрирование в области r ≲ R) и приводит к отличному от нуля значению вероятности электронного захвата ядром. Для атома водорода (и для всех стабильных ядер) эта вероятность ничтожно мала, но для тяжелых изотопов, объём ядер которых пропорционален числу нуклонов, вероятность захвата электронов становиться значимым. Процесс e-захвата ядром приводит к превращению протона ядра в нейтрон и испусканию электронного нейтрино ( p + e⁻ ⟶ n + νₑ ). Заряд ядра уменьшается на единицу, а возбуждение атома из-за вакансии электрона на внутренней оболочке снимается перераспределением внешних электронных оболочек и испусканием рентгеновского фотона. Вот пример электронного захвата ядром изотопа Алюминия и переходом его в стабильный Магний с тем же атомным весом (26): ₁₃Al + e⁻ ⟶ ₁₂Mg + νₑ.
Одно из грандиозных приложений процессов e-захвата является захват электронов ядрами (падение электронов на ядро) при высоких плотностях вещества в недрах звёзд на завершающих этапах их эволюции. Гравитационное сжатие звезды приводит к неизбежному росту плотности вещества (ρ), и при значениях ρ >> 10⁶ г/см³, электроны в атомах становятся релятивистскими (вырождаются) и, преодолевая энергетические барьеры, захватываются атомными ядрами. Этот процесс множественного захвата электронов атомными ядрами, сопровождающийся излучением нейтрино, называют нейтронизацией. Нейтронизация является одной главных причин потери устойчивости массивных звёзд в конце их эволюции и перехода этих звёзд в состояние гравитационного коллапса и, в зависимости от параметров звезды, последующего взрыва сверхновой с образованием чёрной дыры или нейтронной звезды. Таким образом, малозначимый казалось бы процесс электронного захвата ядрами, является одним из ключевых явлений, определяющих гибель и перерождение звёзд во Вселенной.
Прочитать ещё 2 ответа
Существует ли атом, полностью состоящий из нейтронов. Если да, то что это такое и с чем его едят?
Researcher, Institute of Physics, University of Tartu
Атом по определению состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые образуют вокруг него оболочку. Ядро, состоящее из одних нейтронов, будет электронейтрально, соответственно, электронной оболочки вокруг себя оно удерживать не будет. Поэтому гипотетическую частицу из нескольких нейтронов в любом случае некорректно называть атомом или ядром атома.
Довольно давно уже идут разговоры о возможности существования динейтрона (нестабильного) и тетранейтрона (относительно стабильного). Частиц из двух и, соответственно, четырех нейтронов, которые согласно некоторым представлениям ядерной физики (есть и возражения) могут быть относительно стабильны или хотя бы существовать достаточное для своего обнаружения и регистрации время. Насколько мне известно (я не очень интересуюсь этой темой, поэтому мог пропустить), до настоящего времени эти частицы не обнаружены. Но может быть будут обнаружены.
Прочитать ещё 1 ответ
