В какой реакции водород проявляет окислительные свойства

Âîäîðîä, â ñâÿçè ñî ñâîèì óíèêàëüíûì ñòðîåíèåì, ìîæåò îáëàäàòü è îêèñëèòåëüíîé, è âîññòàíîâèòåëüíîé ñïîñîáíîñòüþ. Ðàññìîòðèì âîññòàíîâèòåëüíóþ ñïîñîáíîñòü âîäîðîäà. Òóò ñòåïåíü îêèñëåíèÿ ó ñîåäèíåíèé âîäîðîäà ðàâíà +1. Ýíåðãèÿ ñâÿçè â ìîëåêóëå âåëèêà, ÷òî ãîâîðèò î ìàëîé àêòèâíîñòè ìîëåêóëÿðíîãî âîäîðîäà â íîðìàëüíûõ óñëîâèÿõ.
Ïðè îáû÷íîé òåìïåðàòóðå âîäîðîä ðåàãèðóåò ñ àòîìîì ôòîðà (â òåìíîòå) è õëîðà (ïðè ñâåòå):
H2 + F2 = 2HF,
H2 + Cl2 = 2HCl.
Ïðè óâåëè÷åíèè òåìïåðàòóðû âîäîðîä ìîæåò âñòóïàòü â ðåàêöèè ñ êèñëîðîäîì, ïðè ýòîì ðåàêöèÿ ýêçîòåðìè÷åñêàÿ (èäåò ñ âûäåëåíèåì áîëüøîãî êîëè÷åñòâà òåïëîòû).
Ñ áðîìîì âîäîðîä ðåàãèðóåò îáðàòèìî, ñ éîäîì òîæå. Äëÿ ðåàêöèè âîäîðîäà ñ àçîòîì è ñåðîé íåîáõîäèìî îáåñïå÷èòü îïòèìàëüíûå óñëîâèÿ äëÿ ïðîâåäåíèÿ ýòîé ðåàêöèè (íàëè÷èå êàòàëèçàòîðà è âûñîêîãî äàâëåíèÿ).
Âîäîðîä ðåàãèðóåò ñî ñëîæíûìè ñîåäèíåíèÿìè:
CuO + H2 = Cu + H2O,
C2H2 + H2 = C2H4.
Îêèñëèòåëüíàÿ ñïîñîáíîñòü âîäîðîäà òîæå ÷àñòî âñòðå÷àåòñÿ â õèìè÷åñêîì ðàçíîîáðàçèè. Ïðè ðåàêöèÿõ ñ àêòèâíûìè ìåòàëëàìè (ïðè ïîâûøåíèè òåìïåðàòóðû è äàâëåíèè) âîäîðîä âûñòóïàåò â êà÷åñòâå îêèñëèòåëÿ, òåì ñàìûì îáðàçóåò ãèäðèäû, ãäå ñòåïåíü îêèñëåíèÿ ó àòîìà âîäîðîäà ðàâíà -1:
2Na + H2 = 2NaH,
Ãèäðèäû ïî ñâîåé ïðèðîäå ïðåäñòàâëÿþò êðèñòàëëè÷åñêèå ñîåäèíåíèÿ. Íàïîìèíàþùèå ÷åì-òî ïîâàðåííóþ ñîëü. Íî ïî õèìè÷åñêîé ïðèðîäå îíè èìåþò ñóùåñòâåííûå ðàçëè÷èÿ:
Ïðè âçàèìîäåéñòâèè ñ âîäîé ãèäðèäû ðàñïàäàþòñÿ, îáðàçóÿ ùåëî÷ü è âîäîðîä:
NaH + H2O = NaOH + H2,
Òàêæå èõ ìîæíî íàãðåòü:
2NaH = 2Na + H2,
Àòîìàðíûé âîäîðîä (Í) ñïîñîáåí óæå ïðè êîìíàòíûõ óñëîâèÿõ ðåàãèðîâàòü ñ ñåðîé, àçîòîì, áðîìîì, â ðåçóëüòàòå îáðàçóþòñÿ òàêèå æå ñîåäèíåíèÿ, êàê è ïðè ðåàêöèè ìîëåêóëÿðíîãî âîäîðîäà (H2).
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìè÷åñêèå ýëåìåíòû | |
| Õèìè÷åñêèå ýëåìåíòû Ïåðèîäè÷åñêîé ñèñòåìû Ìåíäåëååâà, ñâîéñòâà, âàëåíòíîñòü õèìè÷åñêèõ ýëåìåíòîâ | |
| Õèìè÷åñêèå ýëåìåíòû | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Âîäîðîä. Ïðèìåíåíèå âîäîðîäà. | |
| Áëàãîäàðÿ ñâîåìó óíèêàëüíîìó ñòðîåíèþ è ñâîéñòâàì , âîäîðîä íàøåë ñâîå øèðîêîå ïðèìåíåíèå â ðàçëè÷íûõ îáëàñòÿõ ïðîìûøëåííîñòè. | |
| Âîäîðîä. Ïðèìåíåíèå âîäîðîäà. | |
Химические свойства
водорода
При обычных условиях молекулярный Водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами.
Водород вступает в реакции с простыми и сложными веществами:

— Взаимодействие водорода с металлами приводит к образованию сложных веществ — гидридов, в химических формулах которых атом металла всегда стоит на первом месте:

При высокой температуре Водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя белые кристаллические вещества — гидриды металлов (LiН, NaН, КН, СаН2 и др.):
Н2 + 2Li = 2LiH
Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
— При взаимодействии водорода с неметаллами образуются летучие водородные соединения. В химической формуле летучего водородного соединения, атом водорода может стоять как на первом так и на втором месте, в зависимости от местонахождения в ПСХЭ (см. табличку в слайде):

1). С кислородом
Водород образует воду:
Видео «Горение водорода»
2Н2 + О2 = 2Н2О + Q
При обычных температурах реакция протекает крайне
медленно, выше 550°С — со взрывом (смесь
2 объемов Н2 и 1 объема О2 называется гремучим газом).
Видео «Взрыв гремучего газа»
Видео «Приготовление и взрыв гремучей смеси»
2). С галогенами
Водород образует галогеноводороды, например:
Н2 + Cl2 = 2НСl
При этом с фтором Водород взрывается (даже в темноте и
при — 252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а
с йодом только при нагревании.
3). С азотом
Водород взаимодействует с образованием аммиака:
ЗН2 + N2 = 2NН3
лишь на катализаторе и при повышенных температуpax и
давлениях.
4). При нагревании Водород энергично реагирует с серой:
Н2 + S = H2S (сероводород),
значительно труднее с селеном и теллуром.
5). С чистым
углеродом Водород может реагировать без катализатора только при высоких
температуpax:
2Н2 + С (аморфный) = СН4 (метан)
— Водород вступает в реакцию замещения с оксидами металлов, при этом образуются в продуктах вода и восстанавливается металл. Водород — проявляет свойства восстановителя:

Водород используется для восстановления многих металлов, так как отнимает кислород у их
оксидов:
CuO + H2 = Cu + H2O,
Fe3O4 + 4H2 = 3Fe +
4Н2О, и т. д.
Применение
водорода
Видео «Применение водорода»
В настоящее время водород получают в огромных
количествах. Очень большую часть его используют при синтезе аммиака,
гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме
того, водород применяют для синтеза соляной кислоты, метилового спирта,
синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп
накаливания и драгоценных камней. В продажу водород поступает в баллонах под
давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной
надписью «Водород».
Водород используется для
превращения жидких жиров в твердые (гидрогенизация), производства жидкого
топлива гидрогенизацией углей и мазута. В металлургии водород используют как
восстановитель оксидов или хлоридов для получения металлов и неметаллов
(германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.).
Практическое применение водорода
многообразно: им обычно заполняют шары-зонды, в химической промышленности он
служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в
пищевой — для выработки из растительных масел твёрдых жиров и т. д. Высокая
температура (до 2600 °С), получающаяся при горении водорода в кислороде,
используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород
является одним из наиболее эффективных реактивных топлив. Ежегодное мировое
потребление водорода превышает 1 млн. т.
ТРЕНАЖЕРЫ
№1. Химические свойства водорода
№2. Водород
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Задание №1
Составьте уравнения реакций взаимодействия водорода со следующими веществами: F2, Ca, Al2O3, оксидом ртути (II), оксидом вольфрама (VI). Назовите продукты реакции, укажите типы реакций.
Задание №2
Осуществите превращения по схеме:
H2O -> H2 -> H2S -> SO2
Задание №3.
Вычислите массу воды, которую можно получить при сжигании 8 г водорода?
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) — самый легкий химический элемент, при обычных условиях — газ
без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород — самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.

Получение
В промышленности водород получают различными методами:
- Конверсия с водяным паром при t = 1000 °C
- Методом газификации угля, торфа, сланца
- Электролизом водных растворов щелочей
- Каталитическим окислением кислородом (неполное окисление)
CH4 + H2O → CO + H2
C + H2O → CO + H2
H2O → H2↑ + O2↑
CH4 + O2 → CO + H2

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
- Вытеснением водорода из кислот
- Гидролизом гидридов
- Взаимодействием активных металлов с водой
- Реакцией цинка или алюминия с раствором щелочи
Fe + HCl → FeCl2 + H2↑
CaH2 + H2O → Ca(OH)2 + H2↑
Ca + H2O → Ca(OH)2 + H2↑
Al + NaOH + H2O → Na[Al(OH)4] + H2↑
Химические свойства
- Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных
реакция идет только со фтором. - Как окислитель реагирует с металлами
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых
выше, чем у водорода:
H2 + O2 → (t) H2O
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)
H2 + N2 → NH3
H2 + S → H2S
H2 + ZnO → Zn + H2O

Na + H2 → NaH (гидрид натрия)
Mg + H2 → MgH2
Вода
Химические свойства:
- Реакция с металлами
- Реакции с основными и кислотными оксидами
- Гидролиз солей
- Реакция с гидридами активных металлов
- Реакции с C, CO, CH4
- С галогенами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
K + H2O → KOH + H2
Реагирует с основными оксидами — с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами —
с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
CaO + H2O → Ca(OH)2
P2O5 + H2O → H3PO4
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3),
а другой — по аниону (Na2CO3).
Na2CO3 + CrBr3 + H2O → Cr(OH)3↓ + CO2 + NaBr
LiH + H2O → LiOH + H2↑
C + H2O → CO + H2
H2O + CO → (кат.) CO2 + H2
H2O + CH4 → (кат.) CO + H2
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты — без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты — при нагревании)

Кристаллогидраты
Кристаллогидраты — кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в
состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O,
Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O.
Медный купорос имеет характерный голубой цвет, а безводный сульфат меди — белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует
вычесть кристаллизационную воду и найти массу безводного сульфата калия.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
K2O2 + H2O → KOH + H2O2
BaO2 + H2SO4 → BaSO4 + H2O2
В разбавленных растворах пероксид водорода легко разлагается:
H2O2 → H2O + H2↑
Также перекись проявляет окислительные свойства:
KCl + H2O2 + H2SO4 → Cl2 + K2SO4 + H2O

Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки,
предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Каждый химический элемент в периодической системе имеет свое определенное место положения, которое отражает проявляемые им свойства и говорит о его электронном строении. Однако есть среди всех один особый атом, который занимает сразу две ячейки. Он располагается в двух совершенно противоположных по проявляемым свойствам группах элементов. Это водород. Такие особенности делают его уникальным.
Водород — это не просто элемент, но и простое вещество, а также составная часть многих сложных соединений, биогенный и органогенный элемент. Поэтому рассмотрим его характеристики и свойства подробнее.

Водород как химический элемент
Водород — это элемент первой группы главной подгруппы, а также седьмой группы главной подгруппы в первом малом периоде. Данный период состоит всего из двух атомов: гелия и рассматриваемого нами элемента. Опишем основные особенности положения водорода в периодической системе.
- Порядковый номер водорода — 1, количество электронов такое же, соответственно, протонов столько же. Атомная масса — 1,00795. Существует три изотопа данного элемента с массовыми числами 1, 2, 3. Однако свойства каждого из них очень сильно различаются, так как увеличение массы даже на единицу именно для водорода является сразу двойным.
- То, что на внешнем энергетическом уровне он содержит всего один электрон, позволяет успешно проявлять ему как окислительные, так и восстановительные свойства. Кроме того, после отдачи электрона у него остается свободная орбиталь, которая принимает участие в образовании химических связей по донорно-акцепторному механизму.
- Водород — это сильный восстановитель. Поэтому основным местом его считается первая группа главной подгруппы, где он возглавляет самые активные металлы — щелочные.
- Однако при взаимодействии с сильными восстановителями, такими как, например, металлы, он может быть и окислителем, принимая электрон. Данные соединения получили название гидридов. По этому признаку он возглавляет подгруппу галогенов, с которыми является схожим.
- Благодаря совсем маленькой атомной массе, водород считается самым легким элементом. Кроме того, его плотность также очень мала, поэтому он также является эталоном легкости.
Таким образом, очевидно, что атом водорода — это совершенно уникальный, непохожий на все остальные элемент. Следовательно, свойства его тоже особенные, а образуемые простые и сложные вещества очень важны. Рассмотрим их далее.
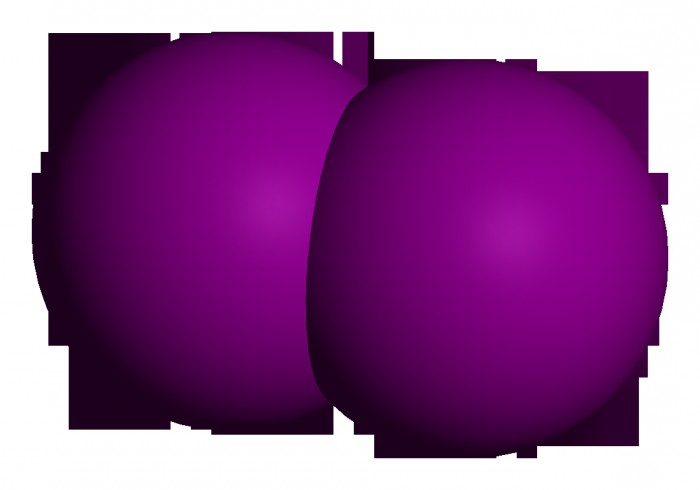
Простое вещество
Если говорить о данном элементе как о молекуле, то нужно сказать, что она двухатомна. То есть водород (простое вещество) — это газ. Формула его эмпирическая будет записываться как Н2, а графическая — через одинарную сигма-связь Н-Н. Механизм образования связи между атомами — ковалентный неполярный.
Еще Генри Кавендиш в 1766 году сумел открыть данное вещество. Именно он и доказал, что водород — это газ, причем такой, который способен взрываться на воздухе. Позже были хорошо изучены свойства, стало ясно, что данное вещество — самое легкое среди известных.
Еще позже Лавуазье дал название (как элементу, так и веществу на его основе) на латыни — hydrogenium, что в переводе означает «рождающий воду». В 1781 году первооткрыватель данного элемента Генри Кавендиш доказал, что вода — сочетание водорода и кислорода, то есть это продукт их взаимодействия. А о том, что легкий газ еще и очень горючий, было известно еще в XVI веке, это отражалось в записях Парацельса.
Таким образом, молекулярный водород — это очень распространенное в природе и образующееся естественным путем газообразное соединение, состоящее из двух атомов, которое способно взрываться на воздухе. Кроме того, молекула может распадаться на атомы, которые принимают участие в ядерных реакциях, превращаясь в ядра гелия. Данные процессы непрерывно происходят на Солнце и в космосе, которые и являются основными поставщиками данного соединения.
Водород — это вещество, которое способно проявлять себя и как окислитель, и как восстановитель. Также оно находит себе очень широкое применение в деятельности человека.

Физические свойства
Физические параметры водород имеет следующие:
- Температура кипения — (-252,76 0С).
- Температура плавления — (-259,2 0С).
- В обозначенном интервале температур является бесцветной жидкостью, не имеющей запаха.
- При очень высоком давлении существуют снегообразные кристаллы твердого водорода.
- При определенных условиях (высокое давление и низкие температуры) способен переходить в металлическое состояние.
- Практически нерастворим в воде, поэтому возможен сбор методом вытеснения воды при получении в лабораторных условиях.
- При обычных условиях водород — это газ, не имеющий запаха, цвета и вкуса.
- Является горючим и взрывоопасным веществом.
- Хорошо растворяется в металлах, так как способен диффундировать сквозь их толщу.
- Примерно в 14,5 раз данный газ легче воздуха.
Кристаллическая решетка простого вещества молекулярная, связи слабые, поэтому легко разрушаются.
Химические свойства
Как уже говорилось выше, водород способен проявлять как восстановительные, так и окислительные свойства. Возможные степени окисления элемента +1; -1. Поэтому его часто используют в промышленности для синтезов и различных реакций.
Окислительные свойства водорода
- Взаимодействие с активными металлами (щелочными и щелочноземельными) при обычных условиях приводит к образованию солеподобных соединений, называемых гидридами. Например: LiH, CaH2, KH, MgH2 и прочие.
- Соединения с малоактивными металлами под воздействием высоких температур или сильной освещенности (фотохимическая инициация реакций) также образуют гидриды.
Восстановительные свойства водорода
- Взаимодействие при обычных условиях только с фтором (как сильным окислителем). В результате образуется фтороводород или плавиковая кислота HF.
- Взаимодействие практически со всеми неметаллами, но при определенных достаточно жестких условиях. Примеры соединений: H2S, NH3, H2O, PH3, SiH4 и прочие.
- Восстанавливает металлы из их оксидов до простых веществ. Это один из промышленных способов получения металлов, называющийся водородотермией.
Отдельно следует выделить реакции, которые используются в органических синтезах. Они называются гидрированием — насыщением водородом и дегидрированием, то есть его отщеплением от молекулы. На основании этих способов превращений получают множество углеводородов и других органических соединений.
Нахождение в природе
Водород — это самое распространенное вещество на нашей планете и за ее пределами. Ведь практически все межзвездное пространство и звезды состоят именно из этого соединения. В космосе он может существовать в виде:
- плазмы;
- газа;
- ионов;
- атомов;
- молекул.
Существует несколько видов различных по плотности облаков, состоящих именно из этого вещества.
Если говорить о распространении конкретно в земной коре, то водород стоит на втором месте по числу атомов после кислорода, его приблизительно 17%. В свободном виде встречается редко, лишь в незначительных количествах в составе сухого воздуха. Самое распространенное соединение данного элемента — вода. Именно в ее составе он и встречается на планете.
Также водород является обязательной составной частью любого живого организма. Причем в теле человека на долю этого атома приходится 63%. Водород — это органогенный элемент, поэтому формирует молекулы белков, жиров, углеводов и нуклеиновых кислот, а также многих других жизненно важных соединений.

Получение
Существуют разные способы получения рассматриваемого нами газа. К ним относится несколько промышленных и лабораторных вариантов синтеза.
Промышленные способы получения водорода:
- Паровая конверсия метана.
- Газификация угля — процесс подразумевает нагревание угля до 1000 0С, в результате чего образуется водород и высокоуглеродный уголь.
- Электролиз. Данный метод может использоваться только для водных растворов различных солей, так как расплавы не приводят к разряжению воды на катоде.
Лабораторные способы получения водорода:
- Гидролиз гидридов металлов.
- Действие разбавленных кислот на активные металлы и средней активности.
- Взаимодействие щелочных и щелочноземельных металлов с водой.
Чтобы собрать образующийся водород, необходимо держать пробирку перевернутой вверх дном. Ведь данный газ нельзя собрать так, как, например, углекислый газ. Это водород, он намного легче воздуха. Быстро улетучивается, а в больших количествах при смешении с воздухом взрывается. Поэтому и следует переворачивать пробирку. После ее заполнения ее нужно закрыть резиновой пробкой.
Чтобы проверить чистоту собранного водорода, следует поднести к горлышку зажженную спичку. Если хлопок глухой и тихий — значит газ чистый, с минимальными примесями воздуха. Если же громкий и свистящий — грязный, с большой долей посторонних компонентов.

Области использования
При сгорании водорода выделяется настолько большое количество энергии (теплоты), что данный газ считается самым выгодным топливом. К тому же экологически чистым. Однако на сегодняшний день его применение в данной области ограничено. Это связано с непродуманными до конца и не решенными проблемами синтеза чистого водорода, который был бы пригоден для использования в качестве топлива в реакторах, двигателях и портативных устройствах, а также отопительных котлах жилых домов.
Ведь способы получения данного газа достаточно дорогостоящие, поэтому прежде необходимо разработать особый метод синтеза. Такой, который позволит получать продукт в большом объеме и с минимальными затратами.
Можно выделить несколько основных областей, в которых находит применение рассматриваемый нами газ.
- Химические синтезы. На основании гидрирования получают мыла, маргарины, пластмассы. При участии водорода синтезируется метанол и аммиак, а также другие соединения.
- В пищевой промышленности — как добавка Е949.
- Авиационная промышленность (ракетостроение, самолетостроение).
- Электроэнергетика.
- Метеорология.
- Топливо экологически чистого вида.
Очевидно, что водород так же важен, как и распространен в природе. Еще большую роль играют образуемые им различные соединения.

Соединения водорода
Это сложные, содержащие атомы водорода вещества. Можно выделить несколько основных типов подобных веществ.
- Галогеноводороды. Общая формула — HHal. Особое значение среди них имеет хлорид водорода. Это газ, который растворяется в воде с образованием раствора соляной кислоты. Данная кислота находит широкое применение практически во всех химических синтезах. Причем как органических, так и неорганических. Хлорид водорода — это соединение, имеющее эмпирическую формулу HCL и являющееся одним из крупнейших по объемам производства в нашей стране ежегодно. Также к галогеноводородам относятся йодоводород, фтороводород и бромоводород. Все они образуют соответствующие кислоты.
- Летучие водородные соединения неметаллов. Практически все они достаточно ядовитые газы. Например, сероводород, метан, силан, фосфин и прочие. При этом очень горючие.
- Гидриды — соединения с металлами. Относятся к классу солей.
- Гидроксиды: основания, кислоты и амфотерные соединения. В их состав обязательно входят атомы водорода, один или несколько. Пример: NaOH, K2[AL(OH)4], H2SO4 и прочие.
- Гидроксид водорода. Это соединение больше известно как вода. Другое название оксид водорода. Эмпирическая формула выглядит так — Н2О.
- Пероксид водорода. Это сильнейший окислитель, формула которого имеет вид Н2О2.
- Многочисленные органические соединения: углеводороды, белки, жиры, липиды, витамины, гормоны, эфирные масла и прочие.
Очевидно, что разнообразие соединений рассматриваемого нами элемента очень велико. Это еще раз подтверждает его высокое значение для природы и человека, а также для всех живых существ.
Оксид водорода — это лучший растворитель
Как уже упоминалось выше, простонародное название данного вещества — вода. Состоит из двух атомов водорода и одного кислорода, соединенных между собой ковалентными полярными связями. Молекула воды является диполем, это объясняет многие проявляемые ею свойства. В частности то, что она является универсальным растворителем.
Именно в водной среде происходят практически все химические процессы. Внутренние реакции пластического и энергетического обмена в живых организмах также осуществляются с помощью оксида водорода.
Вода по праву считается самым важным веществом на планете. Известно, что без нее не сможет жить ни один живой организм. На Земле она способна существовать в трех агрегатных состояниях:
- жидкость;
- газ (пар);
- твердое (лед).
В зависимости от изотопа водорода, входящего в состав молекулы, различают три вида воды.
- Легкая или протиевая. Изотоп с массовым числом 1. Формула — Н2О. Это привычная форма, которую используют все организмы.
- Дейтериевая или тяжелая, ее формула — D2O. Содержит изотоп 2Н.
- Сверхтяжелая или тритиевая. Формула выглядит как Т3О, изотоп — 3Н.
Очень важны запасы пресной протиевой воды на планете. Уже сейчас во многих странах ощущается ее недостаток. Разрабатываются способы обработки соленой воды с целью получения питьевой.
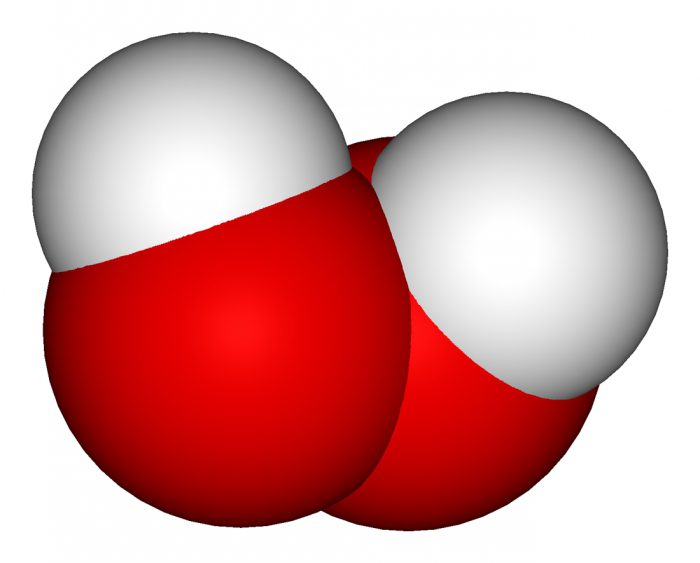
Пероксид водорода — это универсальное средство
Данное соединение, как уже упоминалось выше, прекрасный окислитель. Однако с сильными представителями может вести себя и как восстановитель тоже. Кроме того, обладает выраженным бактерицидным эффектом.
Другое название данного соединения — перекись. Именно в таком виде его используют в медицине. 3% раствор кристаллогидрата рассматриваемого соединения — это медицинское лекарство, которое применяют для обработки небольших ран с целью их обеззараживания. Однако доказано, что при этом заживление ранения по времени увеличивается.
Также пероксид водорода используется в ракетном топливе, в промышленности для дезинфекции и отбеливания, в качестве пенообразователя для получения соответствующих материалов (пенопласта, например). Кроме того, перекись помогает очищать аквариумы, обесцвечивать волосы и отбеливать зубы. Однако при этом наносит вред тканям, поэтому специалистами в этих целях не рекомендуется.
