В какой реакции углерод проявляет восстановительные свойства
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO 3(конц.) → (t) CO2 + NO2 + H2
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания),
кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного
газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа —
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)

Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства углерода
Углерод способен образовывать несколько аллотропных модификаций. Это алмаз (наиболее инертная аллотропная модификация), графит, фуллерен и карбин.
Древесный уголь и сажа представляют собой аморфный углерод. Углерод в таком состоянии не имеет упорядоченной структуры и фактически состоит из мельчайших фрагментов слоев графита. Аморфный углерод, обработанный горячим водяным паром, называют активированным углем. 1 грамм активированного угля из-за наличия в нем множества пор имеет общую поверхность более трехсот квадратных метров! Благодаря своей способности поглощать различные вещества активированный уголь находит широкое применение как наполнитель фильтров, а также как энтеросорбент при различных видах отравлений.
С химической точки зрения аморфный углерод является наиболее активной его формой, графит проявляет среднюю активность, а алмаз является крайне инертным веществом. По этой причине, рассматриваемые ниже химические свойства углерода следует прежде всего относить к аморфному углероду.
Восстановительные свойства углерода
Как восстановитель углерод реагирует с такими неметаллами как, например, кислород, галогены, сера.
В зависимости от избытка или недостатка кислорода при горении угля возможно образование угарного газа CO или углекислого газа CO2:
При взаимодействии углерода со фтором образуется тетрафторид углерода:
При нагревании углерода с серой образуется сероуглерод CS2:
Углерод способен восстанавливать металлы после алюминия в ряду активности из их оксидов. Например:
Также углерод реагирует и с оксидами активных металлов, однако в этом случае наблюдается, как правило, не восстановление металла, а образование его карбида:
Взаимодействие углерода с оксидами неметаллов
Углерод вступает в реакцию сопропорционирования с углекислым газом CO2:
Одним из наиболее важных с промышленной точки зрения процессов является так называемая паровая конверсия угля. Процесс проводят, пропуская водяной пар через раскаленный уголь. При этом протекает следующая реакция:
При высокой температуре углерод способен восстанавливать даже такое инертное соединение как диоксид кремния. При этом в зависимости от условия возможно образование кремния или карбида кремния (карборунда):
Также углерод как восстановитель реагирует с кислотами окислителями, в частности, концентрированными серной и азотной кислотами:
Окислительные свойства углерода
Химический элемент углерод не отличается высокой электроотрицательностью, поэтому образуемые им простые вещества редко проявляют окислительные свойства по отношению к другим неметаллам.
Примером таких реакций является взаимодействие аморфного углерода с водородом при нагревании в присутствии катализатора:
а также с кремнием при температуре 1200-1300 оС:
Окислительные свойства углерод проявляет по отношению к металлам. Углерод способен реагировать с активными металлами и некоторыми металлами средней активности. Реакции протекают при нагревании:
Карбиды активных металлов гидролизуются водой:
а также растворами кислот-неокислителей:
При этом образуются углеводороды, содержащие углерод в той же степени окисления, что и в исходном карбиде.
Химические свойства кремния
Кремний может существовать, как и углерод в кристаллическом и аморфном состоянии и, также, как и в случае углерода, аморфный кремний существенно более химически активен, чем кристаллический.
Иногда аморфный и кристаллический кремний, называют его аллотропными модификациями, что, строго говоря, не совсем верно. Аморфный кремний представляет собой по сути конгломерат беспорядочно расположенных друг относительно друга мельчайших частиц кристаллического кремния.
Взаимодействие кремния с простыми веществами
неметаллами
При обычных условиях кремний ввиду своей инертности реагирует только со фтором:
С хлором, бромом и йодом кремний реагирует только при нагревании. При этом характерно, что в зависимости от активности галогена, требуется и соответственно различная температура:
Так с хлором реакция протекает при 340-420 оС:
С бромом – 620-700 оС:
С йодом – 750-810 оС:
Все галогениды кремния легко гидролизуются водой:
а также растворами щелочей:
Реакция кремния с кислородом протекает, однако требует очень сильного нагревания (1200-1300оС) ввиду того, что прочная оксидная пленка затрудняет взаимодействие:
При температуре 1200-1500 оС кремний медленно взаимодействует с углеродом в виде графита с образованием карборунда SiC – вещества с атомной кристаллической решеткой подобной алмазу и почти не уступающего ему в прочности:
С водородом кремний не реагирует.
металлами
Ввиду своей низкой электроотрицательности кремний может проявлять окислительные свойства лишь по отношению к металлам. Из металлов кремний реагирует с активными (щелочными и щелочноземельными), а также многими металлами средней активности. В результате такого взаимодействия образуются силициды:
Силициды активных металлов легко гидролизуются водой или разбавленными растворами кислот-неокислителей:
При этом образуется газ силан SiH4 – аналог метана CH4.
Взаимодействие кремния со сложными веществами
С водой кремний не реагирует даже при кипячении, однако аморфный кремний взаимодействует с перегретым водяным паром при температуре около 400-500оС. При этом образуется водород и диоксид кремния:
Из всех кислот кремний (в аморфном состоянии) реагирует только с концентрированной плавиковой кислотой:
Кремний растворяется в концентрированных растворах щелочей. Реакция сопровождается выделением водорода:
Углерод — химический элемент № (6). Он расположен в IVА группе Периодической системы.
C6+6)2e)4e
На внешнем слое атома углерода содержатся четыре валентных электрона, и до его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами углероду характерна степень окисления (–4), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления: ( +2) или (+4).
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ. В земной коре распространены карбонаты (например, CaCO3 образует мел, мрамор, известняк). Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений, главным элементом которых является углерод.
Углерод относится к жизненно важным элементам, так как входит в состав молекул всех органических веществ.
Углерод образует несколько аллотропных видоизменений, из которых наиболее известны алмаз и графит.
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.
Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.
Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.
Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления ((3700) °С).
Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа, древесный уголь и кокс. Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией.
Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные, и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
- Взаимодействие с металлами.
Углерод реагирует с металлами при высокой температуре с образованием карбидов:
4Al0+3C0=tAl+34C−43.
В этой реакции углерод выступает как окислитель.
- Взаимодействие с водородом.
Реакция происходит при сильном нагревании. Образуется метан. Углерод — окислитель.
C0+2H02=tC−4H+14.
- Взаимодействие с кислородом.
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
C0+O02=tC+4O−22.
- Взаимодействие с оксидами металлов.
Углерод способен восстанавливать металлы из их оксидов:
2Cu+2O+C0=t2Cu0+C+4O2.
Применение простых веществ
Алмаз применяется:
- для обработки твёрдых поверхностей;
- для резки стекла;
- для изготовления буров и свёрл;
- для изготовления ювелирных украшений.
Графит используется:
- при изготовлении карандашей;
- как твёрдая смазка в подшипниках;
- для изготовления электродов;
- в качестве замедлителя нейтронов в ядерных реакторах;
- для получения искусственных алмазов.
Сажа:
- входит в состав типографской краски, крема для обуви;
- используется как наполнитель для производства резины.
Уголь используется:
- в противогазах, промышленных и бытовых фильтрах;
- для очистки сахарного сиропа, спирта и т. д.;
- в медицине.
Кокс применяется в металлургической промышленности.
Полный курс химии вы можете найти на моем сайте CHEMEGE.RU. Чтобы получать актуальные материалы и новости ЕГЭ по химии, вступайте в мою группу в ВКонтакте или на Facebook. Если вы хотите подготовиться к ЕГЭ по химии на высокие баллы, приглашаю на онлайн-курс «40 шагов к 100 баллам на ЕГЭ по химии«.
1. Положение углерода в периодической системе химических элементов
2. Электронное строение углерода
3. Физические свойства и нахождение в природе
4. Качественные реакции
5. Химические свойства
5.1. Взаимодействие с простыми веществами
5.1.1. Взаимодействие с галогенами
5.1.2. Взаимодействие с серой и кремнием
5.1.3. Взаимодействие с водородом и фосфором
5.1.4. Взаимодействие с азотом
5.1.5. Взаимодействие с активными металлами
5.1.6. Горение
5.2. Взаимодействие со сложными веществами
5.2.1. Взаимодействие с водой
5.2.2. Взаимодействие с оксидами металлов
5.2.3. Взаимодействие с серной кислотой
5.2.4. Взаимодействие с азотной кислотой
5.2.5. Взаимодействие с солями
Бинарные соединения углерода — карбиды
Оксид углерода (II)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с кислородом
3.2. Взаимодействие с хлором
3.3. Взаимодействие с водородом
3.4. Взаимодействие с щелочами
3.5. Взаимодействие с оксидами металлов
3.6. Взаимодействие с прочими окислителями
Оксид углерода (IV)
1. Строение молекулы и физические свойства
2. Способы получения
3. Химические свойства
3.1. Взаимодействие с основными оксидами и основаниями
2.3. Взаимодействие с карбонатами и гидрокарбонатами
2.4. Взаимодействие с восстановителями
Карбонаты и гидрокарбонаты
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
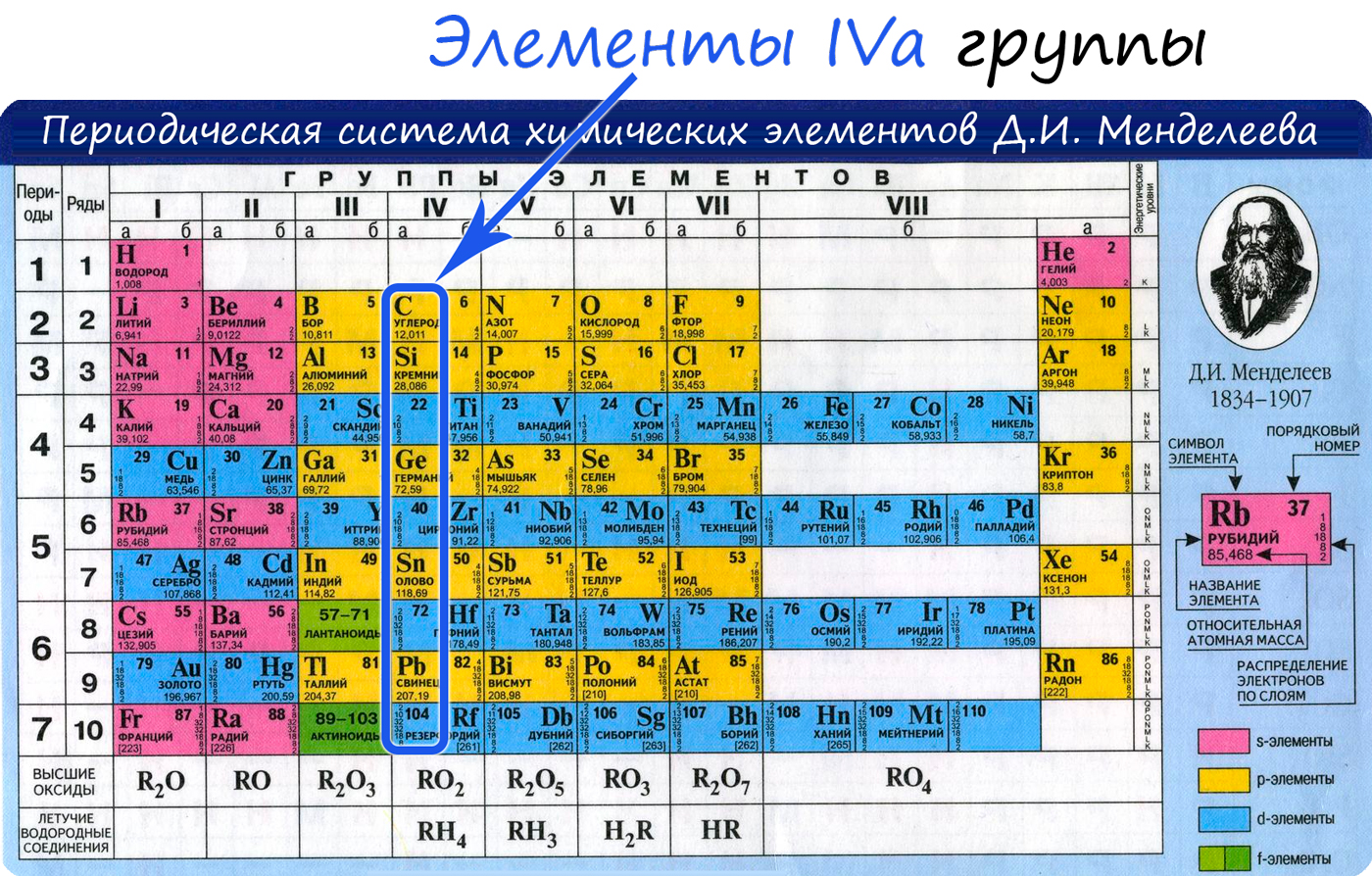
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии
Электронная конфигурация углерода в возбужденном состоянии
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до +4.
Характерные степени окисления -4, 0, +2, +4.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз — это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp³-гибридизации.
Алмаз
Кристаллы алмаза
Графит — это аллотропная модификация, в которой атомы углерода находятся в состоянии sp² -гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Графит
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n
Карбин
Карбин
Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С₆₀, С₇₀ и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
Фуллерен
В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Качественная реакция на карбонат-ионы CO₃²⁻ — взаимодействие солей-карбонатов с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение – углекислый газ.
Например, карбонат кальция растворяется в соляной кислоте:
CaCO₃ + 2HCl → CaCl₂ + H₂O + CO₂
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO₂ – помутнение известковой воды при пропускании через нее углекислого газа:
CO₂ + Ca(OH)₂ → CaCO₃ + H₂O
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
CaCO₃ + CO₂ + H₂O → Ca(HCO₃)₂
Карбонат кальция с углекислым газом
Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО₂ не поддерживает горение. Угарный газ CO горит голубым пламенем.
Горение угарного газа
Соединения углерода
Основные степени окисления углерода — +4, +2, 0, -1 и -4.
Наиболее типичные соединения углерода:
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
- Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
C + 2F₂ → CF₄
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS₂
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С + 2Н₂ → СН₄
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N₂ → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al → Al₄C₃
2C + Ca → CaC₂
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O₂ → CO₂
при недостатке кислорода образуется угарный газ СО:
2C + O₂ → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде
Графит также горит
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
CO + H₂ + O → C + 2O + H₂O
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
2ZnO + C → 2Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe₃O₄ → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС₂ + СО
9С + 2Al₂O₃ → Al₄C₃ + 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
C + 2H₂SO₄(конц) → CO₂ + 2SO₂ + 2H₂O
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
C + 4HNO₃ (конц) → CO₂ + 4NO₂ + 2H₂O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натрия до сульфида натрия:
4C + Na₂SO₄ → Na₂S + 4CO
Карбиды
Карбиды – это соединения элементов с углеродом. Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
Создать карусель Добавьте описание
Все карбиды проявляют свойства восстановителей и могут быть окислены сильными окислителями.
Например, карбид кремния окисляется концентрированной азотной кислотой при нагревании до углекислого газа, оксида кремния (IV) и оксида азота (II):
SiC + 8HNO₃ → 3SiO₂ + 3CO₂ + 8NO + 4H₂O
Оксид углерода (II)
Строение молекулы и физические свойства
Оксид углерода (II) («угарный газ») – это газ без цвета и запаха. Сильный яд. Небольшая концентрация угарного газа в воздухе может вызвать сонливость и головокружение. Большие концентрации угарного газа вызывают удушье.
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:
Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H₂O
H₂C₂O₄ → CO + CO₂ + H₂O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
C + O₂ → CO₂
CO₂ + C → 2CO
Еще один важный промышленный способ получения угарного газа — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
СН₄ + Н₂O → СО + 3Н₂
Также возможна паровая конверсия угля:
CO + H₂ + O → C + 2O + H₂O
Угарный газ в промышленности также можно получать неполным окислением метана:
2СН₄ + О₂ → 2СО + 4Н₂
Химические свойства
Оксид углерода (II) – несолеобразующий оксид. За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
- Угарный газ горит в атмосфере кислорода. Пламя окрашено в синий цвет:
2СO + O₂ → 2CO₂
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
CO + Cl₂ → COCl₂
3. Угарный газ взаимодействует с водородом при повышенном давлении. Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например, под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
СО + 2Н₂ → СН₃ОН
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например, угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов.
Например, оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
3CO + Fe₂O₃ → 2Fe + 3CO₂
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO₂
СО + NiO → Ni + CO₂
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например, пероксидом натрия:
CO + Na₂O₂ → Na₂CO₃
Оксид углерода (IV)
Строение молекулы и физические свойства
Оксид углерода (IV) (углекислый газ) — газ без цвета и запаха. Тяжелее воздуха. Замороженный углекислый газ называют так?
