В какой реакции аммиак проявляет основные свойства

Аммиак – NH3

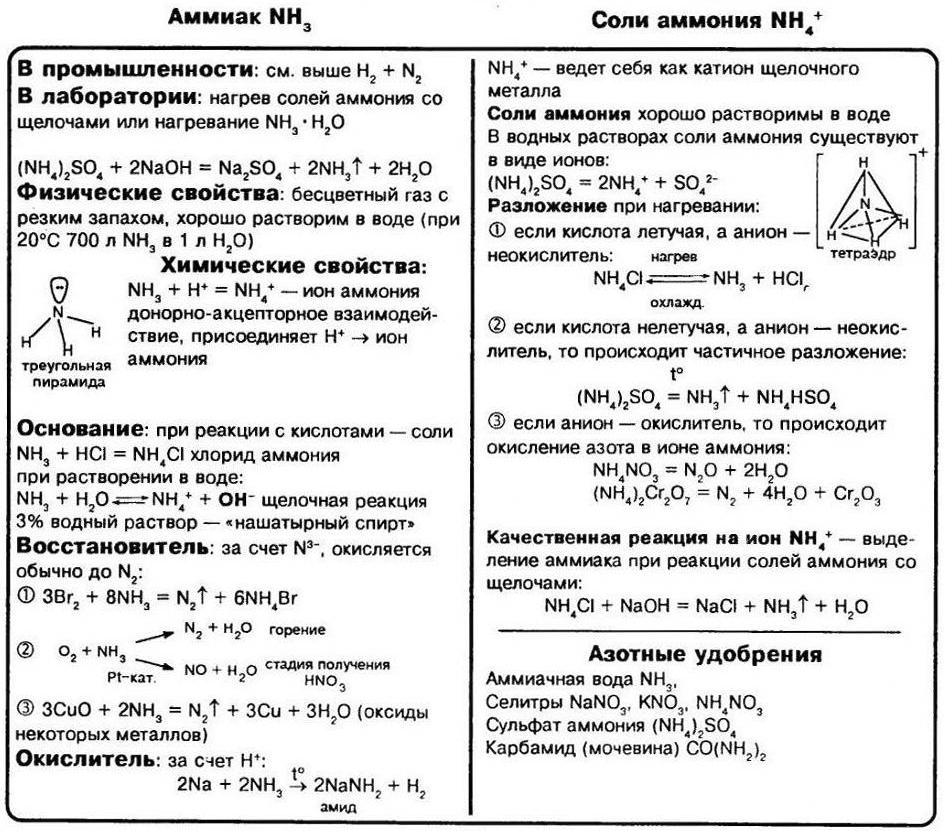
Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей. В жарком климате мочевина (NH2)2CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH4Cl, который при нагревании испаряет аммиак.
1. Строение молекулы


Молекула аммиака имеет форму тригональной пирамиды с
атомом азота в вершине. Три неспаренных
p-электрона атома азота участвуют в образовании полярных ковалентных
связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара
внешних электронов является неподелённой, она может образовать
донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+.
Вид химической связи: ковалентная полярная, три одинарные σ — сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях
— бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти
вдвое легче воздуха, ядовит. По
физиологическому действию на организм относится к группе веществ удушающего и
нейротропного действия, способных при ингаляционном поражении вызвать
токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают
слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и
воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение,
боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы
кашля, покраснение и зуд кожи. Растворимость NH3 в воде чрезвычайно
велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме
воды.
3. Получение аммиака
В лаборатории | В |
Для получения аммиака в лаборатории NH4Cl (NH4)2SO4 Внимание! Гидроксид аммония неустойчивое основание, При получении аммиака держите пробирку — приёмник дном кверху, так как аммиак легче воздуха: | Промышленный способ получения аммиака N2(г) + 3H2(г) ↔ 2NH3(г) Условия: катализатор температура давление Это так называемый процесс Габера (немецкий |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с
изменением степени окисления атома азота (реакции окисления) - без
изменения степени окисления атома азота (присоединение)
Реакции N-3 → N0 → N+2 NH3 – сильный |
с кислородом 1. Горение аммиака (при нагревании) 4NH3 + 3O2 → 2N2 + 6H20 2. Каталитическое окисление амииака (катализатор Pt – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O Видео — Эксперимент » Окисление аммиака в |
с оксидами металлов 2 NH3 |
с сильными окислителями 2NH3 + 3Cl2 = N2 + 6HCl |
аммиак – непрочное соединение, при 2NH3↔ N2 + 3H2 |
5. Применение аммиака
По объемам производства
аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100
миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде
водного раствора – аммиачной воды, которая обычно содержит 25% NH3.
Огромные количества аммиака далее используются для получения азотной кислоты, которая идет на производство удобрений и множества других продуктов. Аммиачную воду
применяют также непосредственно в виде удобрения, а иногда поля поливают из
цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин. Его применяют также в качестве дешевого
хладагента в промышленных холодильных установках.
Аммиак используется
также для получения синтетических
волокон, например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка,
шерсти и шелка. В нефтехимической промышленности аммиак используют для
нейтрализации кислотных отходов, а в производстве природного каучука аммиак
помогает сохранить латекс в процессе его перевозки от плантации до завода.
Аммиак используется также при производстве соды по методу Сольве. В
сталелитейной промышленности аммиак используют для азотирования – насыщения
поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики
используют водные растворы аммиака (нашатырный спирт)
в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека
из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 «Горение аммиака»
Тренажёр №2 «Химические свойства аммиака»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.
№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Нитрид водорода с формулой NH3 называется аммиаком. Это лёгкий (легче воздуха) газ с резким запахом. Строение молекулы определяет физические и химические свойства аммиака.

Строение
Молекула аммиака состоит из одного атома азота и трёх атомов водорода. Связи между атомами водорода и азота ковалентные. Молекула аммиака имеет форму тригональной пирамиды.
На 2р-орбитали азота находится три свободных электрона. С ними вступают в гибридизацию три атома водорода, образуя тип гибридизации sp3.

Рис. 1. Строение молекулы аммиака.
Если один атом водорода заменить углеводородным радикалом (CnHm), получится новое органическое вещество – амин. Замещаться может не только один атом водорода, но и все три. В зависимости от количества замещённых атомов различают три вида аминов:
- первичные (метиламин – CH3NH2);
- вторичные (диметиламин – СН3-NH-СН3);
- третичные (триметиламин – СН3-N-(СН3)2).
К молекуле аммиака могут присоединиться С2Н4, С6Н4, (С2Н4)2 и другие вещества, содержащие несколько атомов углерода и водорода.

Рис. 2. Образование аминов.
У аммиака и аминов остаётся свободной пара электронов азота, поэтому свойства двух веществ схожи.
Физические
Основные физические свойства аммиака:
- бесцветный газ;
- резкий запах;
- хорошая растворимость в воде (на один объём воды 700 объёмов аммиака при 20°С, при 0°С – 1200);
- легче воздуха.
Аммиак сжижается при температуре -33°С и становится твёрдым при -78°С. Концентрированный раствор содержит 25 % аммиака и имеет плотность 0,91 г/см3. Жидкий аммиак растворяет неорганические и органические вещества, но не проводит электрический ток.
В природе аммиак выделяется при гниении и разложении органических веществ, содержащих азот (белки, мочевина).
Химические
Степень окисления азота в составе аммиака – -3, водорода – +1. При образовании аммиака водород окисляет азот, отнимая у него три электрона. За счёт оставшейся пары электронов азота и лёгкого отделения атомов водорода аммиак является активным соединением, вступающим в реакции с простыми и сложными веществами.
Основные химические свойства описаны в таблице.
Взаимодействие | Продукты реакции | Уравнение |
С кислородом | Горит с образованием азота или взаимодействует с кислородом в присутствии катализатора (платины), образуя оксид азота | – 4NH3 +3O2 → 2N2 + 6H2O; – 4NH3 + 5O2 → 4NO + 6H2O |
С галогенами | Азот, кислота | 2NH3 + 3Br2 → N2 + 6HBr |
С водой | Гидроксид аммония или нашатырный спирт | NH3 + H2O → NH4OH |
С кислотами | Соли аммония | – NH3 + HCl → NH4Cl; – 2NH3 + H2SO4 → (NH4)2SO4 |
С солями | Замещает металл, образуя новую соль | 2NH3 + CuSO4 → (NH4)2SO4 + Cu |
С оксидами металлов | Восстанавливает металл, образуется азот | 2NH3 + 3CuO → 3Cu + N2 + 3H2O |

Рис. 3. Горение аммиака.
Что мы узнали?
Выяснили, какими свойствами обладает аммиак. Аммиак – бесцветный лёгкий газ с резким запахом. Сжижается при низкой температуре. Раствор аммиака – хороший растворитель. Способен отдавать атомы водорода, присоединяя углеводородный радикал и образуя амины. Аммиак за счёт оставшейся электронной пары азота реагирует с простыми и сложными веществами – галогенами, кислородом, водой, кислотами, солями, оксидами.
Тест по теме
Оценка доклада
Средняя оценка: 4.3. Всего получено оценок: 286.
История открытия аммиака
Название соединения $NH_3$ «аммиак» предположительно произошло от нескольких источников. Предположительно, свое название аммиак получил в честь бога Аммона, культ которого был распространен в Северной Африке. Аммиак может образовываться в результате быстрого разложения мочевины $(NH_2)_2CO$ в очень жарком климате, что и связало запах соединения с культом божества.
По некоторым другим сведениям, аммиак мог получить свое современное название от древнеегипетского слова «амониан», как называли последователей египетского бога Амона. В качестве атрибута в некоторых элементах ритуальных обрядов использовался хлорид аммония, который при нагревании разлагается с образованием аммиака.
В 1801 году русский ученый-химик, академик Яков Дмитриевич Захаров ввел сокращенное название «аммиак», которое используется в настоящее время.
В чистом виде аммиак был получен в 1774 г. английским химиком Джозефом Луи Пристли. Он нагревал «аммониак» (хлорид аммония) с гашеной известью (гидроксидом кальция). Эту реакцию до сих пор используют в лабораториях, если требуется получить небольшие количества этого газа. Выделявшийся аммиак Пристли собирал над ртутью. Он назвал его «щелочным воздухом», так как водный раствор аммиака имел все признаки щелочи.
В 1784 французский химик Бертолле разложением аммиака доказал его элементный состав, который в 1787 получил официальное название «нашатырь» – от латинского названия нашатырной щелочи – sal ammoniac. Это название сохраняется и до сих пор в большинстве западноевропейских языков (нем. Ammoniak, англ. Ammonia, фр. Ammoniaque)
СТРОЕНИЕ АММИАКА
 Напомним, что атом азота содержит пять валентных электронов, три из которых неспаренные: $1s^12s^22p^3$. У атома водорода один неспаренный электрон $1s^1$. Так как каждый атом стремится завершить свою последнюю оболочку, для этого атому азота необходимо принять три электрона, а атому водорода необходим ещё один электрон, поэтому между атомом азота и водорода образуется в молекуле аммиака три одинаковые ковалентные полярные связи с помощью общих электронных пар. Таким образом, в молекуле аммиака валентность азота = III, степень окисления равна –3.
Напомним, что атом азота содержит пять валентных электронов, три из которых неспаренные: $1s^12s^22p^3$. У атома водорода один неспаренный электрон $1s^1$. Так как каждый атом стремится завершить свою последнюю оболочку, для этого атому азота необходимо принять три электрона, а атому водорода необходим ещё один электрон, поэтому между атомом азота и водорода образуется в молекуле аммиака три одинаковые ковалентные полярные связи с помощью общих электронных пар. Таким образом, в молекуле аммиака валентность азота = III, степень окисления равна –3.

Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония $NH_4^+$.
Кроме ковалентной полярной связи для молекул аммиака характерно и межмолекулярное взаимодействие, а именно межмолекулярные водородные связи. Неподеленная электронная пара атома азота приводит к образованию частично отрицательного заряда на атоме азота, а на атоме водорода частично положительного. Поэтому молекулы аммиака будут притягиваться друг к другу, и между ними будет устанавливаться ещё и водородная связь, которая слабее ковалентных связей (поэтому ее обозначают точками или штрихами).
Именно наличие водородной связи в молекуле аммиака объясняет его растворение в воде и лёгкое сжижение этого газа.
ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА
$NH_3$ – газ без цвета, с резким запахом, почти в два раза легче воздуха, при охлаждении до -33,6$^circ C$ он сжижается, а при температуре -77,8$^circ C$ превращается в твердое белое вещество, хорошо растворим в воде.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи.
Растворимость $NH_3$ в воде чрезвычайно велика — около 1200 объёмов (при 0 $^circ C$) или 700 объёмов (при 20 $^circ C$) в объёме воды. Полученный раствор называют аммиачной водой. Из-за такой растворимости газообразный аммиак нельзя собирать и хранить над водой.
СПОСОБЫ ПОЛУЧЕНИЯ АММИАКА
Промышленные способы:
В промышленности аммиак получают синтезом из простых веществ:
при t=450 $^circ C$; Р=30 Мпа (1000атм.); катализатор — губчатое железо с активирующими добавками ($Al_2O_3$; $K_2O$ и др.)
$3H_2 + N_2xrightarrow[]{t; Pt; Р} 2NH_3$
Более подробно синтез аммиака рассмотрен в теме «Схема производства аммиака»
Лабораторные способы:
В лаборатории аммиак получают действием щелочей на твердые соли аммония:
$2NH_4Cl_{textrm{(тв.)}} + Ca(OH)_{2textrm{(тв.)}} = 2NH_3 + 2H_2O + CaCl_2$
Собирание — в перевернутую кверху дном пробирку, так как аммиак легче воздуха.
Распознавание аммиака можно проводить несколькими способами:
а) по запаху;
б) по посинению влажной лакмусовой бумажки;
в) по появлению белого дыма от поднесенной стеклянной палочки, смоченной HCl (конц.).
ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
$NH_3$ – очень реакционно способное вещество.
1. Газообразный $NH_3$ вступает в реакции окисления, при этом продукт окисления аммиака зависит от силы окислителя и условия проведения реакций:
$4NH_3 + 3O_2 xrightarrow[]{t} 2N_2 + 6H_2O$
$4NH_3 + 5O_2 xrightarrow[]{textrm{800 $^circ C$, кат. Pt/Rh}} 4NO + 6H_2O$
$8NH_3 + 3Cl_2 xrightarrow[]{t} N_2 + 6NH_4Cl$
$2NH_3 + 3CuO xrightarrow[]{500-550 ^circ C} 3Cu + N_2 + 3H_2O$
$2NH_3 + 2Na xrightarrow[]{350 ^circ C} 2NaNH_2 + H_2$
В том числе со сложными веществами-окислителями:
$10NH_3 + 6KMNO_4 + 9H_2SO_4 = 5N_2 + 6MnSO_4 + 3K_2SO_4 + 24H_2O$
$6 NH_3 + 8KClO_3 + 6NaOH = 6NaNO_3 + 8KCl + 12H_2O$
2. Водный раствор аммиака $NH_3 cdot H_2O$ в быту называют нашатырным спиртом. Он не относится к классу спиртов, так как спирты – это органические вещества, а нашатырный спирт относится к неорганическим соединениям. Химики называют это соединение гидроксид аммония – это водный раствор газа аммиака $NH_3$.
Наличие неподелённой электронной пары на атоме азота и присутствие трёх полярных ковалентных связей в молекуле аммиака будет способствовать тому, что он будет вступать в реакции присоединения протона водорода $H^+$, то есть реагировать с водой и с растворами кислот, веществами, имеющими протоны водорода. Поэтому водный раствор аммиака проявляет основные свойства:
$NH_3uparrow + Н_2O leftrightarrow NH_3cdot НOН leftrightarrow NH_4^+ + OН^-$

Взаимодействие аммиака с кислотами приводит к образованию средних или кислых (в случае многоосновных кислот) солей:
$NH_3 + НNO_3 = NH_4NO_3 $
$NH_3 + H_2SO_4 = (NH_4)HSO_4 $
$2NH_3 + H_2SO_4 = (NH_4)_2SO_4$
$NH_3 + HCl = NH_4Cl$
Взаимодействие аммиака с солями приводит к образованию солей аммония:
$3(NH_3cdot H_2O) _{textrm{(конц. холодн.)}} + AlCl_3 = Al(OH)_3downarrow + 3NH_4Cl$
3. $NH_3$ – лиганд в комплексных соединениях (образование аммиакатов):
Молекулы $NH_3$ способны образовывать донорно-акцепторные связи не только с $Н^+$, но и с катионами некоторых переходных металлов: $Ag^+$; $Cu^{2+}$; $Cr^{3+}$; $Co^{2+}$ и др. Это приводит к образованию растворимых аммиакатов.
Например, в аммиаке легко растворяются $Ag_2O$, $Cu_2O$, $Cu(OH)_2$, $AgCl$ (в воде не растворимы):
$ textrm{а)} Ag_2O+ 4NH_3 + H_2O xrightarrow[]{} 2[Ag(NH_3)_2]OHhspace{0,5cm} textrm{гидроксид диамминсеребра (I) }$
$ textrm{б)} Cu(OH)_2 + 4NH_3 xrightarrow[]{} [Cu(NH_3)_4](OH)_2 hspace{0,5cm} textrm{гидроксид тетраамминмеди (II)}$
$ textrm{в)} Zn(OH)_2 + 4NH_3 xrightarrow[]{} [Zn(NH_3)_4](OH)_2 hspace{0,5cm} textrm{гидроксид тетраамминцинка}$
$ textrm{г)} AgCl + 2NH_3 xrightarrow[]{}[Ag(NH_3)_2]Clhspace{0,5cm} textrm{хлорид диамминсеребра (I)}$
$ textrm{д)} CuSO_4 + 4NH_3 xrightarrow[]{} [Cu(NH_3)_4]SO_4hspace{0,5cm} textrm{сульфат тетраамминмеди (II)}$
Аммиачные растворы $Ag_2O$, $Cu_2O$, $Cu(OH)_2$ используются как реактивы в качественном анализе (обнаружение альдегидов, 1-алкинов и др.).
4. $NH_3$ — аминирующий агент в органическом синтезе:
а) Синтез алкиламинов:
$2NH_3 + C_2H_5Br xrightarrow[]{} C_2H_5NH_2 + NH_4Br$
б) Синтез аминокислот:
$ NH_3 + CH_2Br-COOH xrightarrow[]{} NH_2CH_2-COOH + H_2O$
в) Синтез амидов:
$ NH_3 + CH_3-COOH xrightarrow[]{} CH_3-CONH_2 + H_2O$
3. $NH_3$ — аминирующий агент в органическом синтезе:
а) Синтез алкиламинов:
$2NH_3 + C_2H_5Br xrightarrow[]{} C_2H_5NH_2 + NH_4Br$
б) Синтез аминокислот:
$ NH_3 + CH_2Br-COOH xrightarrow[]{} NH_2CH_2-COOH + H_2O$
в) Синтез амидов:
$ NH_3 + CH_3-COOH xrightarrow[]{} CH_3-CONH_2 + H_2O$
Аммиак. Соли аммония
Ключевые слова конспекта: аммиак, строение молекулы, свойства, соли аммония, запах аммиака, гипс, азотная кислота, мочевина.
СТРОЕНИЕ МОЛЕКУЛЫ АММИАКА,
ЕГО ФИЗИЧЕСКИЕ СВОЙСТВА
Водородным соединением азота является аммиак NH3. Аммиак – вещество молекулярного строения. Его электронная и графическая формулы изображены на рисунке.

В молекуле NH3 тип химической связи – ковалентный полярный. Электронная плотность смещена к атому азота, на атоме азота – частичный отрицательный заряд δ–, на атомах водорода – частичный положительный заряд δ+.
В молекуле аммиака одинарные связи, так как на атоме азота в молекуле NH3 имеется неподелённая электронная пара. Выступая в качестве донора электронной пары, атом азота может участвовать в образовании по донорно–акцепторному механизму четвёртой ковалентной связи с другими атомами или ионами, обладающими электроноакцепторными свойствами. Именно поэтому аммиак реагирует с кислотами. Молекула аммиака способна присоединять протон (или ион гидроксония). При этом возникает четвёртая ковалентная связь с атомом водорода по донорно–акцепторному механизму. В результате образуется ион аммония:![]()
При обычных условиях аммиак – бесцветный газ с резким характерным раздражающим запахом. Aммиaк легче воздуха.
Аммиак кипит при температуре –33,3 °С, его температура плавления –77,7 °С. Аммиaк легко сжижается при охлаждении и повышении давления. Он обладает чрезвычайно высокой растворимостью в воде: в одном объёме воды растворяется около 1200 объёмов аммиака при 0 °С, а при +20 °С – 700 объёмов. Разбавленные растворы аммиака (3–10%) называются нашатырным спиртом, концентрированные растворы (18,5–25%) – аммиачной водой.
При работе с аммиаком надо помнить, что даже незначительное содержание его приводит к раздражению слизистой оболочки носа, горла и т. д.
ХИМИЧЕСКИЕ СВОЙСТВА АММИАКА
Рассмотрим химические свойства аммиака с позиций окислительно-восстановительных и кислотно-основных взаимодействий.
В молекуле аммиака азот находится в низшей степени окисления (–3), поэтому за счёт азота аммиак обладает только восстановительными свойствами.
Если пропустить ток аммиака по трубке, вставленной в другую широкую трубку, по которой проходит кислород, то аммиак можно зажечь; он горит бледным зеленоватым пламенем. При горении аммиака образуется свободный азот:![]()
В присутствии катализатора (сплав Pt и Rh) NH3 окисляется кислородом с образованием NO:
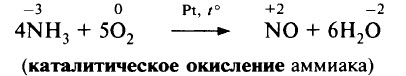
Этот процесс является одной из стадий промышленного получения азотной кислоты.
Аммиаком можно восстановить некоторые неактивные металлы или металлы средней активности из их оксидов:![]()
В кислотно-основных взаимодействиях аммиак проявляет основные свойства. Он взаимодействует с кислотами с образованием солей аммония:
- NH3 + НCl = NH4Cl (хлорид аммония)
- 2NH3 + H2SO4 = (NH4)2SO4 (сульфат аммония)
- NH3 + H2SO4 = NH4HSO4 (гидросульфат аммония)
При растворении аммиака в воде устанавливается следующая совокупность равновесных состояний:
![]()
Поэтому водные растворы аммиака имеют щелочную реакцию.
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АММИАКА
Промышленным способом получения аммиака является его синтез из азота и водорода:![]()
Сырьём является азот, полученный перегонкой жидкого воздуха, и водород, чаще всего получаемый разложением природного газа. Оптимальные условия проведения реакции: t° ≈ 500 °С, р ≈ 1000 атм, катализатор – губчатое железо с добавками (промоторами) К2O, Al2O3. В таких условиях выход аммиака составляет около 50%.
Лабораторным способом получения аммиака является взаимодействие солей аммония со щелочами при нагревании: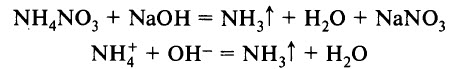
Эта реакция также является качественной реакцией на ион аммония. Её признак – появление запаха аммиака.
Образовавшийся аммиак хорошо растворяется в воде. Для получения аммиака в лаборатории лучше брать сульфат аммония и гидроксид кальция, тогда образующийся сульфат кальция связывает воду, образуется гипс – CaSO4 • 2H2O. Иногда вместо щёлочи используется натронная известь – смесь СаО и NaOH. Реакцию ведут при нагревании:
(NH4)2SO4 + Са(ОН)2 = CaSO4 + 2NH3↑ + 2H2O
Аммиак применяется для получения азотной кислоты HNO3, мочевины (H2N–СО–NH2) – ценного удобрения, для получения соды (Na2CO3) по аммиачному методу, для аминирования органических веществ. Жидкий аммиак и его водные растворы используются как жидкие удобрения. Аммиак применяется как хладагент в холодильниках (NH3 легко сжижается, а затем испаряется с поглощением большого количества теплоты). В медицине используется 10%-й раствор – нашатырный спирт.
СОЛИ АММОНИЯ
Соли аммония, как и другие соли, являются ионными соединениями, образованными катионами аммония NH4+ и анионами кислотных остатков. По многим свойствам соли аммония похожи на соли натрия и калия. При обычных условиях это твёрдые кристаллические вещества, бесцветные, если анион кислотного остатка не обусловливает какую–либо окраску.
Соли аммония разлагаются при нагревании. Состав продуктов реакции термического разложения зависит от природы кислотного остатка (аниона):
а) если соль аммония образована летучей кислотой и её анион не является сильным окислителем, то такая соль полностью разлагается с образованием соответствующих газов:
б) если в состав соли аммония входит анион, обладающий окислительной способностью, то при нагревании происходит окислительно–восстановительная реакция. Так, при нагревании нитрата или нитрита аммония происходит конпропорционирование (в результате степени окисления азота «сходятся»):
А нагревание дихромата аммония приводит к образованию оксида хрома(III), эту реакцию часто используют для имитации «вулканчика»:![]()
Соли аммонию реагируют со щелочами с образованием аммиака:![]()
Данную реакцию можно рассматривать как качественную на наличие ионов аммония. При нагревании аммиак улетучивается за счёт уменьшения его растворимости. Это легко определяется по характерному запаху аммиака и по окрашиванию влажной лакмусовой бумаги в синий цвет.
Конспект урока «Аммиак. Соли аммония».
Следующая тема: «».
