В какой продукт превращается глюкоза при анаэробном дыхании клетки
Клеточное или тканевое дыхание — совокупность биохимических реакций, протекающих в клетках живых организмов, в ходе которых происходит окисление углеводов, липидов и аминокислот до углекислого газа и воды. Высвобожденная энергия запасается в химических связях макроэргических соединений (АТФ, которых в результате процесса образуется 30(32) и др.) и может быть использована по мере необходимости. Входит в группу процессов катаболизма. О физиологических процессах транспортировки к клеткам многоклеточных организмов кислорода и удалению от них углекислого газа см. статью Дыхание.
Использование различных начальных субстратов[править | править код]
В качестве исходных субстратов дыхания могут выступать различные вещества, преобразуемые в ходе специфических метаболических процессов в Ацетил-КоА с высвобождением ряда побочных продуктов. Восстановление НАД (НАДФ) и образование АТФ может происходить уже на этом этапе, однако большая их часть образуется в цикле трикарбоновых кислот при переработке Ацетил-КоА.
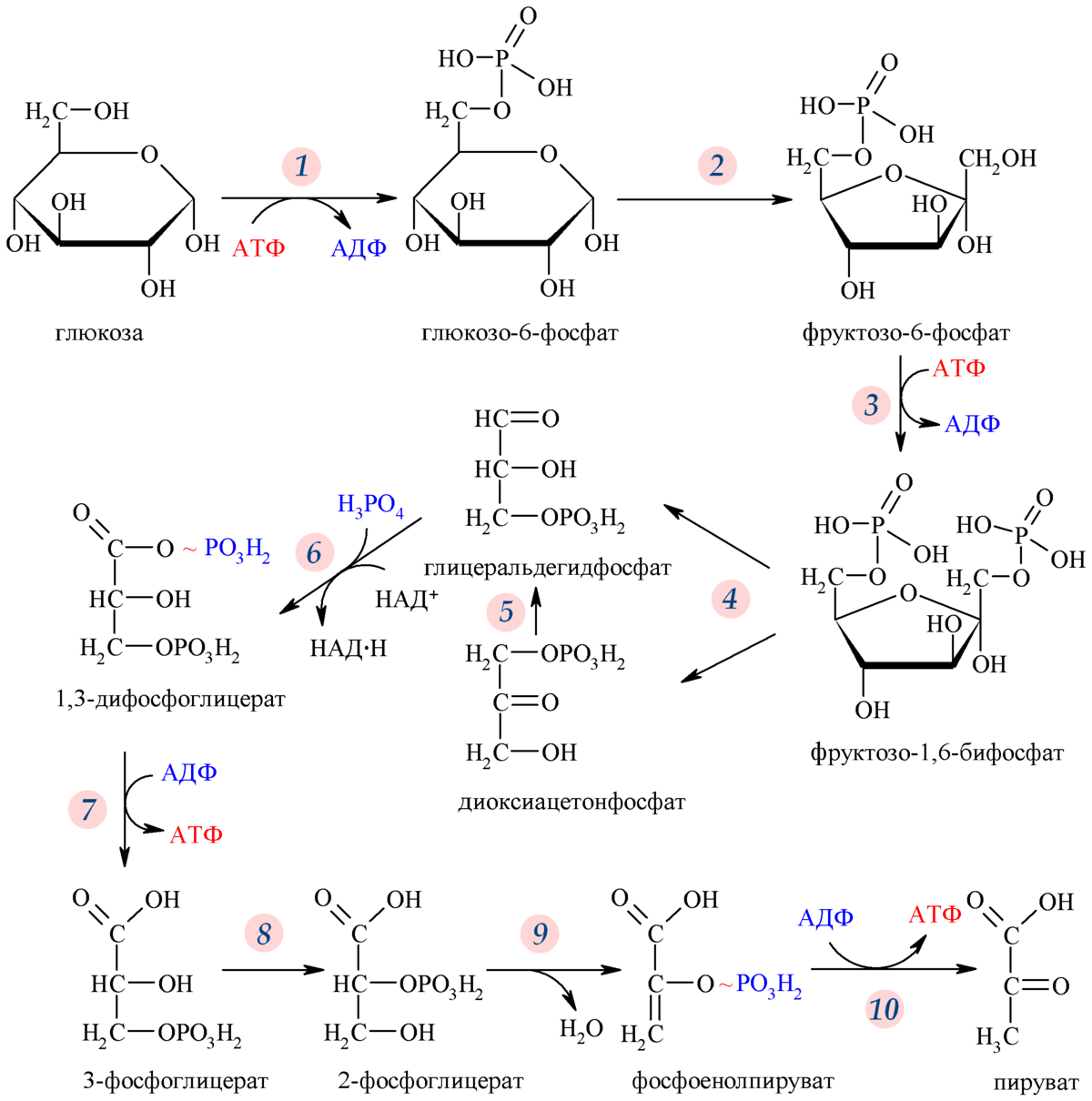
Гликолиз[править | править код]
Гликолиз — путь ферментативного расщепления глюкозы — является общим практически для всех живых организмов процессом. У аэробов он предшествует собственно клеточному дыханию, у анаэробов завершается брожением. Сам по себе гликолиз является полностью анаэробным процессом и для осуществления не требует присутствия кислорода.
Первый его этап протекает с высвобождением 2 молекул АТФ и включает в себя расщепление молекулы глюкозы на 2 молекулы глицеральдегид-3-фосфата. На втором этапе происходит НАД-зависимое окисление глицеральдегид-3-фосфата, сопровождающееся субстратным фосфорилированием, то есть присоединением к молекуле остатка фосфорной кислоты и формированием в ней макроэргической связи, после которого остаток переносится на АДФ с образованием АТФ.
Таким образом, уравнение гликолиза имеет следующий вид:
Глюкоза + 2НАД+ + 4АДФ + 2АТФ + 2Фн = 2ПВК + 2НАД∙Н + 2 АДФ + 4АТФ + 2H2O + 2Н+.
Сократив АТФ и АДФ из левой и правой частей уравнения реакции, получим:
Глюкоза + 2НАД+ + 2АДФ + 2Фн = 2НАД∙Н + 2ПВК + 2АТФ + 2H2O + 2Н+.
Окислительное декарбоксилирование пирувата[править | править код]
Образовавшаяся в ходе гликолиза пировиноградная кислота (пируват) под действием пируватдегидрогеназного комплекса (сложная структура из 3 различных ферментов и более 60 субъединиц) распадается на углекислый газ и ацетальдегид, который вместе с Коферментом А образует Ацетил-КоА. Реакция сопровождается восстановлением НАД до НАД∙Н.
У эукариот процесс протекает в матриксе митохондрий.
β-окисление жирных кислот[править | править код]
Деградация жирных кислот (у некоторых организмов также алканов) происходит у эукариот в матриксе митохондрий. Суть этого процесса заключается в следующем. На первой стадии к жирной кислоте присоединяется кофермент А с образованием ацил-KoA. Он дегидрируется с последовательным переносом восстановительных эквивалентов на убихинон дыхательной ЭТЦ. На второй стадии происходит гидратирование по двойной связи С=С, после чего на третьей стадии происходит окисление полученной гидроксильной группы. В ходе этой реакции восстанавливается НАД.
Наконец, на четвёртой стадии образовавшаяся β-кетокислота расщепляется β-кетотиолазой в присутствии кофермента А на ацетил-КоА и новый ацил-КоА, в которой углеродная цепь на 2 атома короче. Цикл β-окисления повторяется до тех пор, пока вся жирная кислота не будет переработана в ацетил-КоА.
Цикл трикарбоновых кислот[править | править код]
Ацетил-КоА под действием цитратсинтазы передаёт ацетильную группу оксалоацетату с образованием лимонной кислоты, которая поступает в цикл трикарбоновых кислот (цикл Кребса). В ходе одного оборота цикла лимонная кислота несколько раз дегидрируется и дважды декарбоксилируется с регенерацией оксалоацетата и образованием одной молекулы ГТФ (способом субстратного фосфорилирования), трёх НАДН и ФАДН2.
Суммарное уравнение реакций:
Ацетил-КоА + 3НАД+ + ФАД + ГДФ + Фн + 2H2O + КоА-SH = 2КоА-SH + 3НАДH + 3H+ + ФАДН2 + ГТФ + 2CO2
У эукариот ферменты цикла находятся в свободном состоянии в матриксе митохондрий, только сукцинатдегидрогеназа встроена во внутреннюю митохондриальную мембрану.
Окислительное фосфорилирование[править | править код]
Основное количество молекул АТФ вырабатывается по способу окислительного фосфорилирования на последней стадии клеточного дыхания: в электронтранспортной цепи. Здесь происходит окисление НАД∙Н и ФАДН2, восстановленных в процессах гликолиза, β-окисления, цикла Кребса и т.д. Энергия, выделяющаяся в ходе этих реакций, благодаря цепи переносчиков электронов, локализованной во внутренней мембране митохондрий (у прокариот — в цитоплазматической мембране), трансформируется в трансмембранный протонный потенциал. Фермент АТФ-синтаза использует этот градиент для синтеза АТФ, преобразуя его энергию в энергию химических связей. Подсчитано, что молекула НАД∙Н может дать в ходе этого процесса 2.5 молекулы АТФ, ФАДН2 — 1.5 молекулы.
Конечным акцептором электрона в дыхательной цепи аэробов является кислород.
Анаэробное дыхание[править | править код]
Если в электронтранспортной цепи вместо кислорода используется другой конечный акцептор (трёхвалентное железо, нитрат- или сульфат-анион), дыхание называется анаэробным. Анаэробное дыхание свойственно в основном бактериям, которые благодаря этому играют важную роль в биогеохимическом цикле серы, азота и железа. Денитрификация — один из типов анаэробного дыхания — является одним из источников парниковых газов, железобактерии принимают участие в образовании железомарганцевых конкреций. Среди эукариот анаэробное дыхание встречается у некоторых грибов, морских донных беспозвоночных, паразитических червей [1] и протистов — например, фораминифер [2].
Общее уравнение дыхания, баланс АТФ[править | править код]
| Стадия | Выход кофермента | Выход АТФ (ГТФ) | Способ получения АТФ |
|---|---|---|---|
| Первая фаза гликолиза | −2 | Фосфорилирование глюкозы и фруктозо-6-фосфата с использованием 2 АТФ из цитоплазмы. | |
| Вторая фаза гликолиза | 4 | Субстратное фосфорилирование | |
| 2 НАДН | 3 (5) | Окислительное фосфорилирование. Только 2 АТФ образуется из НАДН в электронтранспортной цепи, поскольку кофермент образуется в цитоплазме и должен быть транспортирован в митохондрии. При использовании малат-аспартатного челнока для транспорта в митохондрии из НАДН образуется 3 моль АТФ. При использовании же глицерофосфатного челнока образуется 2 моль АТФ. | |
| Декарбоксилирование пирувата | 2 НАДН | 5 | Окислительное фосфорилирование |
| Цикл Кребса | 2 | Субстратное фосфорилирование | |
| 6 НАДН | 15 | Окислительное фосфорилирование | |
| 2 ФАДН2 | 3 | Окислительное фосфорилирование | |
| Общий выход | 30 (32) АТФ[3] | При полном окислении глюкозы до углекислого газа и окислении всех образующихся коферментов. | |
См. также[править | править код]
- Брожение
Примечания[править | править код]
- ↑ Tielens A.G.M., Rotte C., van Hellemond J.J., Martin W. Mitochondria as we don’t know them (Trends in Biochem.Sci.,2002,27,11,564-572
- ↑ Если нет кислорода, можно дышать нитратами
- ↑ David L. Nelson, Michael M. Cox. Lehninger Principles of Biochemistry. — 4. — W. H. Freeman, 2004. — 1100 с.
Анаэробное дыхание — биохимический процесс окисления органических субстратов или молекулярного водорода с использованием в дыхательной ЭТЦ в качестве конечного акцептора электронов вместо O2 других окислителей неорганической или органической природы. Как и в случае аэробного дыхания, выделяющаяся в ходе реакции свободная энергия запасается в виде трансмембранного протонного потенциала, использующегося АТФ-синтазой для синтеза АТФ.
Осуществляется прокариотами (в редких случаях — и эукариотами) в анаэробных условиях. При этом факультативные анаэробы используют акцепторы электронов с высоким окислительно-восстановительным потенциалом (NO3−, NO2−, Fe3+, фумарат, диметилсульфоксид и т. д.), у них это дыхание конкурирует с энергетически более выгодным аэробным и подавляется кислородом. Акцепторы с низким окислительно-восстановительным потенциалом (сера, SO42−, CO2) применяются только строгими анаэробами, гибнущими при появлении в среде кислорода.
В корневых системах многих растений при гипоксии и аноксии, вызванных затоплением посевов в результате длительных дождей или весенних паводков, развивается анаэробное дыхание с использованием в качестве акцепторов электронов альтернативных кислороду соединений, например нитратов. Установлено, что растения, произрастающие на полях, удобренных нитратными соединениями, переносят переувлажнение почвы и сопутствующую ему гипоксию лучше, нежели такие же растения без нитратной подкормки.
Механизмы окисления органических субстратов при анаэробном дыхании, как правило, аналогичны механизмам окисления при аэробном дыхании. Исключением является использование в качестве исходного субстрата ароматических соединений. Обычные пути их катаболизма требуют молекулярного кислорода уже на первых стадиях, в анаэробных условиях осуществляются иные процессы, например, восстановительная деароматизация бензоил-КоА у Thauera aromatica с затратой энергии АТФ. Некоторые субстраты (например, лигнин) при анаэробном дыхании не могут использоваться.
Нитратное и нитритное дыхание[править | править код]
Прокариоты обладают возможностью использовать в качестве акцептора электрона в дыхательной электронтранспортной цепи (ЭТЦ) вместо кислорода различные окисленные соединения азота. Ферментом, катализирующим финальную стадию транспорта электрона — его перенос на нитрат-анион — является нитратредуктаза. При использовании нитритов ферментов и путей его восстановления два:
- NO-образующая нитритредуктаза восстанавливает нитрит до оксида азота (II). Это одна из стадий денитрификации.
- NH3-образующая нитритредуктаза восстанавливает нитрит до иона аммония, что является заключительной стадией диссимиляционного восстановления нитратов в аммоний или, как его называют в иностранной литературе, диссимиляционной или дыхательной аммонификации (в отечественной литературой аммонификацией называется процесс высвобождения аммиака из состава органических соединений, например, белков). Надо отметить, что ассимиляционное восстановление нитратов в аммоний (ассимиляционная нитратредукция или просто ассимиляция) — процесс включения нитратов после восстановления до аммония в состав органических веществ, широко распространённый у прокариот и некоторых групп эукариот (грибы, растения) — не сопряжён с получением энергии.
НАД·H, образовавшийся при гликолизе, в ЦТК или по иным механизмам и поступающий в дыхательную ЭТЦ, окисляется обычно НАД·H:убихинон-оксидоредуктазой, являющейся протонной помпой. Терминальные оксидоредуктазы, переносящие электрон на конечный акцептор, в отличие от цитохромоксидазы аэробной ЭТЦ, обычно не являются протонной помпой. Однако при переносе нитратредуктазой электрона с убихинона (или у ряда видов менахинона) на нитрат-анион происходит выделение двух протонов в периплазму (с убихинона) и связываение двух протонов в воду в цитоплазме. Таким образом создаётся дополнительный протонный градиент.
Аналогичным образом, связывая протоны в цитоплазме, создаёт градиент электрохимического потенциала нитритредуктаза. В то же время NO-редуктаза связывает протоны из периплазмы и её работа не сопряжена с образованием градиента потенциала[1].
Больше путей переноса протонов через мембрану анаэробная ЭТЦ не содержит (в аэробной же их 3), в связи с чем нитратное дыхание по эффективности в расчёте на 1 моль глюкозы составляет лишь 70 % от аэробного. При поступлении в среду молекулярного кислорода бактерии переключаются на обычное дыхание.
Нитратное дыхание встречается, хотя и редко, и среди эукариот. Так, нитратное дыхание, сопровождающееся денитрификацией и выделением молекулярного азота, недавно открыто у фораминифер[2]. До этого нитратное дыхание с образованием N2O было описано у грибов Fusarium и Cylindrocarpon (см.[3]).
Сульфатное дыхание[править | править код]
В настоящее время известен ряд бактерий, способных окислять органические соединения или молекулярный водород в анаэробных условиях, используя в качестве акцепторов электронов в дыхательной цепи сульфаты, неорганические тиосульфаты, сульфиты, молекулярную серу. Этот процесс получил название диссимиляционной сульфатредукции, а бактерии, осуществляющие этот процесс — сульфатвосстанавливающих или сульфатредуцирующих.
Все сульфатвосстанавливающие бактерии — облигатные анаэробы.
Сульфатвосстанавливающие бактерии получают энергию в процессе сульфатного дыхания при переносе электронов в электронтранспортной цепи. Перенос электронов от окисляемого субстрата по электронтранспортной цепи сопровождается возникновением электрохимического градиента ионов водорода с последующим синтезом АТФ.
Подавляющее большинство бактерий этой группы хемоорганогетеротрофы. Источником углерода и донором электронов для них являются простые органические вещества — пируват, лактат, сукцинат, малат, а также некоторые спирты. У некоторых сульфатвосстанавливающих бактерий обнаружена способность к хемолитоавтотрофии, когда окисляемым субстратом является молекулярный водород.
Сульфатвосстанавливающие эубактерии широко распространены в анаэробных зонах водоёмов разного типа, в иле, в почвах, в пищеварительном тракте животных. Наиболее интенсивно восстановление сульфатов происходит в солёных озерах и морских лиманах, где почти нет циркуляции воды, и содержится много сульфатов. Сульфатвосстанавливающим эубактериям принадлежит ведущая роль в образовании сероводорода в природе и в отложении сульфидных минералов. Накопление в среде H2S часто приводит к отрицательным последствиям — в водоёмах к гибели рыбы, в почвах к угнетению растений. С активностью сульфатвосстанавливающих эубактерий связана также коррозия в анаэробных условиях различного металлического оборудования, например, металлических труб.
Фумаратное дыхание[править | править код]
В качестве акцептора электронов может использоваться фумарат. Фумаратредуктаза сходна с нитритредуктазой: лишь вместо молибдоптерин содержащей субъединицы в её состав входит ФАД и гистидин содержащая субъединица. Трансмембранный протонный потенциал образуется аналогичным образом: перенос протонов не происходит, однако фумаратредуктаза связывает протоны в цитоплазме, а дегидрогеназы в начале ЭТЦ выделяют протоны в периплазму. Перенос электронов с дегидрогеназ на фумаратредуктазу происходит обычно через мембранный пул менохинонов.
Фумарат, как правило, отсутствует в природных местообитаниях и образуется самими микроорганизмами из аспартата, аспарагина, сахаров, малата и цитрата. В виду этого большинство бактерий, способных к фумаратному дыханию, содержат фумаразу, аспартат: аммиак-лиазу и аспарагиназу, синтез которого контролирует чувствительный к молекулярному кислороду белок Fnr.
Фумаратное дыхание достаточно широко распространено среди эукариот, в частности у животных (среди животных, у которых оно описано — пескожил, мидии, аскарида, печёночная двуустка и др[3].)
Железистое дыхание[править | править код]
Ион железа (Fe3+) широко распространённый конечный акцептор электронов при анаэробном дыхании, используемый и автотрофными и гетеротрофными организмами. Поток электронов в таких организмах похож на транспорт электронов в дыхательной цепи с использованием кислорода или нитрата, за исключением того, что конечным ферментом является железо редуктаза. Модельными организмами служат Shewanella putrefaciens и Geobacter metallireducens. Поскольку некоторые железо-восстанавливающие бактерии (например, G. metallireducens) могут использовать токсичные углеводороды, такие как толуол, в качестве источника углерода, то они представляют значительный интерес для их использования для биоремедиации загрязнённых водных систем с высоким содержанием ионов железа.
Дыхание ацетогенных бактерий[править | править код]
Строго анаэробные ацетогенные бактерии родов Acetobacterium, Clostridium, Peptostreptococcus и др. способны получать энергию, окисляя водород углекислым газом в процессе ацетогенеза. При этом две молекулы CO2 образуют ацетат. Энергия при этом запасается в виде трансмембранного градиента протонов (Clostridium sp.) или ионов натрия (Acetobacterium woodi). Для перевода его в энергию связей АТФ используется обычная H-транспортирующая АТФ-синтаза или Na-зависимая АТФ-синтаза соответственно.
Анаэробное дыхание у растений[править | править код]
Анаэробное дыхание, в частности нитратное, активируется в корневых системах некоторых растений в условиях аноксии и гипоксии. Однако если у многих бактерий и некоторых протистов и животных оно может быть основным и достаточным для получения энергии процессом (часто наряду с гликолизом), то у растений функционирует почти исключительно в стрессовых условиях. Так или иначе, но на полях, где в качестве удобрений были внесены нитраты, растения лучше переносят гипоксию, вызванную переувлажнением почвы из-за продолжительных дождей[4][5]. Б. Б. Вартапетян показал, что митохондрии растений в гипоксических условиях сохраняют ультраструктуру в присутствии нитрата[6]. Впоследствии было установлено, что нитрат прямо не используется растительными митохондриями в качестве терминального акцептора электронов, но нитрит, образующийся из нитрата под действием нитратредуктазы, может анаэробно восстанавливаться митохондриями до оксида азота (NO), который далее превращается в цитоплазме в нитрат в реакции с участием фитоглобина[7]. Данный процесс, названный циклом фитоглобина и оксида азота[8], вносит вклад в биоэнергетику растительной клетки при недостатке кислорода.
Анаэробное дыхание у грибов, протистов и животных[править | править код]
Среди животных анаэробное фумаратное дыхание встречается у некоторых паразитических и свободноживущих червей, ракообразных, моллюсков; нитратное дыхание известно среди грибов (например, у Fusarium) [1][9] и свободноживущих протистов — например, фораминифер [2][10]. Способность к анаэробному дыханию присутствует и у черепах, однако непродолжительное время.
См. также[править | править код]
- Брожение
- Гликолиз
- Анаэробные организмы
Примечания[править | править код]
- ↑ U. Flock, J. Reimann and P.Adelroth Proton transfer in bacterial nitric oxide reductase // Biochemical Society Transactions (2006) Volume 34, part 1
- ↑ Элементы — новости науки: Если нет кислорода, можно дышать нитратами
- ↑ 1 2 Mitochondria as we don’t know them. [Trends Biochem Sci. 2002] — PubMed result
- ↑ Семихатова О. А., Т. В. Чиркова «Физиология дыхания растений», изд-во С.ПбГУ, 2001, 224 с.
- ↑ Т. В. Чиркова «Физиологические основы устойчивости растений», изд-во С.ПбГУ, 2002, 244 с.
- ↑ B. B. Vartapetian, L. I. Polyakova. Protective effect of exogenous nitrate on the mitochondrial ultrastructure of Oryza sativa coleoptiles under strict anoxia (англ.) // Protoplasma. — 1999. — Vol. 206, iss. 1—3. — P. 163–167. — ISSN 1615-6102 0033-183X, 1615-6102. — doi:10.1007/BF01279263.
- ↑ K. J. Gupta, A. U. Igamberdiev. The anoxic plant mitochondrion as a nitrite: NO reductase (англ.) // Mitochondrion. — 2011. — Vol. 11, iss. 4. — P. 537–543. — doi:10.1016/j.mito.2011.03.005.
- ↑ A. U. Igamberdiev, R. D. Hill. Plant mitochondrial function during anaerobiosis (англ.) // Annals of Botany. — 2009. — Vol. 103, iss. 2. — P. 259–268. — ISSN 0305-7364 1095-8290, 0305-7364. — doi:10.1093/aob/mcn100.
- ↑ Tielens A.G.M., Rotte C., van Hellemond J.J., Martin W. Mitochondria as we don’t know them (Trends in Biochem.Sci.,2002,27,11,564-572
- ↑ N. Risgaard-Petersen et al. Evidence for complete denitrification in a benthic foraminifer // Nature. 2006. V. 443. P. 93-96.
Литература[править | править код]
- Современная микробиология. Прокариоты: В 2-х томах. Пер. с англ./Под ред. Й. Ленглера, Г. Древса, Г. Шлегеля. — М.: Мир, 2005. ISBN 5-03-003706-3 ISBN 5-03-003707-1 (1 том) ISBN 5-03-003708-X (2 том)
