В какой массе naoh содержится
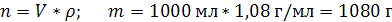
Шиманович И. Л. Химия: методические указания, программа, решение типовых задач, программированные вопросы для самопроверки и контрольные задания для студентов-заочников инженерно-технических (нехимических) специальностей вузов / И. Л. Шиманович. – 3-е изд., испр. – М.: Высш. шк., 2003. – 128 с.
1. Определите эквивалент и эквивалентную массу фосфора, кислорода и брома в соединениях РH3, H2О, НВr. Решение
2. В какой массе NaOH содержится столько же эквивалентов, сколько в 140 г КОН. Решение с ключом
3. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите эквивалентную массу этого металла. Решение с ключом
4. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите эквивалентную массу этого металла. Решение с ключом
5. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите эквивалентную, мольную и атомную массы этого элемента. Решение с ключом
6. Чему равен при н.у. эквивалентный объем водорода? Вычислите эквивалентную массу металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Решение
7. Выразите в молях: а) 6,02·1022 молекул C2H2; б) 1,80·1024 атомов азота; в) 3,01·1023 молекул NH3. Какова мольная масса указанных веществ? Решение
8. Вычислите эквивалент и эквивалентную массу H3PO4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата. Решение
9. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите эквивалентные массы металла и его оксида. Чему равна мольная и атомная масса этого металла? Решение с ключом
10. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите эквивалентную массу, мольную массу и атомную массу этого металла. Решение с ключом
11. Из 3,31 г нитрата металла получается 2,78 г его хлорида, вычислите эквивалентную массу этого металла. Решение
12. Напишите уравнения реакций Fе(ОН)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fе(ОН)3 в каждой из этих реакций. Решение с ключом
13. Избытком гидроксида калия подействовали на растворы: а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их эквиваленты и эквивалентные массы. Решение
14. В каком количестве Сr(OH)3 содержится столько же эквивалентов, сколько в 174,96 г Мg(ОН)2? Решение
15. Избытком хлороводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с HCl и определите их эквиваленты и эквивалентные массы. Решение с ключом
16. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите эквивалентные массы металла и его оксида. Чему равны мольная и атомная массы металла? Решение с ключом
17. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите эквивалентную, мольную и атомную массы металла. Решение с ключом
18. Исходя из мольной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды в граммах. Решение с ключом
19. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NаОН. Вычислите эквивалент, эквивалентную массу и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Решение с ключом
20. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите эквивалент, эквивалентную массу и основность кислоты. На основании, расчета напишите уравнение реакции. Решение
Автор24 — это биржа, где напрямую у преподавателей/аспирантов/репетиторов можно заказать выполнение работы «решить В какой массе NaOH содержится то же количество эквивалентов, что и в 140 г KOH.»
21 января 2018
Заказчик создал задание на выполнение
Лабораторной работы по предмету
Программирование
21 января 2018
18
исполнителей
откликнулись
и предложили выполнить работу по стоимости
от 70 до 2960 руб
21 января 2018
Заказчик переписывался с автором
НиколайАнатольевич
21 января 2018
Заказчик выбрал автора
НиколайАнатольевич,
22 января 2018
Автор выполнил работу по теме
решить В какой массе NaOH содержится то же количество эквивалентов, что и в 140 г KOH.
за
1
день
и уложился в заданный срок
22 января 2018
Заказчик принял работу с первого раза и оплатил заказ
22 января 2018
Заказчик оставил положительный отзыв
Основные принципы создания HTML-документов
Основа используемой HTML-технологии заключается в том, что в обычный текстовый документ вставляют управляющие символы (теги) и в результате получается Web-страница. Браузер, загружая Web-страницу, отображает ее на экране в том виде, который был задан тегами.
Теги позволяют изменять размеры, начертания и цвета символов, определять положение текста на странице, вставлять графические изображения, аним…
Структура документа в HTML
Различают 2 типа тегов: контейнеры и одиночные.
Контейнеры представляют собой дескрипторную пару, включающую в себя начальный (открывающий) и конечный (закрывающий) теги. Начальный тег имеет вид , где TAG — это имя реального HTML-тега. Конечный тег имеет вид . Суть использования контейнеров заключается в хранении определенной информации (текста или других HTML-тегов). В связи с этим со…
Мультимедиа на веб-страницах
В настоящее время, используя Всемирную паутину, можно передавать не только текстовые данные и изображения, но и видео, звук и все то, что называется мультимедиа. Под термином «мультимедиа» понимают компьютерное представление информации, состоящее из более, чем одного типа данных, к которым можно отнести текст и звук, видео и звук. Основная масса мультимедийных элементов, которые встречаются в сети…
XML и XHTML
В свою очередь XHTML (Extensible Hypertext Markup Language, расширяемый язык разметки гипертекста) является промежуточным вариантом между XML и HTML 4.0. Именно в связи с его широким применением консорциумом W3C планируется осуществление постепенного перехода от одного стандарта к другому. Спецификация XHTML построена ппринципу обратной совместимости. Иначе говоря, владельцам веб-сайтов, созданны…
| Дано: | Решение: |
| V (р-ра) = 500 мл = 0,5 л m (NaOH) = 5 г | 1. Вычислим число моль (n) в 5 г NaOH: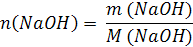 M (NaOH) = 40 г/моль 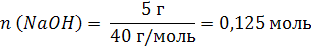 2. Определим молярную концентрацию раствора: 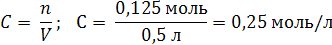 |
| Найти: C(NaOH) | |
| Ответ: Молярная концентрация раствора гидроксида натрия равна 0,25 моль/л. |
2. Вычислить массу хлорида натрия NaCl, содержащегося в растворе объемом 200 мл, если его молярная концентрация 2 моль/л.
| Дано: | Решение: |
| V (р-ра) = 200 мл = 0,2 л C (NaCl) = 2 моль/л | 1. Вычислим число моль NaCl, которое содержится в растворе объемом 0,2 л: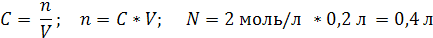 2. Вычислим массу NaCl: 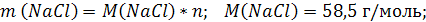 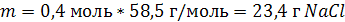 |
| Найти: m( NaCl) | |
| Ответ: m (NaCl) = 23,4 г. |
3. Вычислить молярную концентрацию раствора серной кислоты, если массовая доля H2SO4 в этом растворе 12%. Плотность раствора 1,08 г/мл при 200C.
| Дано: | Решение: |
| ρ (р-ра) = 1,08 г/мл ω (H2SO4) = 12% = 0,12 | 1. Чтобы перейти от массовой доли (%) растворенного вещества к молярной концентрации, надо рассчитать, какую массу имеют 1000 мл раствора: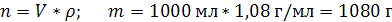 2. Вычислим массу серной кислоты в этом растворе: 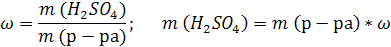 t wx:val=»Cambria Math»/><w:i/><w:sz w:val=»28″/><w:lang w:val=»RU»/></w:rPr><m:t>1080 Рі*0,12=129,6 Рі</m:t></m:r></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR=»00000000″><w:pgSz w:w=»12240″ w:h=»15840″/><w:pgMar w:top=»1134″ w:right=»850″ w:bottom=»1134″ w:left=»1701″ w:header=»720″ w:footer=»720″ w:gutter=»0″/><w:cols w:space=»720″/></w:sectPr></w:body></w:wordDocument>»> 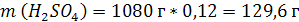 3. Сколько молей содержится в 129,6 г H2SO4? 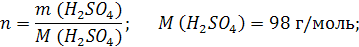 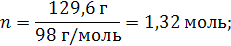 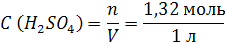 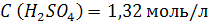 |
| Найти: C (H2SO4) | |
| Ответ: Молярная концентрация раствора серной кислоты с массовой долей H2SO4 12% равна 1,32 моль/л. |
4. Молярность раствора едкого кали KOH равна 3,8 моль/л, его плотность 1,17 г/мл. Вычислить массовую долю (%) KOH в этом растворе.
| Дано: | Решение: |
| C (KOH) = 3,8 моль/л ρ (р-ра) = 1,17 г/мл | 1. Определим количество вещества KOH в 1 л раствора: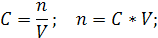 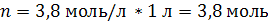 2. Определим массу KOH в 1 л раствора: 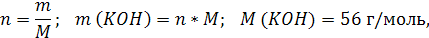 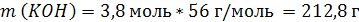 3. Определим массу 1 л (1000 мл) раствора: 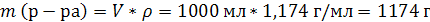 4. Определим массовую долю (%) едкого кали в растворе: 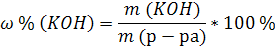 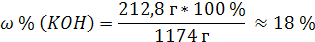 |
| Найти: ω % (KOH) | |
| Ответ: Массовая доля (%) KOH в растворе, молярность которого 3,8 моль/л, равна 18%. |
Предыдущая12345678Следующая
Дата добавления: 2016-10-17; просмотров: 22087; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Поделитесь с друзьями:
ПОИСК ПО САЙТУ:
ПОХОЖИЕ СТАТЬИ:
- 1 страница. Морской порт в современном значении этого понятия представляет собой специально построенное и оборудованное на побережье предприятие
- F Выполнение задания. — Для этого нажмите кнопку с изображением дискеты Сохранить на Панели быстрого доступа, а затем на кнопку Свернуть окна Word XP.
- Locatio conductio operis. Понятие и последствия этого договора
- Receptum nautarum, cauponum, stabulariorum. Понятие этого отношения
- А из этого следует первый вывод: прием сахарозаменителей провоцирует переедание!
- Административных правонарушениях. Перед тем как рассматривать основы производства по делам об административных правонарушениях и особенности этого производства в сфере таможенного дела дадим
- Адсорбция из растворов электролитов
пользователям VK интересно:
- Взаимосвязь юридической психологии с другими науками
- Биологическая роль буферных систем
- Плиты перекрытия
- Упражнений с гимнастической палкой
- Организация мероприятий по ликвидации незаразных болезней животных. Организация лечебных мероприятий
- Коррозионные диаграммы
- Дидактические принципы Каменского
- Кислотный и щелочной гидролиз пептидов.
- Производство строительной извести по мокрому способу из влажного мела
- Устройство и производительность дноуглубительных снарядов

Задача 1.Сколько граммов и молей вещества содержится в 100 мл 21% (по массе) раствора NaOH (ρ = 1,23 г/мл)?
Решение.Найдём массу раствора: mр-ра = V·ρ = 100 · 1,23 = 123 г.
Из формулы массовой доли выразим и найдём массу вещества:
Молярная масса NaOH равна 40 г/моль. Следовательно, число молей NaOH в растворе составит:
Задача 2. В 370 мл воды растворили 30 г медного купороса CuSO4· 5H2O. Найдите масоовую долю сульфата меди в полученном растворе.
Решение.Плотность воды равна 1 г/мл, тогда её масса: mводы = 370·1 = 370г.
Находим массу полученного раствора: mр-ра = mв-ва + mводы= 370 + 30=400 г.
Определяем массу безводного CuSO4 в 30 г медного купороса.
Молярная масса CuSO4·5H2O равна 250 г/моль.
Молярная масса CuSO4 равна 160 г/моль.
В 250 г CuSO4· 5H2O содержится 160 г CuSO4;
В 30 г CuSO4· 5H2O содержится х г CuSO4.
Таким образом, в растворе содержится 19,2 г безводного CuSO4 .
Рассчитываем массовую долю раствора:
Задача 3.К 200 мл 35 % (по массе) раствора NaOH (ρ = 1,38 г/мл) добавили 500 мл воды. Определите массовую долю полученного раствора.
Решение.Определим массу исходного раствора: mр-ра = V·ρ = 200·1,38=276 г
Найдём массу вещества в этом растворе:
В исходном растворе содержится 96,6 г NaOH. Такое же количество будет содержаться в растворе после его разбавления. Определим массу полученного раствора: mр-ра = 276 + 500 = 776 г.
Зная массу раствора и содержание в нём растворённого вещества, найдём масоовую долю полученного раствора NaOH:
Задача 4.Сколько граммов серной кислоты содержится в 400 мл 2 М раствора? Чему равны нормальность и титр этого раствора?
Решение.Молярная масса сернойкислоты равна 98 г/моль. Переводим объём раствора в литры Vр-ра = 400 мл = 0,4 л и находим массу серной кислоты:
mв = СM · Vр-ра · M = 2 · 0,4 · 98 = 78,4 г.
Находим эквивалентную массу H2SO4: .
Определяем нормальность раствора: .
Зная молярную концентрацию раствора, нормальную можно найти и другим способом. Т.к. молярная масса больше эквивалентной в (k · z) число раз, то эквивалентная концентрация во столько же раз больше молярной:
СН = СМ · (k · z) = 2 · 2 · 1 = 4 моль/л.
Находим титр раствора:
Задача 5.Вычислите эквивалентную концентрацию 49% (по массе) раствора H3PO4 (ρ = 1,33 г/мл).
Решение.Молярная масса фосфорной кислоты равна 98 г/моль. Её эквивалентная масса: .
Пусть объём раствора равен 1 л (1000 мл), тогда его масса:
mр-ра = V·ρ = 1000 · 1,33 = 1330 г.
Зная массовую долю раствора, найдём массу вещества, содержащегося в 1 л раствора:
Определяем нормальность раствора:
.
757. К 950 г воды прибавили 50 мл 48%-ного раствора H2SО4 (ρ = 1,38 г/мл). Вычислить массовую долю H2SO4 в полученном растворе.
758. Сколько литров 2,5 %-ного раствора NaOH (ρ = l,03 г/мл) можно приготовить из 80 мл 35%-ного раствора (ρ = l,38 г/мл)?
759. Смешаны 400 мл 1,2 М раствора NaOH и 600 мл 1,8 М раствора NaOH. Определите молярность полученного раствора.
760. Определите молярную и нормальную концентрацию 61,4 % (по массе) раствора MgSO4 ( = 1,31 г/мл).
761. Титр раствора серной кислоты H2SO4 равен 0,0049 г/мл. Какова нормальность этого раствора?
762. Какую массу металлического висмута можно растворить в 30 мл 20% (по массе) раствора HNO3 ( = 1,12 г/мл) ?
763. Смешали 2 л 10%-ного и 4 л 24%-ного раствора азотной кислоты. Чему равна массовая доля полученного раствора?
764. На нейтрализацию 20 мл 1 н. раствора гидроксида натрия пошло 20 мл раствора серной кислоты. Чему равна нормальность раствора кислоты?
765. На нейтрализацию 40 мл 0,1 н раствора азотной кислоты пошло 4 мл раствора гидроксида калия. Чему равна нормальность раствора щелочи?
766. На нейтрализацию 60 мл 0,25 н. H2SO4 пошло 180 мл раствора KOH. Чему равны нормальность и титр раствора KOH?
767. Для нейтрализации 20 мл 0,1 н. раствора кислоты потребовалось 12 мл раствора щелочи. Чему равна нормальность раствора щелочи?
768. Вычислить молярную концентрацию раствора K2SO4, в 20,0 мл которого содержится 1,74 г растворенного вещества. Какова нормальная концентрация этого раствора?
769. До какого объема нужно довести раствор, содержащий 25,0 г CuSO4, чтобы нормальная концентрация полученного раствора была 0,50 н.?
770. Вычислить молярность 10%-ного раствора азотной кислоты, плотность которого 1,056 г/мл.
771. Сколько миллилитров 10%-ного раствора хлорида бария ( = 1,09 г/мл), требуется для реакции с сульфатом натрия, содержащимся в 20 мл 10%-ного раствора ( = 1,07 г/мл)?
772. Сколько миллилитров 10% раствора соляной кислоты ( =1,05 г/мл), требуется для нейтрализации гидроокиси натрия, содержащейся в 100 мл 2% раствора ( = 1,022 г/мл)?
773. Сколько миллилитров 20%раствора соляной кислоты ( = 1,1 г/мл), требуется для растворения 10,0 г карбоната кальция?
774. Вычислить, достаточно ли 20 мл 30% раствора серной кислоты ( = 1,22 г/мл) для растворения 6,54 г цинка.
775. Сколько граммов NaOH необходимо взять для приготовления 125 мл 0,15 M раствора?
776. Сколько миллилитров 70% H2SO4 (ρ=1,622 г/мл) надо взять для приготовления 25 мл 2 M раствора?
777. Сколько граммов HNO3 содержится в 200 мл 0,1 M раствора?
778. Чему равна молярность раствора, содержащего в 0,75 л 4,41 г поваренной соли?
779. В каком объеме 0,1 M раствора содержится 7,1 г Na2SO4?
780. Сколько граммов Na2CO3 содержится в 500 мл 0,1 н. раствора?
781. Какова нормальная концентрация раствора, 800 мл которого содержат 12,25 г H2SO4?
782. Сколько воды надо прибавить к 200 мл 1 н. раствора NaOH, чтобы получить 0,05 н. раствор?
783. До какого объема следует упарить 3,5 л 0,04 н. раствора KOH для получения 0,1 н. раствора?
784. До какого объема следует разбавить водой 2,4 л 1,6 н. раствор HCl для получения 0,25 н. раствора?
785. Чему равна массовая доля H2SO4 в ее 10 н. растворе (ρ = 1,29 г/мл)?
786. Смешаны 800 мл 3 н. раствора KOH и 1,2 л 12% раствора KOH (ρ =1,10 г/мл). Вычислить нормальную концентрацию полученного раствора.
787. Какой объём 40% (по массе) раствора H3PO4 ( = 1,25 г/мл) потребуется для приготовления 3 л 0,15 н. раствора ортофосфорной кислоты ?
788. Рассчитайте молярность и нормальность 65% (по массе) раствора Pb(NO3)2 ( = 1,25 г/мл).
789. Определите молярную и нормальную концентрацию 61,4% (по массе) раствора MgSO4 ( = 1,31 г/мл).
790. Титр раствора серной кислоты равен 0,0049 г/мл. Какова нормальность этого раствора?
791. Какой объём 10% (по массе) раствора хлороводородной кислоты ( =1,049 г/мл) нужно взять для приготовления 1 л 0,2 н. раствора HCl?
792. На нейтрализацию 20 мл раствора H2SO4 израсходовано 25 мл 0,005 н. раствора NaOH. Найдите титр и нормальность раствора кислоты.
793. Вычислите массовую долю 9 н. раствора KOH ( = 1,310 г/мл).
794. Какую массу воды необходимо прибавить к 500 мл 20% (по массе) раствора NaCl ( = 1,152 г/мл), чтобы получить 4,5% (по массе) раствор ( = 1,029 г/мл)?
795. Какой объём 25% (по массе) раствора NaOH ( = 1,2 г/мл) потребуется, чтобы полностью прореагировало 250 мл 2 М раствора FeCl3?
796. Определите массовую долю раствора Na2CO3, полученного при растворении 12 г кристаллогидрата соды Na2CO3 · 10 H2O в 150 г воды.
797. Рассчитайте массу 5% (по массе) раствора MgSO4, для приготовления которого взято 400 г кристаллогидрата MgSO4 · 7H2O.
798. Сколько воды необходимо добавить к 3 л раствора с массовой долей KOH 50% ( = 1,29 г/мл) для приготовления 10% (по массе) раствора KOH ( =1,09 г/мл)?
799. Какой объём 40% (по массе) раствора H3PO4 ( = 1,25 г/мл) потребуется для приготовления 3 л 0,15 н. раствора ортофосфорной кислоты?
800. Рассчитайте молярность и нормальность 65% (по массе) раствора Pb(NO3)2 ( = 1,25 г/мл).
801. Смешаны 400 мл 1,2 М раствора NaOH и 600 мл 1,8 М раствора NaOH. Определите молярность полученного раствора.
802. Какую массу металлического висмута можно растворить в 70 мл 20% (по массе) раствора HNO3 ( = 1,12 г/мл)?
803. Вычислите молярность и нормальность 4,6% (по массе) раствора буры Na2B4O7 ( = 1,02 г/мл).
804. Какой объём раствора NaOH с массовой долей 25% ( =1,269 г/мл) необходим для нейтрализации 0,5 кг серной кислоты H2SO4?
805. Определите массу хлорида кальция, необходимую для приготовления 2 л раствора ( = 1,177 г/мл) с массовой долей CaCl2 20%.
806. До какого объёма следует разбавить водой 2,4 л 0,03 н. раствора Na2SO4 для получения 0,01н. раствора?
807. Рассчитайте объём 38% (по массе) раствора HCl ( = 1,19 г/мл), который необходим для приготовления 1 л 2 М раствора HCl.
808. Какой объём 15% раствора H2SO4 ( = 1,1 г/мл) потребуется для полного растворения 35 г алюминия?
809. Определите молярную концентрацию 30% (по массе) раствора азотной кислоты ( = 1,2 г/мл).
810. Растворимость NaCl при 250С равна 36,0 г в 100 г воды. Определите массовую долю хлорида натрия в насыщенном растворе при этой же температуре.
811. Определите массу хлороводорода, который содержится в 0,25 л раствора соляной кислоты с массовой долей HCl 15% ( = 1,035 г/мл).
812. Рассчитайте мольные доли этилового спирта и воды в 96% (по массе) растворе С2Н5ОН.
813. Какую массу медного купороса CuSO4·5H2O и воды следует взять для приготовления 4 кг 20% (по массе) раствора сульфата меди (II) CuSO4?
814. Определите массовую долю раствора HNO3, если к 40 мл 96% раствора HNO3 ( = 1,5 г/мл) добавили 30 мл 48% раствора HNO3 ( = 1,3 г/мл).
815. Какой объём 1 н раствора можно приготовить из 1кг 63% (по массе) раствора НNO3 (ρ = 1,32 г/мл)?
816. Сколько граммов 2,5% (по массе) раствора НCl требуется для взаимодействия со 150 мл 3 н раствора Na2CO3 (ρ = 1,5 г/мл)?
817. Определите нормальность раствора, полученного смешением 400 мл 1,2 н. и 600 мл 1,8 н. раствора NaOH.
818. Определите массовую долю КСlO3 в насыщенном при 400С растворе, если растворимость бертолетовой соли при этой температуре равна 14г.
819. В 500 г воды растворили 100 л хлороводорода, измеренного при 200С и давлении 100 кПа. Вычислите массовую долю HCl в полученном растворе хлороводородной кислоты.
820. Какова молярность, нормальность и титр 20% (по массе) раствора КNO3 ( =1,2 г/мл)?
821. Чему равны титр и массовая доля 5 н. раствора Н2SO4 ( = 1,29 г/мл)?
822. Какой объём 5 М раствора NaCl необходимо взять для приготовления 25 мл 4. н раствора хлорида натрия.
823. На нейтрализацию 50 мл раствора NaOH пошло 24 мл 0,5 н. раствора серной кислоты. Какова нормальность раствора гидроксида натрия?
824. Определите массовую долю раствора, полученного при растворении 10 л (н. у.) сероводорода H2S в 400 г воды.
825. Какой объём 15% (по массе) раствора H2SO4 ( = 1,1 г/мл) потребуется для полного растворения 5 г магния?
826. Какую массу глауберовой соли Na2SO4·10 H2O следует растворить в 300 г воды для получения раствора, содержащего 5% (масс.) сульфата натрия?
827. Какой объём 0,1 н. раствора серной кислоты можно приготовить из 150 мл 10% раствора H2SO4 (ρ = 1,22 г/мл)?
828. На нейтрализацию 10 мл раствора щелочи израсходовано 30 мл 0,2 н. раствора серной кислоты. Какова нормальность раствора щелочи? Сколько 0,1 н. раствора HCl потребовалось бы для той же цели?
829. Какой объём 10% (по массе) раствора хлороводородной кислоты ( = 1,049 г/мл) нужно взять для приготовления 1 л 0,2 н. раствора HCl ?
830. На нейтрализацию 20 мл раствора H2SO4 израсходовано 25 мл 0,015 н. раствора NaOH. Найдите титр и нормальность раствора кислоты.
831. Вычислите массовую долю 9 н. раствора KOH ( = 1,310 г/мл).
832. Какую массу воды необходимо прибавить к 500 мл 20% (по массе) раствора NaCl ( = 1,152 г/мл), чтобы получить 4% (по массе) раствор ( = 1,029 г/мл)?
833. Определите массу хлорида кальция, необходимую для приготовления 2 л раствора ( = 1,177 г/мл) с массовой долей CaCl2 20%.
834. До какого объёма следует разбавить водой 2,4 л 0,03 н. раствора Na2SO4 для получения 0,01 н. раствора ?
835. Вычислите молярность и нормальность 5% (по массе) раствора буры Na2B4O7 ( = 1,1 г/мл).
836. Какой объём раствора NaOH с массовой долей 45% ( = 1,35 г/мл) необходим для нейтрализации 0,5 кг серной кислоты H2SO4?
837. Какой объём 25% (по массе) раствора NaOH ( = 1,2 г/мл) потребуется, чтобы полностью прореагировало 250 мл 2 М раствора FeCl3.
838. Определите массовую долю раствора Na2CO3, полученного при растворении 12 г кристаллогидрата соды Na2CO3 · 10 H2O в 150 г воды.
839. Рассчитайте массу 5% (по массе) раствора MgSO4, для приготовления которого взято 400 г кристаллогидрата MgSO4 · 7H2O.
840. Сколько воды необходимо добавить к 3 л раствора с массовой долей KOH 50% ( = 1,29 г/мл) для приготовления 10% (по массе) раствора KOH ( = 1,09г/мл)?
841. Определите массовую долю хлорида калия в растворе содержащем 0,072г КС1 в 0,3 л раствора плотность которого 1,12 г/ мл.
842. Вычислите эквивалентную, молярную концентрации и моляльность раствора в котором массовая доля СаСО3 равна 5%. Плотность раствора равна 1,12 г/мл.
843. Сколько воды необходимо прибавить к 100 мл 20% (по массе) раствора HCl (ρ=1,10 г/мл), чтобы получить 5% (по массе) раствор?
844. Сколько миллилитров 30% (по массе) раствора HNO3 (ρ = 1,205 г/мл) нужно взять для приготовления 0,5 л 1 н. раствора?
845. Какой объем воды следует прибавить к 200 мл 50% (по массе) раствора НNОз (ρ = 1,316 г/мл) для получения 10% (по массе) раствора.
846. К 500 мл раствора КОН с массовой долей 0,36 (ρ = 1,358 г/мл) добавили 125,7 г КОН. Вычислите массовую долю полученного раствора.
847. Сколько граммов BaSО4 выпадет в осадок, если к 200 мл 0,5 н раствора BaCl2 прибавить 50 мл 0,3 н. раствора Na2SO4?
848. Титр раствора фосфорной кислоты равен 0,02486 г/мл. Какой объем этого раствора потребуется для взаимодействия с 50 мл 0,2 н. раствора КОН?
849. Вычислите объем воды, который необходимо прибавить к 100 мл 26%(по массе) раствора серной кислоты (ρ = 1,190 г/мл), чтобы получить 5% раствор.
850. Смешали 100 мл раствора H2SО4 с массовой долей 0,5 (ρ = 1,399 г/мл) и 20 мл раствора H2SО4 с массовой долей 0,1 (ρ = 1,070 г/мл) и добавили воды до 2 л. Определите нормальность полученного раствора.
851. Вычислите объем раствора серной кислоты с массовой долей 0,08 (ρ = 1,055 г/мл), который необходим для приготовления 3 л 0,1 н. раствора. Какова молярность приготовленного раствора?
852. Вычислите молярность, моляльность и нормальность 10% (по массе) раствора серной кислоты (ρ = 1,069 г/мл).
853. Какой объем 0,15 М раствора Н3РО4 можно приготовить из 55 мл 0,45 н. раствора? Определите нормальность полученного раствора.
854. Какой объем 0,2 н. раствора щелочи потребуется для осаждения в виде Fе(ОН)3 всего железа, содержащегося в 10 мл 0,5 н. раствора FеС1з? Определите массу осадка.
855. Определить молярную и нормальную концентрации 16% (по массе) раствора NaOH (ρ=1,18 г/мл).
856. На нейтрализацию 20 мл раствора NaOH потребовалось 40 мл 6% (по массе) раствора НС1 (ρ = 1,029 г/мл). Вычислите нормальность раствора щелочи.
857. Чему равна молярная концентрация 20% (по массе) раствора HCl (ρ = 1,10 г/мл)?
858. Сколько миллилитров 10% (по массе) раствора соляной кислоты (ρ = 1,049 г/мл) нужно взять для приготовления 0,1 л 0,2 н. раствора?
859. До какого объема следует упарить 3,5 л 0,04 н. раствора KOH для получения 0,1 н. раствора?
860. Сколько граммов KCl следует добавить к 450 г 8% (по массе) раствора той же соли для получения 12% (по массе) раствора?
861. До какого объема следует разбавить водой 2,4 л 1,6 н. раствор HCl для получения 0,25 н. раствора?
862. Сколько миллилитров 96% (по массе) раствора H2SO4 (ρ = l,84 г/мл) нужно взять для приготовления. 1 л 0,5 н. раствора?
863. Чему равна массовая доля H2SO4 в ее 8 н. растворе (ρ = 1,2 г/мл)?
864. Сколько миллилитров 70% (по массе) раствора H2SO4 (ρ = 1,622 г/мл) надо взять для приготовления 70 мл 2 M раствора?
865. Сколько воды необходимо прибавить к 500 мл 20% (по массе) раствора NaCl (ρ= 1,152 г/мл), чтобы получить 2,5% (по массе) раствор?
866. Смешано 250 мл 0,1 Mраствора H2SO4 и 100 мл 0,5 Mраствора NaOH. Какое вещество и в каком избытке было взято?
867. Образец технической каустической соды содержит 92% (по массе) NaOH. Сколько по весу надо взять этого образца для приготовления 10 л 2 Mраствора NaOH?
868. Сколько миллилитров 0,25 н. раствора H2SO4 потребуется для осаждения в виде BaSO4 всего бария, содержащегося в 20 мл 2 н. раствора BaCl2?
869. Сколько граммов KCl следует растворить в 100 г воды для получения 5% (по массе) раствора?
870. 1 мл34% (по массе) раствора содержит 0,426 грастворенного вещества. Чему равна плотность этого раствора?
871. Насыщенный при 150C раствор K2CO3 (поташ) содержит 51,3% (по массе) растворенного вещества (ρ =.1,563 г/мл). Вычислить, сколько граммов K2CO3 содержится в 1 л такогораствора.
872. Сколько миллилитров 20% (по массе) раствора HCl (ρ = 1,10 г/мл) следует добавить к 4 л 0,6 н. раствора HCl для получения 1 н. раствора?
873. Сколько миллилитров 0,1 н. раствора щелочи потребуется для осаждения в виде Fe(OH)3 всего железа, содержащегося в 200 мл 0,2 н. раствора FeCl3?
874. Сколько литров 2,5% (по массе) раствора NaOH (ρ = l,03 г/мл) можно приготовить из 80 мл 35% (по массе) раствора (ρ = l,38 г/мл)?
875. Чему равна молярная концентрация раствора, который содержит в 3 л 175,5 г поваренной соли?
876. 600 млраствора NaOH содержат 8 грастворенного вещества. Чему равна молярность раствора?
877. На нейтрализацию 10 мл раствора щелочи израсходовано 30 мл 0,6 н. раствора серной кислоты. Какова нормальность раствора щелочи? Сколько 0,1 н. раствора HCl потребовалось бы для той же цели?
878. Для осаждения всего хлора, содержащегося в 15 мл раствора NaCl, израсходовано 35 мл 0,1 н. раствора AgNO3. Сколько граммов NaCl содержит 1 л этого раствора?
879. Определите титр и нормальность 0,7 н. раствора фосфорной кислоты. Какой объем этого раствора потребуется для взаимодействия с 45 мл 0,1 н. раствора NaOH?
880. В 1000 г воды содержится 250 г КОН. Вычислите массовую долю, моляльную и нормальную концентрацию этого раствора. Плотность раствора 1,156 г/мл.
881. Какой объем воды следует прибавить к 100 мл 40% (по массе) раствора НNОз (ρ = 1,316 г/мл) для получения 10% (по массе) раствора.
882. К 500 мл раствора КОН с массовой долей 0,36 (ρ = 1,358 г/мл) добавили 15,7 г КОН. Вычислите массовую долю полученного раствора.
883. Вычислите объем воды, который необходимо прибавить к 100 мл 26% (по массе) раствора серной кислоты (ρ = 1,190 г/мл), чтобы получить 5% (по массе) раствор.
884. Смешали 100 мл раствора H2SО4 с массовой долей 0,5 (ρ = 1,399 г/мл) и 20 мл раствора H2SО4 с массовой долей 0,1 (ρ = 1,070 г/мл) и добавили воды до 3 л. Определите нормальность полученного раствора.
885. Вычислите массовую долю азотной кислоты в растворе и моляльность 8 н. раствора азотной кислоты (ρ = 1,246 г/мл).
886. Смешаны 200 мл 1,2 М раствора гидроксида натрия и 800 мл 1,8 М раствора NaOH. Какова молярная концентрация полученного раствора?
887. Водный раствор содержит 577 г серной кислоты в 1 литре (ρ = 1,335 г/мл). Вычислите массовую долю, молярную концентрацию, моляльность и мольные доли серной кислоты и воды в полученном растворе.
888. Определите эквивалентную концентрацию, моляльность и массовую долю сульфата железа (III) в растворе 0,8 М раствора сульфата железа (III), если плотность раствора равна 1,01 г/ мл.
889. В растворе объемом 200 мл содержится гидроксид натрия массой 12 г. Определите молярную концентрации и титр данного раствора.
890. Сколько мл 6 М раствора H3PO4 необходимо взять для приготовления из него раствора кислоты объемом 0,5 л с эквивалентной концентрацией 0,1 моль/л?
891. До какого объема нужно разбавить 30% (по массе) раствор нитрата свинца (II) объемом 25 мл (ρ = 1,33 г/мл), чтобы получить раствор соли с концентрацией СМ = 0,2 моль/л и плотностью 1,08 г/мл?
892. До какого объема следует разбавить раствор НС1 объемом 25 мл с эквивалентной концентрацией 6 моль/л, чтобы концентрация стала равной 0,2 моль/л?
893. Вычислите эквивалентную массу двухосновной кислоты, в 12,5 н растворе которой массовая доля этой кислоты 37% (ρ = 1,664 г/мл.). Какая это кислота? Чему равны молярная концентрация, моляльность и титр раствора этой кислоты?
894. Какой объем раствора серной кислоты с массовой долей 96% (ρ = 1,835 г/мл) нужно взять для приготовления 5 л 0,5 н. раствора серной кислоты?
895. Смешаны 0,8 л 1,5 н раствора гидроксида натрия и 0,4 л 0,6 н раствора гидроксида натрия. Какова молярная концентрация полученного раствора?
896. Какой объем раствора фосфорной кислоты с массовой долей Н3РО4 36 % (ρ = 1,216 г/мл) требуется для приготовления 13 литров 0,15 н. раствора фосфорной кислоты.
897. Вычислите молярную, эквивалентную концентрации и моляльность раствора серной с массовой долей Н2SO4 20% (ρ = 1,14 г / мл).
898. Какой объем раствора с массовой долей соляной кислоты 10% (ρ = 1,049 г/мл) надо взять для приготовления раствора объемом 350 мл с молярной концентрацией 0,2 моль /л?
899. В 45 г воды растворено 6,84 г сахара. Вычислите молярные доли сахара и воды.
900. Рассчитайте эквивалентную концентрацию и титр раствора иодида калия 1 литр которого содержит 0,0037 г иодида калия.
Раздел VII. Коллигативные свойства растворов
[1, с.; 2, с.105-110; 3, с. 205-208; 4, с.209-214; 5, с.132-140]
Рекомендуемые страницы:
