В каких веществах содержится водород

Обобщающая схема «ВОДОРОД»
I.
Водород – химический элемент
а) Положение в ПСХЭ
- порядковый номер №1
- период 1
- группа I (главная подгруппа «А»)
- относительная масса Ar(Н)=1
- латинское название Hydrogenium (рождающий
воду)
б) Распространённость водорода в
природе
Водород — химический элемент. | В земной коре (литосфера и гидросфера) – 1% по массе (10 место |
АТМОСФЕРА — 0,0001% по числу атомов | |
Самый распространённый элемент во вселенной – 92% от числа всех атомов |
Водород – химический элемент | В соединениях | Н2О – вода (11% по массе) |
СН4 – газ метан (25% по массе) | ||
Органические вещества (нефть, горючие природные газы и В организмах животных и растений (то есть в составе белков, В теле человека в среднем содержится около 7 килограммов водорода. |
в) Валентность водорода в соединениях
I Н2 ↑,
ц, з, Mr(Н2)=2,
газ легче воздуха
H2O – вода;
Н2О2 —
перекись водорода
II. Водород – простое вещество (Н2)
Получение
1.Лаборатория А) Взаимодействие металлов с кислотами: Zn + 2HCl = ZnCl2 + H2↑ соль Б) Взаимодействие активных металлов с водой: 2Na + 2H2O = 2NaOH + H2↑ |
2. · эл. ток 2H2O = · t, Ni CH4 + 2H2O = |
Нахождение
водорода в природе.
Водород широко
распространен в природе, его содержание в земной коре (литосфера и гидросфера) составляет
по массе 1%, а по числу атомов 16%. Водород входит в состав самого
распространенного вещества на Земле — воды (11,19% Водорода по массе), в состав
соединений, слагающих угли, нефть, природные газы, глины, а также организмы
животных и растений (то есть в состав белков, нуклеиновых кислот, жиров,
углеводов и других). В свободном состоянии Водород встречается крайне редко, в
небольших количествах он содержится в вулканических и других природных газах.
Ничтожные количества свободного Водорода (0,0001% по числу атомов) присутствуют
в атмосфере. В околоземном пространстве Водород в виде потока протонов образует
внутренний («протонный») радиационный пояс Земли. В космосе Водород
является самым распространенным элементом. В виде плазмы он составляет около
половины массы Солнца и большинства звезд, основную часть газов межзвездной
среды и газовых туманностей. Водород присутствует в атмосфере ряда планет и в
кометах в виде свободного Н2, метана СН4, аммиака NH3,
воды Н2О, радикалов. В виде потока
протонов Водород входит в состав корпускулярного излучения Солнца и космических
лучей.
Существуют три изотопа водорода:
а) легкий водород – протий,
б) тяжелый водород – дейтерий (D),
в) сверхтяжелый водород – тритий (Т).
Тритий неустойчивый
(радиоактивный) изотоп, поэтому в природе он практически не встречается.
Дейтерий устойчив, но его очень мало: 0,015% (от массы всего земного водорода).
Валентность
водорода в соединениях
В соединениях водород
проявляет валентность I.
Физические
свойства водорода
Простое вещество
водород (Н2) – это газ, легче воздуха, без цвета, без запаха, без
вкуса, tкип = – 2530С, водород в воде нерастворим , горюч. Собирать водород можно путем вытеснения
воздуха из пробирки или воды. При этом пробирку нужно перевернуть вверх дном.
Получение
водорода
В лаборатории водород
получают в результате реакции
Видео — Эксперимент
«Получение водорода и проверка его на чистоту»
Zn + H2SO4
= ZnSO4 + H2
.
Вместо цинка можно
использовать железо, алюминий и некоторые другие металлы, а вместо серной
кислоты – некоторые другие разбавленные кислоты. Образующийся водород собирают
в пробирку методом вытеснения воды (см. рис. 10.2 б) или просто в
перевернутую колбу (рис. 10.2 а).
В промышленности в больших
количествах водород получают из природного газа (в основном это метан) при
взаимодействии его с парами воды при 800 °С в присутствии никелевого
катализатора:
CH4 + 2H2O = 4H2 +CO2
(t, Ni)
или обрабатывают при
высокой температуре парами воды уголь:
2H2O + С =
2H2 + CO2. (t)
Чистый водород получают
из воды, разлагая ее электрическим током (подвергая электролизу):
2H2O = 2H2+ O2(электролиз).
Дополнительно:
Видео — Эксперимент
«Мыльные пузыри с водородом»
ТРЕНАЖЁРЫ
Тренажёр №1- Нахождение
водорода в природе. Физические свойства
Тренажёр №2 —
Характеристика водорода по положению в Периодической системе элементов Д. И.
Менделеева
АЛГОРИТМ СОСТАВЛЕНИЯ УХР ПОЛУЧЕНИЯ ВОДОРОДА
Если кислород является самым распространенным химическим элементом на Земле, то водород – самый распространенный элемент во всей Вселенной. Наше Солнце (и другие звезды) примерно на половину состоит из водорода, а что касается межзвездного газа, то он на 90% состоит из атомов водорода. Немалое место этот химический элемент занимает и на Земле, ведь вместе с кислородом он входит в состав воды, а само его название «водород» происходит от двух древнегреческих слов: «вода» и «рожаю». Помимо воды водород присутствует в большинстве органических веществ и клеток, без него, как и без кислорода, была бы немыслима сама Жизнь.
История открытия водорода
Первым среди ученых водород заметил еще великий алхимик и лекарь средневековья Теофраст Парацельс. В своих алхимических опытах, в надежде отыскать «философский камень» смешивая металлы с кислотами Парацельс получил некий неизвестный до того горючий газ. Правда отделить этот газ от воздуха так и не удалось.
Только спустя полтора века после Парацельса французскому химику Лемери таки удалось отделить водород от воздуха и доказать его горючесть. Правда Лемери так и не понял, что полученный им газ является чистым водородом. Параллельно подобными химическими опытами занимался и русский ученый Ломоносов, но настоящий прорыв в исследовании водорода был сделан английским химиком Генри Кавендишом, которого по праву считают первооткрывателем водорода.
В 1766 году Кавендишу удалось получить чистый водород, который он называл «горючим воздухом». Еще через 20 лет талантливый французский химик Антуан Лавуазье смог синтезировать воду и выделить из нее этот самый «горючий воздух» – водород. И к слову именно Лавуазье предложил водороду его название – «Hydrogenium», он же «водород».

Антуан Лавуазье со своей женой, помогавшей ему проводить химические опыты, в том числе и по синтезу водорода.
Водород в таблице Менделеева
В основе расположения химических элементов в периодической системе Менделеева лежит их атомный вес, рассчитанный относительно атомного веса водорода. То есть иными словами водород и его атомный вес является краеугольным камнем таблицы Менделеева, той точкой опоры, на основе которой великий химик создал свою систему. Поэтому не удивительно, что в таблице Менделеева водород занимает почетное первое место.

Помимо этого водород имеет такие характеристики:
- Атомная масса водорода составляет 1,00795.
- У водорода в наличии три изотопа, каждый из которых обладает индивидуальными свойствами.
- Водород – легкий элемент имеющий малую плотность.
- Водород обладает восстановительными и окислительными свойствами.
- Вступая в химические реакции с металлами, водород принимает их электрон и стает окислителем. Подобные соединения называются гидратами.
Строение молекулы водорода
Водород это газ, молекула его состоит из двух атомов.
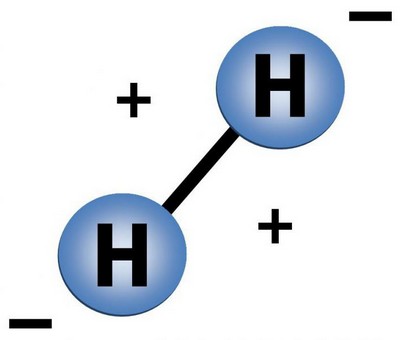
Так схематически выглядит молекула водорода.
Молекулярный водород, образованный из таких вот двухатомных молекул взрывается при поднесенной горящей спичке. Молекула водорода при взрыве распадается на атомы, которые превращаются в ядра гелия. Именно таким образом происходят ядерные реакции на Солнце и других звездах – за счет постоянного распадение молекул водорода наше светило горит и обогревает нас своим теплом.
Физические свойства водорода
У водорода в наличие следующие физические свойства:
- Температура кипения водорода составляет 252,76 °C;
- А при температуре 259,14 °C он уже начинает плавиться.
- В воде водород растворяется слабо.
- Чистый водород – весьма опасное взрывчатое и горючее вещество.
- Водород легче воздуха в 14,5 раз.
Химические свойства водорода
Поскольку водород может быть в разных ситуациях и окислителем и восстановителем его используют для осуществления реакций и синтезов.
Окислительные свойства водорода взаимодействуют с активными (обычно щелочными и щелочноземельными) металлами, результатом этих взаимодействий является образование гидридов – солеподобных соединений. Впрочем, гидриды образуются и при реакциях водорода с малоактивными металлами.
Восстановительные свойства водорода обладают способностью восстанавливать металлы до простых веществ из их оксидов, в промышленности это называется водородотермией.

Как получить водород?
Среди промышленных средств получения водорода можно выделить:
- газификацию угля,
- паровую конверсию метана,
- электролиз.
В лаборатории водород можно получить:
- при гидролизе гидридов металлов,
- при реакции с водой щелочных и щелочноземельных металлов,
- при взаимодействии разбавленных кислот с активными металлами.
Применение водорода
Так как водород в 14 раз легче воздуха, то в былые времена им начиняли воздушные шары и дирижабли. Но после серии катастроф произошедших с дирижаблями конструкторам пришлось искать водороду замену (напомним, чистый водород – взрывоопасное вещество, и малейшей искры было достаточно, чтобы случился взрыв).

Взрыв дирижабля Гинденбург в 1937 году, причиной взрыва как раз и стало воспламенение водорода (вследствие короткого замыкания), на котором летал этот огромный дирижабль.
Поэтому для подобных летательных аппаратов вместо водорода стали использовать гелий, который также легче воздуха, получение гелия более трудоемкое, зато он не такой взрывоопасный как водород.
Тем не менее, водород весьма хорошо зарекомендовал себя в качестве одного из компонентов ракетного топлива. А автомобили, работающие на водородном топливе более экологичнее своих дизельных и бензиновых собратьев.
Также с помощью водорода производится очистка различных видов топлива, в особенности на основе нефти и нефтепродуктов.
Водород, видео
И в завершение образовательное видео по теме нашей статьи.

Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Водород – первый химический элемент Периодической Системы химических элементов Д.И. Менделеева. Химический элемент водород расположен в первой группе, главной подгруппе, первом периоде Периодической Системы.
Относительная атомная масса водорода = 1.
Водород имеет наиболее простое строение атома, он состоит из единственного электрона, который находится в околоядерном пространстве. Ядро атома водорода состоит из одного протона. Атом водорода, в химических реакциях может как отдавать, так и присоединять электрон, образуя два вида ионов:
H0 + 1ē → H1 − H0 – 1ē → H1+.
Водород – самый распространённый элемент во Вселенной. На его долю приходится около 88,6% всех атомов (около 11,3% составляют атомы гелия, доля всех остальных вместе взятых элементов – порядка 0,1%). Таким образом, водород – основная составная часть звёзд и межзвёздного газа. В межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Массовая доля водорода в земной коре составляет 1%.
Это девятый по распространённости элемент. Значение водорода в химических процессах, происходящих на Земле, почти так же велико, как и кислорода. В отличие от кислорода, существующего на Земле и в связанном, и в свободном состояниях, практически весь водород на Земле находится в виде соединений; лишь в очень незначительном количестве водород в виде простого вещества содержится в атмосфере (0,00005% по объёму для сухого воздуха).
Водород входит в состав практически всех органических веществ и присутствует во всех живых клетках.
Физические свойства водорода
Простое вещество, образованное химическим элементом водородом, имеет молекулярное строение. Его состав отвечает формуле Н2. Как и химический элемент, простое вещество также называют водородом.
Водород – бесцветный газ без запаха и вкуса, практически нерастворим в воде. При комнатной температуре и нормальном атмосферном давлении растворимость составляет 18,8 мл газа на 1 л воды.
Водород – самый легкий газ, его плотность составляет 0,08987 г/л. Для сравнения: плотность воздуха равна 1,3 г/л.
Водород способен растворяться в металлах, так например, в одном объеме палладия может раствориться до 850 объемов водорода. Из-за крайне малого размера молекул водород способен к диффузии через многие материалы Подобно другим газам водород при низких температурах конденсируется в бесцветную прозрачную жидкость, это происходит при температуре –252,8°С.
При достижении температуры –259,2°С водород кристаллизуется в виде белых кристаллов, похожих на снег. В отличие от кислорода, для водорода не характерна аллотропия
Применение водорода
Водород используют в различных отраслях промышленности. Много водорода уходит на производство аммиака (NH3). Из аммиака получают азотные удобрения, синтетические волокна и пластмассы, лекарства. В пищевой промышленности водород используют при производстве маргарина, в состав которого входят твердые жиры. Чтобы их получить из жидких жиров, через них пропускают водород. Когда водород горит в кислороде, то температура пламени составляет около 2500°C. При такой температуре можно плавить и сваривать тугоплавкие металлы. Таким образом, водород используется при сварке.
Смесь жидких водорода и кислорода применяют как ракетное топливо.
В настоящее время в ряде стран начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт – вода, а не углекислый газ, вызывающий парниковый эффект. Ученые предполагают, что в середине XXI века должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
В конце XIX – начале ХХ веков, на заре эры воздухоплавания, водородом заполняли воздушные шары, дирижабли и аэростаты, так как он намного легче воздуха. Однако эпоха дирижаблей начала стремительно уходить в прошлое после катастрофы, случившейся с дирижаблем Гинденбург. 6 мая 1937 года дирижабль, заполненный водородом, загорелся, что повлекло за собой гибель десятков его пассажиров. Водород крайне взрывоопасен в определенной пропорции с кислородом. Несоблюдение правил техники безопасности и привело к воспламенению и взрыву дирижабля.
Итог статьи:
- Водород – первый химический элемент Периодической Системы химических элементов Д.И. Менделеева
- Водород расположен в I группе, главной подгруппе, 1 периоде Периодической Системы
- Валентность водорода в соединениях – I
- Водород – бесцветный газ без запаха и вкуса, практически нерастворим в воде
- Водород – самый легкий газ
- При низких температурах получают жидкий и твердый водород
- Водород способен растворяться в металлах
- Сферы применения водорода разнообразны
В периодической системе водород располагается в двух абсолютно противоположных по своим свойствам группах элементов. Данная особенность делают его совершенно уникальным. Водород не просто представляет собой элемент или вещество, но также является составной частью многих сложных соединений, органогенным и биогенным элементом. Поэтому рассмотрим его свойства и характеристики более подробно.
История открытия водорода

Выделение горючего газа в процессе взаимодействия металлов и кислот наблюдали еще в XVI веке, то есть во время становления химии как науки. Известный английский ученый Генри Кавендиш исследовал вещество, начиная с 1766 года, и дал ему название «горючий воздух». При сжигании этот газ давал воду. К сожалению, приверженность ученого теории флогистона (гипотетической «сверхтонкой материи») помешала ему прийти к правильным выводам.
Французский химик и естествоиспытатель А. Лавуазье вместе с инженером Ж. Менье и при помощи специальных газометров в 1783 г. провел синтез воды, а после и ее анализ посредством разложения водяного пара раскаленным железом. Таким образом, ученые смогли прийти к правильным выводам. Они установили, что «горючий воздух» не только входит в состав воды, но и может быть получен из нее.
В 1787 году Лавуазье выдвинул предположение, что исследуемый газ является простым веществом и, соответственно, относится к числу первичных химических элементов. Он назвал его hydrogene (от греческих слов hydor — вода + gennao — рождаю), т. е. «рождающий воду».
Русское название «водород» в 1824 году предложил химик М. Соловьев. Определение состава воды ознаменовало конец «теории флогистона». На стыке XVIII и XIX веков было установлено, что атом водорода очень легкий (по сравнению с атомами прочих элементов) и его масса была принята за основную единицу сравнения атомных масс, получив значение, равное 1.
Физические свойства

Водород является легчайшим из всех известных науке веществ (он в 14,4 раз легче воздуха), его плотность составляет 0,0899 г/л (1 атм, 0 °С). Данный материал плавится (затвердевает) и кипит (сжижается), соответственно, при -259,1 °С и -252,8 °С (только гелий обладает более низкими t° кипения и плавления).
Критическая температура водорода крайне низка (-240 °С). По этой причине его сжижение — довольно сложный и затратный процесс. Критическое давление вещества — 12,8 кгс/см², а критическая плотность составляет 0,0312 г/см³. Среди всех газов водород имеет наибольшую теплопроводность: при 1 атм и 0 °С она равняется 0,174 вт/(мхК).
Удельная теплоемкость вещества в тех же условиях — 14,208 кДж/(кгхК) или 3,394 кал/(гх°С). Данный элемент слабо растворим в воде (около 0,0182 мл/г при 1 атм и 20 °С), но хорошо — в большинстве металлов (Ni, Pt, Pa и прочих), особенно в палладии (примерно 850 объемов на один объем Pd).
С последним свойством связана его способность диффундирования, при этом диффузия через углеродистый сплав (к примеру, сталь) может сопровождаться разрушением сплава из-за взаимодействия водорода с углеродом (этот процесс называется декарбонизация). В жидком состоянии вещество очень легкое (плотность — 0,0708 г/см³ при t° = -253 °С) и текучее (вязкость — 13,8 спуаз в тех же условиях).
Химические свойства водорода

Во многих соединениях этот элемент проявляет валентность +1 (степень окисления), подобно натрию и прочим щелочным металлам. Обычно он рассматривается в качестве аналога этих металлов. Соответственно он возглавляет I группу системы Менделеева. В гидридах металлов ион водорода проявляет отрицательный заряд (степень окисления при этом -1), то есть Na+H- имеет структуру, подобную хлориду Na+Cl-. В соответствии с этим и некоторыми другими фактами (близость физических свойств элемента «H» и галогенов, способность его замещения галогенами в органических соединениях) Hydrogene относят к VII группе системы Менделеева.
В обычных условиях молекулярный водород имеет низкую активность, непосредственно соединяясь только с самыми активными из неметаллов (с фтором и хлором, с последним — на свету). В свою очередь, при нагревании он взаимодействует со многими химическими элементами.
Атомарный водород имеет повышенную химическую активность (если сравнивать с молекулярным). С кислородом он образует воду по формуле:
Н₂ + ½О₂ = Н₂О,
выделяя 285,937 кДж/моль тепла или 68,3174 ккал/моль (25 °С, 1 атм). В обычных температурных условиях реакция протекает довольно медленно, а при t° >= 550 °С — неконтролируемо. Пределы взрывоопасности смеси водород + кислород по объему составляют 4–94 % Н₂, а смеси водород + воздух — 4–74 % Н₂ (смесь из двух объемов Н₂ и одного объема О₂ называют гремучим газом).
Данный элемент используют для восстановления большинства металлов, так как он отнимает кислород у оксидов:
Fe₃O₄ + 4H₂ = 3Fe + 4Н₂О,
CuO + H₂ = Cu + H₂O и т. д.
С разными галогенами водород образует галогеноводороды, к примеру:
Н₂ + Cl₂ = 2НСl.
Однако при реакции с фтором водород взрывается (это происходит и в темноте, при -252 °С), с бромом и хлором реагирует только при нагревании или освещении, а с йодом — исключительно при нагревании. При взаимодействии с азотом образуется аммиак, но лишь на катализаторе, при повышенных давлениях и температуре:
ЗН₂ + N₂ = 2NН₃.
При нагревании водород активно реагирует с серой:
Н₂ + S = H₂S (сероводород),
и значительно труднее — с теллуром или селеном. С чистым углеродом водород реагирует без катализатора, но при высоких температурах:
2Н₂ + С (аморфный) = СН₄ (метан).
Данное вещество непосредственно реагирует с некоторыми из металлов (щелочными, щелочноземельными и прочими), образуя гидриды, например:
Н₂ + 2Li = 2LiH.
Немаловажное практическое значение имеют взаимодействия водорода и оксида углерода (II). При этом в зависимости от давления, температуры и катализатора образуются разные органические соединения: НСНО, СН₃ОН и пр. Ненасыщенные углеводороды в процессе реакции переходят в насыщенные, к примеру:
СnН₂n + Н₂ = СnН₂n₊₂.
Водород и его соединения играют в химии исключительную роль. Он обусловливает кислотные свойства т. н. протонных кислот, склонен образовывать с разными элементами водородную связь, оказывающую значительное влияние на свойства многих неорганических и органических соединений.
Получение водорода
Основными видами сырья для промышленного производства этого элемента являются газы нефтепереработки, природные горючие и коксовые газы. Его также получают из воды посредством электролиза (в местах с доступной электроэнергией). Одним из важнейших методов производства материала из природного газа считается каталитическое взаимодействие углеводородов, в основном метана, с водяным паром (т. н. конверсия). Например:
СН₄ + H₂О = СО + ЗН₂.
Неполное окисление углеводородов кислородом:
СН₄ + ½О₂ = СО + 2Н₂.
Синтезированный оксид углерода (II) подвергается конверсии:
СО + Н₂О = СО₂ + Н₂.
Водород, производимый из природного газа, является самым дешевым.
Для электролиза воды применяется постоянный ток, который пропускается через раствор NaOH или КОН (кислоты не используют во избежание коррозии аппаратуры). В лабораторных условиях материал получают электролизом воды или в результате реакции между соляной кислотой и цинком. Однако чаще применяют готовый заводской материал в баллонах.
Из газов нефтепереработки и коксового газа данный элемент выделяют путем удаления всех остальных компонентов газовой смеси, так как они легче сжижаются при глубоком охлаждении.
Применение водорода

Промышленным образом этот материал стали получать еще в конце XVIII века. Тогда его использовали для наполнения воздушных шаров. На данный момент водород широко применяют в промышленности, главным образом — в химической, для производства аммиака.
Массовые потребители вещества — производители метилового и прочих спиртов, синтетического бензина и многих других продуктов. Их получают синтезом из оксида углерода (II) и водорода. Hydrogene используют для гидрогенизации тяжелого и твердого жидкого топлива, жиров и пр., для синтеза HCl, гидроочистки нефтепродуктов, а также в резке/сварке металлов. Важнейшими элементами для атомной энергетики являются его изотопы — тритий и дейтерий.
Биологическая роль водорода
Около 10 % массы живых организмов (в среднем) приходится на этот элемент. Он входит в состав воды и важнейших групп природных соединений, включая белки, нуклеиновые кислоты, липиды, углеводы. Для чего он служит?
Этот материал играет решающую роль: при поддержании пространственной структуры белков (четвертичной), в осуществлении принципа комплиментарности нуклеиновых кислот (т. е. в реализации и хранении генетической информации), вообще в «узнавании» на молекулярном уровне.
Ион водорода Н+ принимает участие в важных динамических реакциях/процессах в организме. В том числе: в биологическом окислении, которое обеспечивает живые клетки энергией, в реакциях биосинтеза, в фотосинтезе у растений, в бактериальном фотосинтезе и азотфиксации, в поддержании кислотно-щелочного баланса и гомеостаза, в мембранных процессах транспорта. Наряду с углеродом и кислородом он образует функциональную и структурную основы явлений жизни.
