В каких продуктах содержится таллий
Таллий является редко встречающимся металлом на Земле. Но случаи отравления им не так уж и редки. Отравление таллием протекает тяжело, зачастую приводит к летальному исходу. Сравнить по токсичности можно со свинцом и мышьяком, опасен, как и кристаллический фенол. Более токсичен, чем ртуть, находящаяся перед таллием в таблице Менделеева. Следует познакомиться поближе с этим опасным металлом.

Каковы же его свойства и характеристики?
У вещества порошковая консистенция, бело-серебристой расцветки. Применяется обширно, особенно находясь в составе противоядий от грызунов. Для проведения радиологического обследования сердца используются соли таллия, а также сульфат таллия, как и в роли катализатора для фейерверков и в изготовлении оптических линз.
Этот химический элемент располагается в третьей группе таблицы Менделеева и имеет голубой оттенок. Бывает он одно- и трёхвалентным, более токсичным ядом считается одновалентный элемент. В природе он присутствует мало и не концентрированно, потому добывают его при обработке и добыче солей тяжёлых металлов (например, из свинца). В жирной и водной среде соединения таллия практически не растворяются.
Существует таллий в следующих состояниях:
- раствора Клеричи,
- перекиси,
- окиси (гидроксид таллия, оксид таллия),
- галоидных солей (нитрат таллия, хлорид таллия, сульфат таллия, йодид и бромид).

Также этот элемент встречается в человеческом организме, роль его полноценно еще не изучена. Ученые предполагают, что в организм он попадает вместе с растительной пищей. Содержится он также в:
- копоти,
- бытовой пыли,
- сигаретном дыме,
- промышленных испарениях.
Оксид таллия, как и прочие его соединения, распределяется по организму равномерно. Меньше всего его в кишечнике, волосяном покрове и зубах, в большом объеме отмечается в жировых тканях, чуть больше в мышцах и жирах. Гидроксид таллия или в другой форме в организме должен быть в пределах 0,1 мг, норма повышается до 0,5 мг при большой мышечной массе.
Какова токсикогенетика этого вида отравления?
Острое отравление таллием может произойти из-за намеренного и случайного попадания в организм больших порций солей металла. Парами и пылью металлов можно получить повреждения дыхательной системы, поражение происходит и при контактах с кожным покровом.
Вещество в организм всасывается различными способами: через кожный покров, дыхательные пути и пищеварительный тракт. Чтобы яд полностью впитался, достаточно одного часа. Гидроксид таллия или любое другое соединение представляет серьезную опасность.

Ядам легко впитываться в кровь, и большая часть оседает в сердечных мышцах, почках, слюнных железах и печени. Сравнительно малой являются отложения в мозге и жировых тканях. Выводится элемент в основном через желудок. Около месяца составляет срок полувыведения яда.
Как же происходит интоксикация?
Отравление солями таллия опасно тем, что он способен не только нарушать структуру клеток, но также и накапливаться в ней. Он способен изменять свойства молекул, так как способен взаимодействовать с различными энедогенными лигандами. Также он может образовывать связи с низкомолекулярными соединениями. Накапливаясь в клетках кожи, вещество поражает их.
Оксид таллия, находясь в организме, выбирает мишенью транспортные системы биомембран, работу ферментов, а также структурные белки. Повреждения происходит также и лизосом, эндоплазматического ретикулума. Механизмы работы биологически активных веществ нарушаются.
Каковы же симптомы?
Отравление таллием происходит при употреблении веществ с содержащимся таллием в количестве более 1 грамма. Летальный исход наступает при приёме дозы в 600 мг. Есть разница во временных рамках проявления симптоматики отравлений, как хронических, так и острых, но можно отследить и общие схожие проявления.

В течение первых 3-4 часов могут проявиться первые симптомы:
- кровотечения в кишечнике,
- общая слабость,
- рвота,
- ощущения тошноты.
В течение следующих 7 суток поражается нервная система, проявляется это в следующих симптомах:
- ухудшение зрения,
- повреждения черепных нервов,
- проблемы с координацией движений,
- боли в мышечной ткани,
- онемение конечностей,
- полиневрит,
- судороги,
- головные боли,
- слабость,
- психические нарушения.
Гидроксид таллия и прочие соли также со временем вызывают нарушения в работе всех систем организма.
- Почки снижение мочеиспускания, увеличение уровня мочевины в кровеносной системе, понижается и клубочковая фильтрация.
- Зрение — происходит атрофия сетчатки.
- Кожа — белесые пятна на ногтевой пластине, раздражения кожного покрова, облысение.
- Сосудистая система и сердце увеличение АД, тахикардия, болевые ощущения в сердце.
- Дыхательная система — паралич мышц органов дыхания, отек лёгких, раздражительность в горле.

Если получить смертельную дозу вещества, то времени до летального исхода остается немного. Проявляются симптомы либо в одно время, либо через небольшой промежуток друг за другом. Кровотечения в кишечнике, диарея, тошнота и рвота, повышенная температура могут дополняться психозом, отёком легких и даже комой. В период 7-10 суток наступает смерть, поэтому следует сразу же после отравления получить медицинскую помощь.
Если отравление в хронической стадии, то симптоматика весьма расплывчата, проявиться может на последних стадиях. В основном присутствуют нарушения функционирования желудочно-кишечного тракта. Такое состояние характеризуется следующей симптоматикой:
- ухудшение зрения,
- слабость в мышцах,
- алопеция,
- импотенция.
Как диагностировать?
Чтобы получить информацию о наличии таллия в организме, нет смысла использовать рентген, так как он в данном случае незаметен, используется для диагностирования рентгенограмма. При попадании в организм этого вещества в значительных дозах, его концентрация варьируется в пределах 300-2000 мкг/л, а экскреция за сутки превосходит 10-20 мкг. Оксид таллия в организме также можно заметить при помощи электроэнцефалограммы, заметные небольшие изменения, также в периферических нервах замедляется нервная проводимость.
Варианты лечения

Существует несколько лечебных процедур, использующихся для выведения из организма таллия: употребление диэтилдитиокарбамата (противоядия), усиление экскреции почек при помощи хлорида калия, гемодиализ, а также очищение желудка. Употребление сиропа ипекакуаны и промывание пищеварительной системы необходимо делать в первые 5 часов. Насколько вывелся яд может показать анализ, полученный при помощи рентгенограммы области живота.
В желудке и кишечнике таллий впитывать помогает прусский голубой, который в кристаллической решетке заменяет таллий калием, благодаря чему он не всасывается в кровь. Употребить нужно 250 мг/кг однократно. Для очищения желудка применяют цитрат магния или маннитол (в качестве слабительных препаратов).
Последствия отравления и профилактические меры
Для работающих на производствах в контакте с таллием , необходимо соблюдать определенные защитные меры:
- полноценно и правильно питаться,
- систематически осуществлять плановые осмотры в больнице,
- на рабочих местах не допускать принятия пищи и напитков,
- обязательно использовать защитные средства (специализированную обувь и одежду, перчатки, респираторы).
Оксид таллия в организме сверх нормы может привести к тяжелым последствиям, а также нарушить нормальное функционирование организма. Необходимо избегать прямых контактов с веществами, которые содержат в своем составе гидроксид таллия или другие его производные.
Интоксикация имеет не разовые последствия, а более серьезные, ведь таллий очень токсичен. Развиться может бесплодие, число врожденных пороков, импотенция, гормональные нарушения и нарушения психики, хроническими заболеваниями дыхательной системы и желудочно-кишечного тракта. Летальный исход возможен от инфаркта или же инсульта.
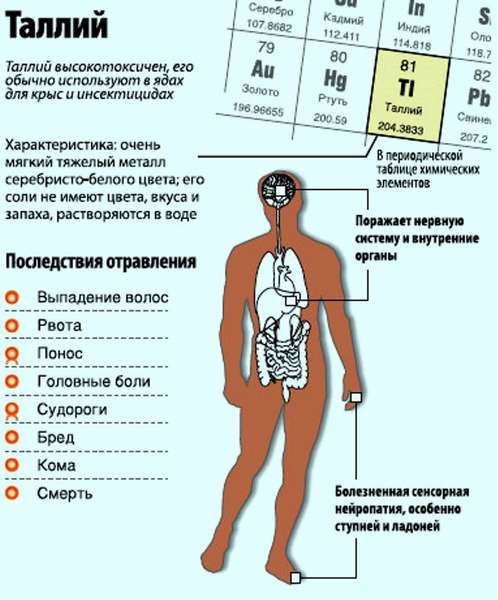
Если подвести итоги, то отравление таллием, как высокотоксичным элементом, очень опасно. Отравиться можно не только в производственных условиях, но и в бытовых. Все системы в организме разрушаются под его воздействием, особенно страдает нервная и мышечная системы.
Лечение необходимо начинать сразу же. В первую очередь необходимо ввести прусскую синь, эффективный антидот. Также следует всегда осуществлять профилактические меры и осторожность, особенно на производстве.
Видео
Насколько тяжелым может быть отравление таллием? Ответ на этот вопрос вы найдете, посмотрев видеосюжет.
Загрузка…
| Таллий | ||||
|---|---|---|---|---|
| ← Ртуть | Свинец → | ||||
| ||||
| Мягкий серебристо-белый металл с голубоватым оттенком | ||||
Таллий в ампуле | ||||
| Название, символ, номер | Та́ллий / Thallium (Tl), 81 | |||
| Атомная масса (молярная масса) | [204,382; 204,385][комм 1][1] а. е. м. (г/моль) | |||
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 6p1 | |||
| Радиус атома | 171 пм | |||
| Ковалентный радиус | 148 пм | |||
| Радиус иона | (+3e) 95 (+1e) 147 пм | |||
| Электроотрицательность | 1,62 (шкала Полинга) | |||
| Электродный потенциал | Tl←Tl+ −0,338 В Tl←Tl3+ 0,71 В | |||
| Степени окисления | 3, 1 | |||
| Энергия ионизации (первый электрон) | 588,9 (6,10) кДж/моль (эВ) | |||
| Плотность (при н. у.) | 11,849 [2] г/см³ | |||
| Температура плавления | 577 K (304 °C, 579 °F)[2] | |||
| Температура кипения | 1746 K (1473 °C, 2683 °F)[2] | |||
| Уд. теплота плавления | 4,31 кДж/моль | |||
| Уд. теплота испарения | 162,4 кДж/моль | |||
| Молярная теплоёмкость | 26,3 [3] Дж/(K·моль) | |||
| Молярный объём | 17,2 см³/моль | |||
| Структура решётки | гексагональная | |||
| Параметры решётки | a=3,456 c=5,525[4] | |||
| Отношение c/a | 1,599 | |||
| Температура Дебая | 96,00 K | |||
| Теплопроводность | (300 K) 38,9[3] Вт/(м·К) | |||
| Номер CAS | 7440-28-0 | |||
Та́ллий — элемент 13-й группы периодической таблицы химических элементов (по устаревшей классификации — элемент главной подгруппы III группы), шестого периода, атомный номер 81. Обозначается символом Tl (лат. Thallium). Относится к группе тяжёлых металлов. Простое вещество таллий — мягкий, чрезвычайно токсичный металл серебристо-белого цвета с серовато-голубоватым оттенком.
История[править | править код]
Таллий был открыт спектральным методом в 1861 году английским учёным Уильямом Круксом в шламах свинцовых камер сернокислотного завода вблизи города Аббероде, расположенным в горном массиве Гарц.
Металлический таллий был независимо получен Уильямом Круксом и французским химиком Клодом-Огюстом Лами в 1862 году[5].
Происхождение названия[править | править код]
Название элемент получил по характерным зелёным линиям своего спектра и зелёной окраске пламени. От др.-греч. θαλλός — молодая, зелёная ветвь[6].
Нахождение в природе[править | править код]
Таллий — рассеянный элемент. Содержится в обманках и колчеданах цинка, меди и железа, в калийных солях и слюдах. Таллий — тяжёлый металл. Известно лишь семь минералов таллия (круксит (Cu, Tl, Ag)2Se, лорандит TlAsS2, врбаит Tl4Hg3Sb2As8S20, гутчинсонит (Pb, Tl)S • Ag2S • 5As2S5, авиценнит Tl2O3), все они крайне редкие. Главная масса таллия связана с сульфидами и прежде всего с дисульфидами железа. В пирите он установлен в 25 % проанализированных образцов. Его содержание в дисульфидах железа нередко составляет 0,1—0,2 %, а иногда достигает 0,5 %. В галените содержание таллия колеблется от 0,003 до 0,1 % и редко более. Высокие концентрации таллия в дисульфидах и галенитах характерны для низкотемпературных свинцово-цинковых месторождений в известняках. Содержание таллия, достигающее 0,5 %, отмечается в некоторых сульфосолях. Небольшое количество таллия встречается во многих других сульфидах, например, в сфалеритах и халькопиритах некоторых медноколчеданных месторождений, содержание колеблется от 25 до 50 г/т. Наибольшее геохимическое сходство таллий имеет с K, Rb, Cs, а также с Pb, Ag, Cu, Bi. Таллий легко мигрирует в биосфере. Из природных вод он сорбируется углями, глинами, гидроксидами марганца, накапливается при испарении воды (например, в озере Сиваш до 5⋅10−8 г/л). Содержится в калиевых минералах (слюде, полевых шпатах), сульфидных рудах: галените, сфалерите, марказите (до 0,5 %), киновари. Как примесь присутствует в природных оксидах марганца и железа[7].
Среднее содержание таллия (по массе):
- в земной коре 4,5⋅10−5 %;
- в ультраосновных породах 10−6 %;
- в основных породах 2⋅10−5 %;
- в морской воде 10−9 %.
Изотопы[править | править код]
Природный таллий состоит из двух стабильных изотопов: 205Tl (изотопная распространённость 70,48 % по числу атомов) и 203Tl (29,52 %). В ничтожных количествах в природе встречаются также радиоактивные изотопы таллия, являющиеся промежуточными членами рядов распада:
- 206Tl (Т1/2 = 4,19 мин.) и 210Tl (1,30 мин.) — ряд урана-238;
- 207Tl (4,78 мин.) — ряд урана-235;
- 208Tl (3,1 мин.) — ряд тория-232.
Все остальные известные изотопы таллия с массовыми числами от 176 до 217 получены искусственно.
Получение[править | править код]
Технически чистый таллий очищают от других элементов, содержащихся в колошниковой пыли (Ni, Zn, Cd, In, Ge, Pb, As, Se, Te), растворением в тёплой разбавленной серной кислоте с последующим осаждением нерастворимого сульфата свинца и добавлением HCl для осаждения хлорида таллия (TlCl). Дальнейшая очистка достигается электролизом сульфата таллия в разбавленной серной кислоте с использованием проволоки из платины с последующим плавлением выделившегося таллия в атмосфере водорода при 350—400 °C.
Свойства[править | править код]
Таллий — блестящий серебристый мягкий металл с голубоватым оттенком. На воздухе быстро тускнеет, покрываясь чёрной плёнкой оксида таллия Tl2O[3]. В воде в присутствии кислорода растворяется с образованием TlOH, в отсутствие кислорода не реагирует, поэтому таллий хранят под слоем прокипячённой дистиллированной воды (или парафина, а также покрывают лаком)[3].
Физические свойства[править | править код]
Существует в трёх модификациях. Низкотемпературная модификация Tl II является кристаллом гексагональной сингонии, пространственная группа P63/mmc, параметры ячейки a = 0,34566 нм, c = 0,55248 нм, Z = 2, решётка типа магния. Выше 234 °C существует высокотемпературная модификация Tl I кубической сингонии (объёмно-центрированная решётка), пространственная группа Im3m, параметры ячейки a = 0,3882 нм, Z = 2, решётка типа α-Fe; энтальпия перехода между модификациями I и II составляет 0,36 кДж/моль. При 3,67 ГПа и 25 °C — модификация Tl III кубической сингонии (гранецентрированная решётка), пространственная группа Fm3m, параметры ячейки a = 0,4778 нм, Z = 4. Температура плавления составляет 577 K (304 °C), кипит при 1746 K (1473 °C)[2]. Таллий относится к группе тяжёлых металлов; его плотность — 11,855 г/см3[2].
Сечение захвата тепловых нейтронов атомом — 3,4 ± 0,5 барн. Конфигурация внешних электронов — 6s26p. Энергии ионизации (в эВ): Tl0→Tl+→Tl2+→Tl3+→Tl4+ соответственно равны 6,1080; 20,4284; 29,8; 50,0[3].
Таллий диамагнитен, массовая магнитная восприимчивость поликристаллического гексагонального таллия равна χ = −0,249·10−9 м3/кг при нормальных условиях, −0,258·10−9 м3/кг при T = 14,2 К. У кубического поликристаллического таллия при T > 235 К массовая магнитная восприимчивость составляет −0,158·10−9 м3/кг. Монокристаллический гексагональный таллий проявляет анизотропию, χ|| = −0,420·10−9 м3/кг, χ⊥ = −0,164·10−9 м3/кг. У жидкого таллия χ = −0,131·10−9 м3/кг при температуре плавления[8].
При температуре 2,39 K таллий переходит в сверхпроводящее состояние.
Спектр таллия в видимом диапазоне имеет яркую линию с длиной волны 525,046 нм (зелёный), благодаря которой этот элемент и получил своё название.
Твёрдость по Моосу 1,3, по Бриннелю 20 МПа[3].
Химические свойства[править | править код]
Реагирует с неметаллами: с галогенами и кислородом при комнатной температуре, с серой, селеном, теллуром, фосфором — при нагревании. С мышьяком сплавляется без образования соединения. С водородом, азотом, углеродом, кремнием, бором, а также с аммиаком и сухим углекислым газом не реагирует.
Легко растворяется в азотной кислоте, хуже — в серной. Соляная кислота на таллий действует слабо из-за пассивации плёнкой монохлорида таллия.
Не реагирует со щелочами, с этанолом в присутствии растворённого кислорода образует этилат таллия.
В соединениях проявляет степени окисления +1 и +3. Наиболее устойчивы соли Tl(I), которые напоминают соли калия, серебра и свинца. Под действием бромной воды, перманганата калия, бромата калия, дисульфата калия Tl(I) окисляется до Tl(III), соли которого термически малоустойчивы, легко гидролизуются и восстанавливаются. В растворах Tl(III) восстанавливается до Tl(I) под действием диоксида серы, сероводорода, тиосульфата натрия и ряда металлов, включая цинк, железо и медь. Известны соединения, в которых таллий присутствует сразу в двух степенях окисления, например гексахлороталлат(III) таллия(I) Tl3[TlCl6].
Применение[править | править код]
- Амальгама таллия имеет низкую температуру плавления (tпл = −61 °C; более легкоплавкой является только эвтектика в системе натрий-калий-цезий с tпл = −78 °C) — она находит применение для заполнения низкотемпературных термометров и в качестве теплоносителя.
- Нуклид 201Tl используется в медицине для кардиологических исследований.
- Таллий вводится в качестве активатора в кристаллы иодида натрия, использующегося в качестве сцинтиллятора для регистрации ионизирующих излучений.
- В инфракрасной оптике в качестве материалов линз применяются бромид и иодид таллия(I). Кроме того, в годы Великой Отечественной войны оксисульфид таллия (таллофид) применялся в качестве чувствительного элемента приборов ночного видения[9].
- Иодид таллия(I) добавляют в осветительные металлогалогеновые лампы.
- Раствор Клеричи, состоящий из формиата таллия (HCOOTl) и малоната таллия (CH2(COOTl)2), используется в минералогии для определения свойств минералов.
- Сульфат таллия(I) и карбонат таллия(I) ранее применялись в качестве средства для борьбы с грызунами в труднодоступных местах.
- Трёхвалентный таллий является основным компонентом некоторых относительно сильных окислительных реагентов в органическом синтезе:
- Трифторацетат таллия(III) или трис(трифторацетат) таллия, TTFA (Tl(Otfac)3);[10]
- Тринитрат таллия, TTN (Tl(NO3)3);
- Триацетат таллия, TTA (Tl(CH3COO)3).
Биологическая роль и физиологическое воздействие[править | править код]
Таллий не играет значительной биологической роли (среди тяжёлых металлов).
Как сам таллий, так и его соединения высокотоксичны и канцерогенны в больших концентрациях (в особенности растворимые в воде — хлорид, нитрат, ацетат и т. д.). Соединения таллия относят к категории кумулятивных ядов — накапливающиеся патологические симптомы при хроническом отравлении[11].
В больших дозах соединения таллия поражают периферическую нервную систему, желудочно-кишечный тракт и почки.
Ионы одновалентного таллия Tl+ замещают ионы калия в биохимических процессах из-за сходства их химических свойств. Таллий концентрируется в волосах, костях, почках и мышцах.
Характерный симптом отравления соединениями таллия — частичное выпадение волос, при значительной дозе — тотальная алопеция. При высокой дозе — алопеция нехарактерна, так как человек погибает от отравления до наступления потери волос.
ПДК в воде для таллия 0,0001 мг/л, для бромида, иодида, карбоната (в пересчёте на таллий) в воздухе рабочей зоны (ПДКр.з.) составляет 0,01 мг/м3, в атмосферном воздухе 0,004 мг/м3. Класс опасности — I (чрезвычайно опасное химическое вещество).
Смертельная для взрослого человека доза таллия в соединениях составляет 600 мг.
При отравлении таллием или его соединениями в качестве антидота используется берлинская лазурь.
Первая помощь при отравлении таллием — промывание желудка раствором 0,3 % тиосульфата натрия (Na2S2O3) с взболтанным порошком активированного угля.
Криминальные отравления соединениями таллия описаны в ряде остросюжетных произведений детективной литературы[12][13] и кинофильмов[14].
Известные случаи отравления таллием[править | править код]
- 1950-е гг. — «таллиевое» безумие в Австралии.
- 1987 г. — дело Тамары Иванютиной.
- 2017—2018 г. — массовое отравление в Таганроге на Таганрогском авиационном научно-техническом комплексе имени Г. Бериева[15][16].
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02.
- ↑ 1 2 3 4 5 Thallium: physical properties (англ.). WebElements. Дата обращения 20 августа 2013.
- ↑ 1 2 3 4 5 6 Фёдоров П. И. Таллий // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные—Трипсин. — С. 490—492. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- ↑ Thallium: crystal structure (англ.). WebElements. Дата обращения 20 августа 2013.
- ↑ * Crookes, William (March 30, 1861) «On the existence of a new element, probably of the sulphur group, » Chemical News, vol. 3, pp. 193—194; reprinted in: Crookes, William. XLVI. On the existence of a new element, probably of the sulphur group (англ.) // Philosophical Magazine : journal. — 1861. — April (vol. 21, no. 140). — P. 301—305. — doi:10.1080/14786446108643058.;
- Crookes, William (May 18, 1861) «Further remarks on the supposed new metalloid, » Chemical News, vol. 3, p. 303.
- Crookes, William (June 19, 1862) «Preliminary researches on thallium, » Proceedings of the Royal Society of London, vol. 12, pages 150—159.
- Lamy, A. (May 16, 1862) «De l’existencè d’un nouveau métal, le thallium, » Comptes Rendus, vol. 54, pages 1255—1262.
- ↑ Weeks, Mary Elvira (англ.)русск.. The discovery of the elements. XIII. Supplementary note on the discovery of thallium (англ.) // Journal of Chemical Education (англ.)русск. : journal. — 1932. — Vol. 9, no. 12. — P. 2078. — doi:10.1021/ed009p2078. — Bibcode: 1932JChEd…9.2078W.
- ↑ Вольфсон Ф. И., Дружинин А. В. Главнейшие типы рудных месторождений, — Москва: Недра, 1975, 392 с.
- ↑ Физические величины : Справочник / Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.: Энергоатомиздат, 1991. — С. 602. — 1232 с. — 50 000 экз. — ISBN 5-283-04013-5.
- ↑ Таллий // encyclopaedia.biga.ru
- ↑ Sullivan, P. D. Menger, E. M. Reddoch, A. H. Paskovich, D. H. Oxidation of anthracene by thallium(III) trifluoroacetate. Electron spin resonance and structure of the product cation radicals (англ.) // Journal of Physical Chemistry. — 1978. — Vol. 82, no. 10. — P. 1158—1160. — doi:10.1021/j100499a015.
- ↑ Тарасенко Н.В., Рубцов В.Ф., Малинин А.В., Седов В.В. Таллий // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1985. — Т. 24. Сосудистый шов — Тениоз. — 544 с. — 150 800 экз.
- ↑ Dr John Emsley[en]. The trouble with thallium (англ.) // New Scientist. — 1978. — 10 August. — P. 394.
- ↑ Вилла «Белый Конь»
- ↑ Криминал.RU. Криминальная Россия. Неуловимый привкус смерти (11 декабря 2016). Дата обращения 18 февраля 2018.
- ↑ Королев, Никита На таганрогское авиационное предприятие завезли таллий. Коммерсант (1 марта 2018). Архивировано 1 марта 2018 года.
- ↑ Комментарий ПАО «ТАНТК им. Г.М. Бериева» по поводу отравившихся сотрудников.. ТАНТК им. Г. Бериева (2 марта 2018). Архивировано 6 марта 2018 года.
Комментарии
- ↑ Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе.
Ссылки[править | править код]
- Таллий. Популярная библиотека химических элементов. Дата обращения 20 августа 2013.
- Таллий (20 ноября 2006). — News.ru. Дата обращения 20 августа 2013.
