В каких продуктах содержится миозин

Сыры — продукт хорошего настроения
Эндокринолог среди прочих аминокислот выписала для похудения L-тирозин. Иду в магазин спортивного питания за заветной баночкой.
– Есть? — спрашиваю.
— Нет, — отвечают.
Иду в другой магазин. Ответ тот же. В третий — и снова неудача. Да что происходит?
— У вас есть L-тирозин? — уже со слабой надеждой в голосе спрашиваю в четвертом магазине.
Продавщица подскочила с места, пошла к витрине. Примерно на полпути остановилась и, сделав печальное лицо, ответила:
— Ой, нет, закончился. Он же для сжигания жира очень хорош…
Ясно — активно худеющие женщины раскусили пользу приема аминокислот при похудении. Сегодня стало модно худеть грамотно, а не просто полагаясь на какую-нибудь убивающую метаболизм диету. В том же магазине, кстати, другой продавец меня сразу спросил: «А все вот эти аминокислоты, которые вы спрашиваете, вам эндокринолог прописал? Сегодня многие после приема у доктора к нам приходят».
Но предупреждаю всех, кто будет так же, как и я, искать аминокислоту через торговые точки, а не в интернете: не все продавцы спортивного питания знают товар, которым торгуют.
В одном из специализированных отделов задаю все тот же вопрос про L-тирозин. Девушка делает лицо все знающего человека и презирающего незнаек, типа меня, и с некоторым вызовом спрашивает: «Может, вы имели в виду L-карнитин?» Да нет, что сказала, то и имела в виду. А раз для вас — это новое сочетание слов, то и покупать у вас ничего не буду, даже если найду то, что мне надо, на полках. Развернулась и ушла.
В общем, L-тирозин я все еще не купила. Зато начала изучать продукты с высоким содержанием этой аминокислоты. Но сначала буквально в нескольких предложениях о чудо-свойствах тирозина.
Чем полезен L-тирозин?
Тирозин считается условно заменимой аминокислотой, поскольку она вырабатывается в организме из фенилаланина, поступающего с продуктами питания. Тирозин входит в состав протеинов и всех белковых соединений организма. Является предшественником дофамина — гормона мотивации и радости, адреналина и норадреналина, а также гормонов щитовидной железы; гормона роста, отвечающего в том числе и за жиросжигание; меланина, отвечающего за красивый загар.
Одно из зарубежных исследований показало, что люди, принимавшие тирозин в виде добавки, лучше запоминали информацию, быстрее реагировали на ситуацию, принимали нестандартные решения в той или иной ситуации.
Тирозин улучшает настроение
7 полезных свойств тирозина:
· снижает волнение, уровень депрессии, улучшает настроение;
· снимает зависимости — помогает снизить тягу к алкоголю, курению, еде, к кофеину;
· оптимизирует метаболизм, регулирует обмен веществ;
· улучшает работу щитовидной железы;
· улучшает концентрацию внимания и память;
· повышает выносливость при больших физических нагрузках;
· помогает бороться с аллергическими реакциями.
При похудении L-тирозин эффективен только в комплексе с другими аминокислотами и при достаточной физической нагрузке — хотя бы ежедневной ходьбе.
Симптомы, говорящие о дефиците тирозина в организме:
– вялость, усталость, хроническое нежелание что-либо делать;
– пониженное давление и температура тела;
– депрессия;
– увеличение веса без видимых на то причин.
Если у вас есть эти симптомы, обратитесь к эндокринологу. Он назначит соответствующие анализы и, возможно, прием аминокислоты в виде добавки к пище.
В каких продуктах содержится тирозин?
Больше всего тирозина содержится в белковых продуктах. Ниже привожу список продуктов, в 100 граммах которых тирозина больше 20% от суточной нормы (при норме 4,4 г):
Соевый протеин (изолят) (порошок) 3,2 г
Белок куриного яйца в виде порошка 3,2 г
Сыр пармезан 2 г
Сыр швейцарский 1,7 г
Сыры Тильзитер, Эдам, Гауда 1,5 г
Икра красная или черная 1,4 г
Сыры с плесенью 1,3 г
Свинина, куриная грудка 1,2 г
Говяжья печень, говядина, сыр Моцарелла, семена тыквы 1,1 г
Крольчатина, курица, куриная печень, телятина, арахис 1 г
Помните, что прием L-тирозина в виде добавки должен назначить врач, поскольку есть противопоказания, а также, возможно, вам нужна совсем другая аминокислота для успешного похудения. Тем более что пилюли стоят недешево.
А вот есть белковые продукты, богатые тирозином, могут практически все. Тем более что сыры, икра и мясо — ну, что может быть вкуснее! Разве что тортик????
Подписывайтесь на канал «Вечерний чай». Худею сама и в процессе изучаю полезную информацию о функционировании организма человека. Делюсь тем, что кажется наиболее интересным для успешного похудения.
Заглядывайте на мой сайт, там не только о похудении, но и житейские истории, рецепты…
Часть структуры миозина II. Атомы тяжелой цепи окрашены в красный (слева), атомы легкой цепи окрашены в желтый и оранжевый.
Миозин — фибриллярный белок, один из главных компонентов сократительных волокон мышц — миофибрилл. Составляет 40—60 % общего количества мышечных белков. При соединении миозина с другим белком миофибрилл (актином) образуется актомиозин — основной структурный элемент сократительной системы мышц. Другое важное свойство миозина — способность расщеплять аденозинтрифосфорную кислоту (АТФ)[1]. Благодаря АТФ-азной активности миозина, химическая энергия макроэргических связей АТФ превращается в механическую энергию мышечного сокращения. Молекулярная масса миозина около 500 000. При действии протеолитических ферментов миозин распадается на фрагменты — тяжёлый меромиозин и лёгкий меромиозин (молекулярная масса около 350 000 и около 150 000). С помощью меченного тяжёлого меромиозиона при цитологических исследованиях выявляется местоположение актиновых микрофиламентов в клетке.
Структура[править | править код]
Миозины — семейство белков, являющихся моторами цитоскелета системы микрофиламентов. Миозины состоят из тяжёлых цепей (H) и лёгких (L) в разном количестве в зависимости от типа миозина. H-цепь имеет 2 участка — «головку» и «хвостик». Головка тяжёлой цепи миозина имеет сайт связывания с актином и сайт связывания АТФ. По количеству «головок» миозины делятся на «традиционные» (англ. conventional myosin) — 2 головки и нетрадиционные (англ. unconventional myosin) — 1 головка. Традиционные миозины могут связываться между собой в протофибриллы, а нетрадиционные — не могут.
На электронных микрофотографиях молекулы миозина имеют вид палочек (1600´25) с двумя глобулярными образованиями на одном из концов. Полагают, что 2 полипептидные цепи, образующие миозин, скручены в спираль. Белки, аналогичные миозину, обнаружены в жгутиках, ресничках и других двигательных структурах у многих простейших и бактерий, сперматозоидов животных и некоторых растений.
Виды миозина[править | править код]
Мышечный миозин[править | править код]
Мышечный миозин (т. н. миозин II) — традиционного типа. Обнаруживается в поперечно-полосатой мускулатуре позвоночных и беспозвоночных животных, в гладкомышечных клетках беспозвоночных. Мышечный миозин всегда состоит из двух H-цепей по 200 кДа каждая, образующих две «головки» молекулы и скрученный из двух хвостиков тяжёлой цепи хвост. Две лёгкие L-цепи по 18 кДа ассоциированы с тяжёлыми цепями в районе перехода от головки к хвосту. Связываясь с микрофиламентами головками попеременно, миозины как бы «шагают» по нему за счёт гидролиза макроэргической связи молекулы АТФ. При этом к хвосту молекулы может быть присоединена соседняя микрофибрилла, и тогда происходит мышечное сокращение.
Немышечный миозин[править | править код]
Немышечные миозины встречаются в разных клетках, в том числе в гладко-мышечных клетках позвоночных. Немышечные миозины могут быть 2-головые и 1-головые, то есть традиционные и нетрадиционные. Нетрадиционные миозины найдены во всех клетках. Они не могут образовывать протофиламенты. Одноголовый миозин тащит груз от (−) конца микрофиламента к (+)-концу. Миозин I — в фоторецепторах, миозин VII — в органах слуха.
Примечания[править | править код]
- ↑ В. А. Энгельгардт и М. Н. Любимова, 1939
См. также[править | править код]
- Моторные белки
Ссылки[править | править код]
- Section 18.3Myosin: The Actin Motor Protein / Alberts B, Johnson A, Lewis J, et al. Molecular Biology of the Cell. 4th edition. — New York: Garland Science; 2002 (англ.)
В человеческом организме аминокислоты являются своеобразными строительными материалами для ногтей, волос (альфа-кератины), соединительных тканей, мышц, кожи и т.д. и т.п. Но при этом собственных «хранилищ» полезных аминокислот и протеинов (составляющих молекулы белка) в организме человека нет. Поэтому, то, что пища с высоким содержанием белка для нашего организма очень полезна – это очевидно.

Кроме всего, абсолютно все процессы, происходящие в нашем организме, не обходятся без участия в них белков. К примеру, за перенос ко всем клеткам организма кислорода отвечает белок – гемоглобин, белки миозином и актином обеспечивают мышечную работу, порообразующие белки регулируют правильность передачи информации от головного мозга ко всем внутренним органам. Также белки – это неотъемлимая часть нашей иммунной системы – в ней они играют роль антител, защищающих организм человека от вирусов и вредоносных бактерий.
Параметры определения содержания белка в пище:
Основными параметрами при выборе продуктов с большим количеством полезных белков является их содержание на единицу калорий и коэффициент, опять же, их усвоения организмом. Поэтому при выборе продуктов обращайте внимание на низкое содержание в них жиров и высокое – белков. Традиционно к таким продуктам питания относят те, у которых на 100 г массы содержится более 10 г протеинов, и практически отсутствуют углеводы. Суточная норма белков, входящих в дневной рацион здорового взрослого человека не должна быть ниже 100-120 грамм.
Основные продукты с высоким содержанием белка:
Продукты, содержащие достаточно большое количество полезных белков (протеинов) могут быть разного происхождения – животного и растительного. Рассмотрим самые основные:
1. Молочные продукты содержат около 30% белка. К таким продуктам можно отнести сыры разных сортов (сливочный, чеддер, мюнстер, моцарелла, пармезан и итальянский «Рикотта»). Также большое количество белка содержится в сырном соусе, обезжиренном твороге и нежирном молоке. Творог рекомендовано употреблять с добавлением йогурта или кефира и небольшого количества сахара, которые ускоряют усвоение белка организмом.

2. Яйца (белок) относятся к низкокалорийным продуктам, употребляя которые вы получаете отличный строительный материал для своих мышц. Съедая два яйца (приблизительно 100 г), вы пополняете свой организм 17-ю граммами белка.

3. Печень – недорогой, но довольно таки богатый белком (25%) и питательный продукт. В пищу рекомендовано употреблять в тушеном и вареном виде, а также в качестве разнообразных паштетов.

4. Рыба и морепродукты содержат около 25% белка. В список этих продуктов входят: вареный тихоокеанский и атлантический морской окунь, палтус, запеченное в духовке филе трески, анчоусы, скумбрия, пикша, тунец, лосось, семга, кефаль, сардины, сайда и вареные креветки смешанных видов.

5. Говядина в своем составе содержит не менее 25% отличного животного белка. Рекомендовано употреблять в пищу вареную, тушеную или приготовленную на пару говядину не старше двухлетнего возраста, тогда этот продукт будет не только оптимально богат белками, но еще и отличаться замечательными вкусовыми характеристиками.

6. Мясо птицы содержит от 15% до 20% белка, который очень хорошо усваивается организмом и при этом содержит минимум калорий. К таким продуктам можно отнести куриную грудку и крылышки (бульоны на их основе), а также белое мясо индейки, но без кожи.

7. Бобовые. Соя, пожалуй, самый богатый белками (14%) продукт растительного происхождения. На сегодняшний день из нее изготавливают огромное количество всевозможных кулинарных блюд, являющихся заменителями мясных продуктов. Богаты белками и соевый творог «Тофу», зрелые бобы фасоли (вареные или запеченные без соли), черные бобы, лимская фасоль, нут (турецкий горох) и некоторые другие. Приготовленные бобы чечевицы (1 чашка) содержат 28 г отличного растительного белка и огромное количество витаминов группы В.

8. Крупы и зерновые. Эти продукты содержат около 12% белка, легко усваиваются и способствуют нормальному пищеварению. Самое большое содержание белков в зерновых и крупах находится в овсе (хлопья, каша), рисе (коричневом и белом с длинным волокном), гречневой непросеянной муке, желтой кукурузе и обогащенной кукурузной муке. Кроме этого белком очень богата кинва, поэтому ее и называют «абсолютно белковой». В 100 граммах этой зерновой культуры содержится около 16,5 г белка, причем высокого качества, идеально сочетающегося со многими натуральными аминокислотами.

9. Семечки. Одна четверть стакана подсолнуховых семян содержит 21 грамм белка, а семена тыквы в том же количестве – 19 грамм. Семечки рекомендуют добавлять к кашам и салатам.

10. Миндальное масло (1/4 стакана), как и сам миндаль (приблизительно горсть) содержит чуть больше 8 грамм белка, приблизительно как арахис, но при этом не вызывает аллергии и не причиняет вреда. Маслом миндаля, как правило, заправляют салаты, а орешки добавляют в кашу за завтраком или используют как перекус.

11. Фрукты и овощи. Высокое содержание белка также содержится и в некоторых фруктах и овощах (не менее 9%). К таким можно отнести брюссельскую капусту, спаржу, сладкий картофель, тыкву, кокос, шпинат, папайю, а также сушеные сливы и абрикосы.

Усваивание белков организмом происходит намного лучше, если их подвергнуть тепловой обработке, после которой они становятся для ферментов желудка и кишечника более доступными. Также следует помнить, что пища, содержащая большое количество белков требует больше времени для усваивания ее организмом и для вывода из него продуктов белкового обмена. По этой причине, во избежание обезвоживания организма рекомендуется выпивать в сутки не менее 2,5 литров воды.
Эту статью находят по запросу: «Где много белка»
430 просмотров всего, 1 просмотров сегодня
Белковый состав мышечной ткани весьма сложен. Уже с давних пор он изучается многими учеными. Основоположник отечественной биохимии А. Я. Данилевский, исследуя белки мышечной ткани, дал правильное представление о физиологической роли ряда белков и о значении сократительного белка миозина, содержащегося в миофибриллах.
В дальнейшем миозин исследовали В. А. Энгельгардт, И. И. Иванов и другие советские ученые. Большой вклад в изучение мышечного сокращения внес венгерский ученый Сцент-Джордьи. Другой венгерский ученый Штрауб открыл белок мышц актин.
Изучение мышечной ткани следует начинать с белков, так как на их долю приходится около 80% сухого остатка мышечной ткани. В соответствии с морфологической структурой мышечного волокна белки распределяются следующим образом:
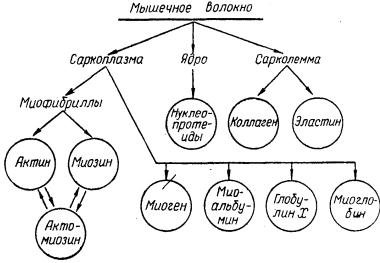
Из приведенной схемы видно, что белковый состав мышечной ткани очень разнообразен. В саркоплазме содержится четыре белка: миоген, миоальбумин, глобулин X и миоглобин. В миофибриллах содержится комплекс, состоящий из актина и миозина, называемый актомиозином. Все белки саркоплазмы называются внутриклеточными, а белки сарколеммы — внеклеточными, В ядрах содержатся нуклеопротеиды, в сарколемме — коллаген и эластин. Если учесть, что в мышечной ткани, кроме того, содержится еще значительное количество различных ферментов и каждый из них является особым белком, то белковый состав мышечной ткани оказывается еще более сложным.
Миозин
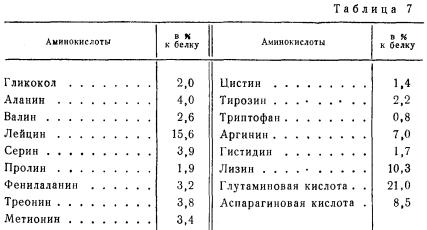
Основным белком мышечной ткани является миозин. Он составляет почти половину всех белков мышечной ткани, причем он встречается в мышцах всех млекопитающих, птиц и рыб. По пищевой ценности он является полноценным белком. В табл. 7 приведен аминокислотный состав миозина быка.
Миозин был детально изучен советскими биохимиками, обнаружившими, что он является не только структурным белком мышечной ткани, т. е. белком, участвующим в построении клетки, но и ферментом — аденозинтрифосфатазой, катализирующей реакцию гидролиза АТФ. При этом образуются АДФ (аденозинди-фосфорная кислота) и фосфорная кислота и выделяется большое количество энергии, используемой при мышечной работе.
Миозин получен в чистом кристаллическом виде. Молекулярный вес его очень большой, примерно 1,5 млн. Кристаллический миозин при полном отсутствии солей прекрасно растворим в воде. Ho достаточно добавить к воде ничтожное количество какой-либо соли, например хлористого натрия, как он полностью теряет способность растворяться и растворение наступает уже при концентрации хлористого натрия около 1%. Однако по отношению к солям, например к сернокислому аммонию, миозин ведет себя как типичный глобулин.
При извлечении белков мяса водой миозин не переходит в раствор. При обработке мяса солевыми растворами он обнаруживается в солевой вытяжке. При разведении водой солевого раствора миозина уменьшается концентрация соли и миозин начинает выпадать в осадок. Миозин высаливается при полном насыщении хлористым натрием и сернокислым магнием (высаливание производят кристаллической солью, иначе добиться полного насыщения невозможно).
Изоэлектрическая точка миозина находится при pH 5,4—5,5.
Миозин обладает свойством вступать в особые связи с различными веществами, в первую очередь с белками, с образованием комплексов. Особую роль в деятельности мышц играет комплекс миозина с актином — актомиозин.
Актин и актомиозин
Белок актин может существовать в двух формах: фибриллярной и глобулярной. В покоящейся мышце актин находится в фибриллярной форме; при мышечном сокращении он переходит в глобулярную. Большое значение в этом превращении имеют аденозинтрифосфорная кислота и соли.
В мышечной ткани содержится 12—15% актина. В раствор он переходит при длительном извлечении солевыми растворами; при кратковременном извлечении он остается в строме. Молекулярный вес актина около 75 000.
При смешивании растворов актина и миозина образуется комплекс, называемый актомиозином, из которого в основном построены миофибриллы. Этот комплекс отличается высокой вязкостью, способен резко сжиматься при определенных концентрациях ионов калия и магния (0,05 м KCl >и 0,001 м MgCl2) в присутствии аденозинтрифосфата. При более высоких концентрациях солей (0,6 м KCl) актомиозин при добавлении АТФ распадается на актин и миозин. Вязкость раствора при этом заметно снижается.
По представлениям Сцент-Джордьи сжатие актомиозина под действием АТФ лежит в основе сокращения живой мышцы.
Актомиозин, как подлинный глобулин, не растворим в воде. При обработке мяса солевыми растворами в раствор переходит актомиозин с неопределенным содержанием актина в зависимости от длительности извлечения.
Глобулин X
В мышечной ткани содержится около 20% глобулина X от всего количества белка. Он является типичным глобулином, т. е. не растворяется в воде, но растворяется в солевых растворах средней концентрации; осаждается из растворов при половине насыщения сернокислым аммонием (1 объем раствора белка и 1 объем насыщенного раствора сернокислого аммония), хлористым натрием при полном насыщении.
Mиоген
В мышечной ткани содержится около 20% миогена от всего количества белка. Его нельзя отнести к типичным альбуминам или глобулинам, так как он растворяется в воде, недостаточно высаливается хлористым натрием и сернокислым магнием при насыщении (кристаллической солью), в то же время осаждается сернокислым аммонием при 2/3 насыщения (1 объем белкового раствора и 2 объема насыщенного раствора сернокислого аммония). Этот белок был получен в кристаллическом виде. Молекулярный вес миогена 150 000.
В. А. Энгельгардт обнаружил у миогена способность катализировать одну из важнейших реакций, протекающих в процессе гликолиза мышечной ткани. Этим открытием впервые было показано, что ферментативной активностью могут обладать структурные белки, т. е. белки, участвующие в построении тканей.
Mиоальбумин
В мышечной ткани содержится около 1—2% миоальбумина от всего количества белка. Он является типичным альбумином, т. е. растворяется в воде, не осаждается хлористым натрием при насыщении, но осаждается сернокислым аммонием.
Mиоглобин
Миоглобин — сложный белок хромопротеид с молекулярным весом 16 900. При гидролизе он распадается на белок глобин и небелковую группу гем. Миоглобин окрашивает мышцы в красный цвет; от гемоглобина он отличается белковой частью; простетическая группа у них одинакова.
При окислении гем переходит в гематин, а в присутствии соляной кислоты — в гемин. По содержанию гемина можно судить о количестве миоглобина в мышечной ткани.
Содержание гемина в мышцах крупного рогатого скота колеблется от 42 до 60 мг на 100 г ткани; в мышцах свиней его значительно меньше — от 22 до 42 мг на 100 г ткани, поэтому они слабее окрашены.
Миоглобин, как и пигменты крови, имеют характерный спектр поглощения.
Принцип получения спектров поглощения окрашенных веществ, в частности пигментов мяса и крови, состоит в том, что световая энергия, проходя через раствор пигмента, поглощается этим раствором. При этом происходит так называемая абсорбция (поглощение) света, которую можно обнаружить спектроскопом.
Характерные полосы поглощения для пигментов мышечной ткани и крови находятся в пределах от 400 до 700 ммк. В этом интервале волны воспринимаются нашим глазом, и мы можем увидеть посредством спектроскопа в спектре темные полосы, получающиеся благодаря абсорбции света с определенной длиной волны.
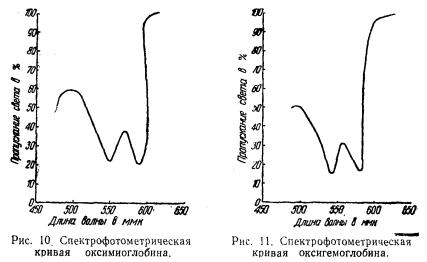
Поглощение света окрашенными веществами можно определить количественно спектрофотометром. Полученные результаты принято выражать графически. В этом случае по оси абсцисс откладывают длину волны света, а по оси ординат — количество света в процентах, прошедшее через раствор. Чем меньше прошло света, тем больше поглотилось его окрашенным веществом. Полное пропускание света раствором принимается за 100%.
На рис. 10 показано поглощение (абсорбция) света раствором оксимиоглобина; из него видно, что оксимиоглобин имеет две ярко выраженные характерные полосы поглощения в видимой области спектра, т. е. два участка, в которых он меньше всего пропускает света и, следовательно, больше всего поглощает света. Максимумы этих участков находятся при двух длинах волн; λ 585 ммк и λ 545 ммк,
На рис. 11 показана для сравнения спектрофотометрическая кривая оксигемоглобина.
Миоглобин обладает большей способностью связываться с кислородом, чем гемоглобин крови. Посредством миоглобина мышечная ткань снабжается кислородом. В работающих мышцах миоглобина содержится больше, так как в них окисление протекает интенсивнее. Известно, что мышцы ног сильнее окрашены, чем спинная мышца; мышцы работающих волов окрашены также сильнее, чем неработающих животных. Особенно это заметно у птиц, грудные мышцы которых, являясь нерабочими, почти не окрашены.
Коллаген и эластин
Коллаген и эластин — соединительнотканные белки не растворимые в воде и солевых растворах. Они образуют сарколемму — тончайшую оболочку мышечного волокна.
Нуклеопротеиды
Нуклеопротеиды — белки, составляющие клеточное ядро. Характерной особенностью их является способность растворяться в растворах слабых щелочей. Это объясняется тем, что в их молекуле содержится простетическая группа, имеющая кислотные свойства.
Разделение белков мышечной ткани
При обработке мышечной ткани солевыми растворами средней концентрации ее белки можно разделить на белки стромы и белки плазмы. Под стромой понимают не растворимую в солевом растворе структурную основу мышечной ткани, которая состоит главным образом из белков сарколеммы (см. схему).

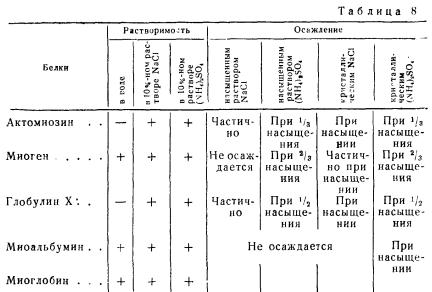
Растворимость внутриклеточных белков мышечной ткани различна. Например, актомиозин и глобулин X не растворяются в воде и легче осаждаются из солевых растворов сернокислым аммонием и хлористым натрием, чем миоген. Миоген растворяется в воде подобно миоальбумину, но отличается от него по высаливаемости.
Растворимость белков мышечной ткани в растворах солей при нейтральной реакции и их осаждаемость приведены в табл. 8.
При посоле, варке и других видах технологической обработки мяса происходит потеря белковых веществ. Величины потерь белков обусловлены различными растворимостью и осаждаемастью их.
Зная свойства белков, можно подобрать такие условия, при которых потери будут наименьшими. Поэтому на изучение указанных свойств белков должно быть обращено особое внимание.
- Химия мышечной ткани
- Денатурация белков крови
- Использование крови для технических целей
- Использование крови для лечебных целей
- Использование крови для пищевых целей
- Порча крови
- Химический состав плазмы крови
- Гемолиз крови
- Химия эритроцитов
- Химический состав крови
- Постоянство состава и физико-химические свойства крови
- Дефибринирование крови
- Стабилизация крови
- Свертывание крови
- Химия крови
- Автолиз
- Гниение белков в кишечнике
- Обмен сложных белков
- Образование специфических веществ
- Декарбоксилирование белков
- Переаминирование белков
- Дезаминирование белков
- Синтез белков
- Обмен белков
- Обмен жиров и липоидов
- Связь между дыханием и брожением
- Обмен углеводов
- Всасывание
- Пищеварение
- Пищевые вещества
