В каких продуктах содержится галогены

Галогены – это класс родственных элементов, которые включают йод, бром, фтор и хлор. С их соединениями, то есть с йодидом, бромидом, фторидом и хлористыми солями мы сталкиваемся в пищевых продуктах, лекарственных препаратах и окружающей среды.О йоде многие знают с детства, им обрабатывали сбитые коленки в детстве.
Позже мы узнали о том, что этот галоген необходим для синтеза гормонов щитовидной железы. Прочитать об этом можно в статье «Правда и мифы о йоде»
Да, йод необходим организму, его дефицит опасен для организма также как и его избыток.
Но почему, то мало говорят и пишут о токсичности галогенов. Более того, их добавляют в продукты питания, воду, средства по уходу за телом и с их помощью отравляют людей.
О токсическом действии галогенов.
1. Что надо знать о токсическом действии галогенов.
1) Йод и хлориды полезны в небольших количествах, другие являются токсичными.
2) Галогены могут связываться с рецепторами йода, блокировать действие йодида и гормонов щитовидной железы, и вызывать многие тяжелые заболевания.
3) Токсичные галогены очень медленно выделяются из организма, и не известны пути их детоксикации из печени.
4) Выведение токсичных галогенов может быть увеличено следующими способами:
- Высокими дозами йода,
- Высокими дозами витамина С,
- Нерафинированной морской соли (которая заменяет бромид хлоридом),
- Ванны с английской солью,
- Потоотделение в сухой инфракрасной сауне.
2. Токсичность бромида/брома.
1)Бром является ядом и в пище не должен применяться.
2)Бром может связываться с рецепторами йода и блокировать их функцию.
3) Однако, этот галоген заменяет йодид во многих продуктах, лекарственных препаратах и в окружающей среде, несмотря на то, что это пестицид.
4) Он заменил йод при обработке белой муки и уменьшил потребление йода человеком на 726 мкг/день.
5) Симптомы интоксикации брома.
Эти симптомы включают:
- Ощущение скуки,
- Апатию,
- Депрессию,
- Раздражительность, головную боль,
- Гипотиреоз.
6) Признаки тяжелой интоксикации бромом.
Они характеризуются:
- Бредом,
- Шизофренией,
- Галлюцинациями.
7) Некоторые лекарства содержат бром.
- атровент ингалятор,
- назальный спрей атровент.
Есть и другие препараты. Будьте с ними осторожнее, до покупки препарата прочитайте его состав, инструкции есть в Интернете.
«8)» Продукты питания, содержащие бром.
- Все хлебобулочные изделия из белой муки содержат бром, так как мука им обрабатывается.
- некоторые энергетические напитки содержат его.
- некоторые бассейны могут его содержать.
- он содержится в некоторых пестицидах и может попасть в воду.
3. Токсичность фторида/фтора.
Фтор известен как токсин и может привести к летальному исходу.
Но уже более 50 лет его добавляют в питьевую воду, чтобы не было кариеса у людей.
Это было сделано в законодательном порядке без всяких научных исследований.
Позднее было показано, что нет никакой разницы в заболевании зубов с фтором или без него.
Сразу после того, как в Америке стали фторировать водопроводную воду, многие страны также перешли на фторирование воду.
После того, как ученые установили, что фтор не сохраняет зубы от кариеса, многие страны перестали фторировать питьевую воду.
1) Чем вреден фтор?
Сейчас широко известно вредное действие фтора на организм человека:
- он вызывает флюороз (изменение цвета зубов),
- вызывает перелом бедер,
- способствует появлению рака костей,
- снижает интеллект,
- токсичен для почек,
- является причиной зоба у собак.
- фтор является более токсичным, когда в организме есть дефицит йодида.
2) Фтор может содержаться в лекарствах.
Поэтому внимательно изучайте состав препарата до его покупки.
3) Фтор может содержаться в средствах гигиены.
Наиболее часто он содержится в зубной пасте, даже в детской.
Вам может быть полезна статья «Сделайте самую лучшую зубную пасту, рецепты»
4. Токсичность хлорида/ хлора.
1) Хлорид является важным элементом во внеклеточной жидкости, он необходим в виде соляной кислоты в желудке для пищеварения.
2) Но в больших количествах он токсичен и с его побочными продуктами он может вызвать:
- врожденные дефекты,
- рак,
- репродуктивные расстройства,
- мертворождения,
- нарушения иммунной системы.
3) Избыток натрия хлорида (соли) конкурирует с йодидом и может вызвать гипотиреоз.
4) Источники хлорида.
Это могут быть:
- продукты (соль, питьевая вода, сукралоза или спленда, то есть хлорированный сахар).
- газообразный хлор в паре посудомоечной машины, горячей ванне, бассейны.
5. Перхлорат.
Перхлорат – это один атом хлора, окруженный 4 атомами кислорода. Является токсином.
Его наличие в организме может привести к:
1)гипотиреозу,
2) раку щитовидной железы,
3) зобу,
4) мастопатии,
5) нарушению менструального цикла,
6) дисфункции иммунной системы,
7) плохому развитию плода,
«8)» умственной отсталости новорожденных.
Дополнительно о перхлорате вы можете прочитать в статье «Йод, щитовидная железа, перхлорат и здоровье»
Будьте здоровы! И пишите комментарии.
10 голосов
Средняя оценка: 5 из 5
Здравствуйте, уважаемые читатели. Тема правильного питания сегодня интересна всем, кто хочет оставаться бодрым и здоровым долгие годы. Мы следим за калорийностью рациона, рассчитываем количество углеводов, белков, жиров, витаминов. Однако забываем, что для полноценной жизнедеятельности организму нужны микроэлементы, например фтор. Давайте разберемся, где же искать этот экзотический компонент, и какие фторсодержащие продукты питания предпочтительнее.
Для чего нашему организму нужны ионы F

Поскольку фтор это газообразное вещество группы галогенов, в наш организм он попадает в виде соединений различных металлов (кальция, натрия, олова). Далее он ионизируется и переносится кровью к органам и тканям.
Потребность человека во фторе невелика, всего лишь 0,5-4 миллиграмма за сутки. Учитывая, что литр питьевой воды содержит 3-12 мг фторидов, можно сказать, что специально насыщать рацион продуктами с содержанием фтора нет никакой необходимости, при условии соблюдения основных принципов правильного питания.

Хотя фтор принято относить к группе условно жизненно необходимых микроэлементов, совсем обойтись без него у организма не получится. Сам по себе F необходим на этапе формирования зубной эмали и костей. От его содержания зависит состояние ногтевой пластины и волос, а также скорость регенерации поврежденных тканей.
Читайте также:
В каких продуктах содержится много аминокислот: самые нужные и незаменимые для человека

Ионы фтора катализируют кроветворение, помогают организму избавляться от радионуклидов и тяжелых металлов. Помимо этого, галоген ускоряет процесс усвоения Ca или железа из продуктов питания.
Прекрасная совместимость фтора и кальция позволяет им работать в тандеме, всячески укрепляя кости и зубную эмаль. Поэтому микроэлемент особенно важен для женщин. Как известно, во время вынашивания малыша мама нуждается в регулярном поступлении кальция, необходимого для формирования скелета ребенка.
Читайте также:
Чем полезны и вредны семена подсолнуха для здоровья — какая норма употребления в день

При его нехватке организм позаимствует микроэлемент из костной ткани, что немедленно скажется на состоянии волос и ногтей будущей мамочки. Дамам старшего возраста важно употреблять максимально допустимое количество продуктов, содержащих фториды, чтобы исключить развитие остеопороза.
Еще одно полезное свойство галогена F – его способность снижать агрессивность кислой среды в полости рта и уничтожать бактерии, вызывающие кариес. Кстати, этим успешно пользуются производители зубной пасты.
Как скажется на организме избыток микроэлемента

Последнее время появилось множество статей и публикаций на тему вреда фтора. Дескать, этот химический элемент для человеческого организма небезопасен. Надо сказать, что галоген действительно ядовит, но только в своем естественном, газообразном состоянии.
Более того, из продуктов мы получаем его в микродозах, накопить критическую концентрацию вещества организм не успевает, поскольку F быстро утилизируется через мочевыделительную систему. Но покупать продукцию обогащенную фтором специально действительно не стоит. Мало того, что цены на такой товар выше на 20-30%, риск передозировки при их потреблении заметно увеличивается.
Возможно вас еще заинтересует:
В каких продуктах питания содержится омега-3 больше всего

Теперь немного о том, как можно узнать, что вашему организму многовато фтора. Поскольку ионы галогена следуют, прежде всего, в костную ткань, его избыток проявит себя белыми пятнами на зубной эмали. Но если этот признак легко обнаружить визуально, другие последствия, вроде носовых кровотечений, скачков давления, кожного зуда или головных болей, нередко списывают на другие факторы.

Постоянное превышение необходимой суточной нормы фторидов ведет к снижению иммунитета, усложнению течения хронических недугов, развитию аллергии и даже возникновению опухолей. Нужно учесть, что соединения фтора несовместимы с магнием, его полноценному усвоению они препятствуют.
Где содержится микроэлемент

Различное количество фтора содержат практически все категории продуктов питания. Но нужно признать, что в большом количестве микроэлемент не содержится нигде. Как правило, его присутствие в продуктах ограничивается десятыми и сотыми миллиграмма.
Читайте также:
Чем полезны персики для организма мужчин и женщин и есть ли противопоказания?

Относительно велико его содержание в морской рыбе. Особенно богата фторидами скумбрия, содержащая 35% микроэлемента от суточной нормы потребления. В каких еще продуктах содержится фтор, можно узнать из таблицы. Расчеты приводятся исходя из максимальной нормы суточного потребления.
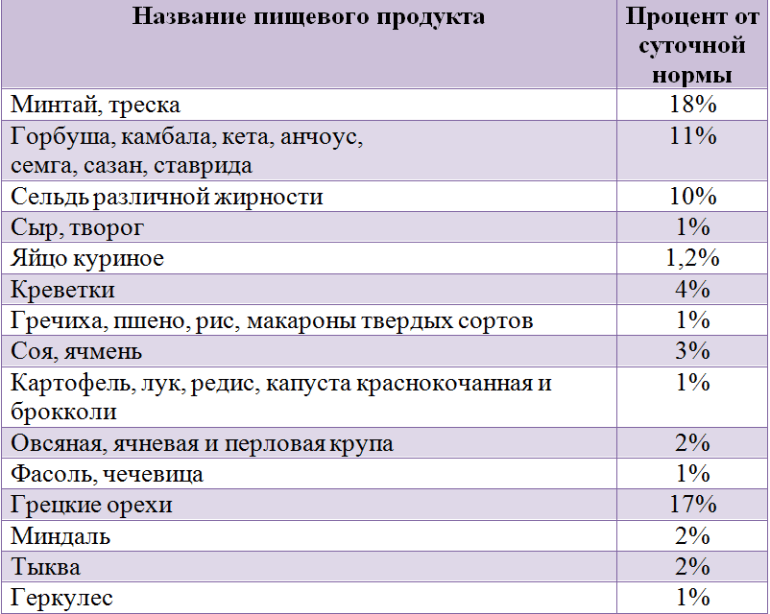
Фториды можно получить не только из рыбы, молочных продуктах или круп. Некоторое их количество имеется в говядине или телятине, печени. Если говорить о морепродуктах, то микроэлемент можно обнаружить в морской капусте (ламинарии). Соединения фтора присутствуют в яблоках, винограде, финиках, шпинате, свекольной ботве, подсолнечных и тыквенных семенах.

Вам наверняка любопытно будет узнать, что помимо перечисленных продуктов, микроэлемент в значительном количестве присутствует в чайном листе. Можно сказать, что растение фаворит по содержанию фтористых соединений. При этом во время заваривания лист отдает воде примерно 50-70% вещества.
Читайте также:
В чем содержится витамин с в большом количестве — таблица со списком продуктов

Именно поэтому считается, что чай полезен для зубов. Особенно это касается зеленых сортов, которые почти не содержат красящий пигмент, а значит не вызовут пожелтения эмали. На пользу пойдут горячие напитки, приготовленные с добавлением мяты. В ее листочках и стеблях тоже присутствует фтор.
Прощаясь с вами, уважаемые читатели, хочу пожелать хорошего здоровья. Напоминаю, что интересная информация появляется регулярно, поэтому непременно подпишитесь на блог, чтобы не пропустить новинки. Поделитесь ссылкой на статью с друзьями по социальным сетям.
| Группа → | 17 (VIIA) | ||||||
|---|---|---|---|---|---|---|---|
| ↓ Период | |||||||
| 2 |
| ||||||
| 3 |
| ||||||
| 4 |
| ||||||
| 5 |
| ||||||
| 6 |
| ||||||
| 7 |
| ||||||
Галоге́ны (от греч. ἁλός — «соль» и γένος — «рождение, происхождение»; иногда употребляется устаревшее название гало́иды) — химические элементы 17-й группы периодической таблицы химических элементов Д. И. Менделеева (по устаревшей классификации — элементы главной подгруппы VII группы)[1].
Реагируют почти со всеми простыми веществами, кроме некоторых неметаллов. Все галогены — энергичные окислители, поэтому встречаются в природе только в виде соединений. С увеличением порядкового номера химическая активность галогенов уменьшается, химическая активность галогенид-ионов F−, Cl−, Br−, I−, At− уменьшается.
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент теннессин Ts.
Все галогены — неметаллы, являются сильными окислителями. На внешнем энергетическом уровне 7 электронов. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены (кроме фтора) при взаимодействии с более электроотрицательными элементами могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Этимология[править | править код]
Термин «галогены» в отношении всей группы элементов (на тот момент были известны фтор, хлор, бром и иод) был предложен в 1841 году шведским химиком Й. Берцелиусом. Первоначально слово «галоген» (в буквальном переводе с греческого — «солерод») было предложено в 1811 году немецким учёным И. Швейггером в качестве названия для недавно открытого хлора, однако в химии закрепилось название, которое предложил Г. Дэви[2].
Строение атомов и степени окисления[править | править код]
Электронная конфигурация внешней электронной оболочки атомов галогенов ns2np5: фтор — 2s22p5, хлор — 3s23p5, бром — 4s24p5, иод — 5s25p5, астат — 6s26p5.
Имея на внешней электронной оболочке 7 электронов, атомы всех галогенов легко присоединяют недостающий до завершения оболочки 1 электрон и в своих соединениях проявляют степень окисления −1. Хлор, бром, иод и астат в соединениях с более электроотрицательными элементами проявляют положительные степени окисления: +1, +3, +5, +7. Для фтора характерна постоянная степень окисления −1.
Распространённость элементов и получение простых веществ[править | править код]
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а теннессин в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причём объёмы производства хлора значительно выше, чем трёх других стабильных галогенов.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов). Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF2).
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F−) = +2,87 В и Eo(Cl2/Cl−) = +1,36 В показывают, что окислить ионы F− и Cl− можно только сильными окислителями. В промышленности применяется только электролитическое окисление. При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде:
полуреакция на катоде:
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом является, в частности, RuO2).
В современных электролизёрах катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na+ переходить из анодного пространства в катодное. Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl− в Cl2) и накапливаются у катода (образование OH−). Перемещение OH− в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH− реагировал бы с Cl2 и сводил на нет весь результат.
Бром получают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения иода из природных рассолов, богатых I−. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br2 и I2 удаляются из раствора потоком воздуха.
Физические свойства галогенов[править | править код]
| Вещество | Агрегатное состояние при обычных условиях | Цвет | Запах |
|---|---|---|---|
| Фтор F2 | Газ, не сжижается при обычной температуре | Светло-желтый | Резкий, раздражающий |
| Хлор CI2 | Газ, сжижающийся при обычной температуре под давлением | Жёлто-зелёный | Резкий, удушливый |
| Бром Br2 | Тяжёлая летучая жидкость | Буровато-коричневый | Резкий, зловонный |
| Иод I2 | Твёрдое вещество | Тёмно-серый с металлическим блеском | Резкий |
| Астат At2 | Твёрдое вещество | Сине-чёрный с металлическим блеском | Вероятно, резкий |
| Простое вещество | Температура плавления, °C | Температура кипения, °C |
| F2 | −220 | −188 |
| Cl2 | −101 | −34 |
| Br2 | −7 | 58 |
| I2 | 113,5 | 184,885 |
| At2 | 244 | 309[3] |
Химические свойства галогенов[править | править код]
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к теннессину. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р); все реакции при этом сильно экзотермические и могут протекать со взрывом, например:
При нагревании фтор окисляет все другие галогены по схеме
Hal2 + F2 = 2НalF
причём в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с тяжёлыми инертными (благородными) газами:
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов:
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Возбуждение этой реакции происходит под действием фотонов , которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
а также обратимо реагирует с водой, образуя равновесную смесь веществ, называемую хлорной водой:
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
- на холоде
- при нагревании:
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии, и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора. Он вступает в те же реакции, что и хлор. Являясь более мягким реагентом, бром находит широкое применение в органической химии. Бром, так же как и хлор растворяется в воде и, частично реагируя с ней, образует так называемую «бромную воду».
Растворимость в воде иода — 0,3395 грамма на литр при 25 градусах Цельсия[4], это меньше, чем у брома. Водный раствор иода называется «иодной водой»[5]. Иод способен растворяться в растворах иодидов с образованием комплексных анионов:
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и обратимой:
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов[6].
Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
При диссоциации образуются не только анионы, но и катионы At+: HAt диссоциирует на:
Применение галогенов и их соединений[править | править код]
Природное соединение фтора — криолит Na3AlF6 — применяется при получении алюминия. Соединения фтора используются в качестве добавок в зубные пасты для предотвращения заболеваний кариесом.
Хлор широко используется для получения соляной кислоты, в органическом синтезе при производстве пластмасс и синтетических волокон, каучуков, красителей, растворителей и др. Многие хлорсодержащие соединения используют для борьбы с вредителями в сельском хозяйстве. Хлор и его соединения применяются для отбеливания льняных и хлопчатобумажных тканей, бумаги, обеззараживания питьевой воды. Правда, применение хлора для обеззараживания воды далеко не безопасно, для этих целей лучше использовать озон.
Простые вещества и соединения брома и иода используются в фармацевтической и химической промышленности.
Токсичность галогенов[править | править код]
Вследствие высокой реакционной способности (особенно это ярко проявляется у фтора) все галогены являются ядовитыми веществами с сильно выраженным удушающим и поражающим ткани воздействиями.
Большую опасность представляют пары и аэрозоль фтора, так как в отличие от других галогенов имеют довольно слабый запах и ощущаются только в больших концентрациях.
Примечания[править | править код]
- ↑ Periodic Table of the Elements (англ.) (недоступная ссылка). IUPAC. — PDF. Дата обращения 25 октября 2013. Архивировано 22 августа 2015 года.
- ↑ Snelders, H. A. M. J. S. C. Schweigger: His Romanticism and His Crystal Electrical Theory of Matter (англ.) // Isis (англ.)русск. : journal. — 1971. — Vol. 62, no. 3. — P. 328. — doi:10.1086/350763.
- ↑ Бердоносов С.С. Астат // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
- ↑ Стасиневич Д.С. Иод // Краткая химическая энциклопедия / Отв. ред. И. Л. Кнунянц. — М.: Советская Энциклопедия, 1963. — Т. 2. Ж—Малоновый эфир.
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 84. Фтор, бром, иод // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 197—199. — 240 с. — 1 630 000 экз.
- ↑ Н. Е. Кузьменко, В. В. Еремин, В. А. Попков. Начала химии. Современный курс для поступающих в вузы: учебник / Кузьменко, Н. Е.. — 16. — 107045, Москва, Луков пер., д. 8.: «Экзамен», 2013. — С. 343—347. — 831 с. — ISBN 978-5-377-06154-0.
Литература[править | править код]
- Greenwood, Norman N. (англ.)русск.; Earnshaw, Alan. Chemistry of the Elements (неопр.). — 2nd. — Butterworth–Heinemann (англ.)русск., 1997. — ISBN 0080379419.
