Укажите какие свойства углекислого газа лежат в основе этого опыта

Задания. 1. Получите углекислый газ взаимодействием мрамора с соляной кислотой.
2. Изучите некоторые физические свойства диоксида углерода (IV) (цвет, запах, растворимость в воде, относительную плотность).
3. а) Изучите взаимодействие углекислого газа с водой;б) осуществите следующие превращения;
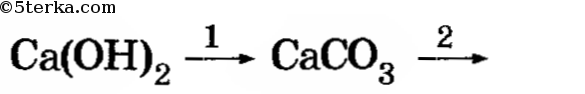
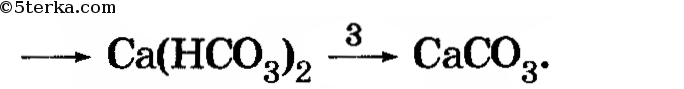
4. Распознайте известняк среди выданных образцов минералов.
5. Получите карбонат бария с помощью реакции обмена.
Оборудование. Прибор для получения газов, заправленный кусочками мрамора и соляной кислотой, лабораторный штатив, штатив с пробирками, пипетки, стаканы на 150 мл (2 шт.), картонный кружок для стакана, пробиркодержатели (2 шт.), нагревательный прибор.
Вещества. 10%-е растворы карбоната натрия и хлорида бария, 10%-я соляная кислота, известковая вода, раствор лакмуса, дистиллированная вода, минералы гипс, каолин, известняк, кварц.
Выполнение работы
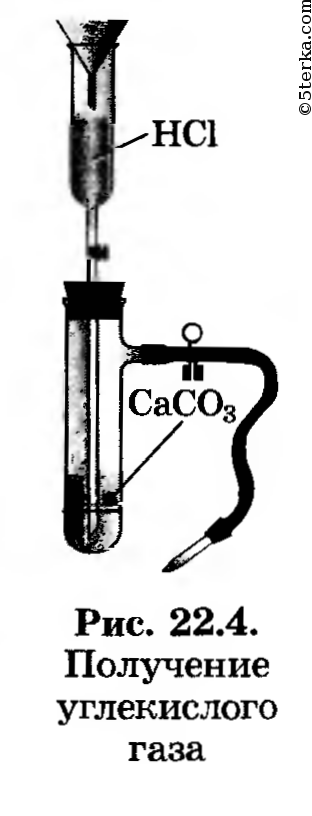
1. Получение оксида углерода (IV). Зарядите прибор для получения углекислого газа (рис. 22.4). Получите углекислый газ, соберите его в химический стакан и прикройте картонным кружком. (Для чего?)
2. Изучение свойств оксида углерода (IV). Внесите в стакан горящую спичку. Что наблюдаете? «Перелейте» содержимое в другой стакан. Убедитесь с помощью горящей спички, что углекислый газ действительно «перелился» из одного стакана в другой.
Какое свойство углекислого газа лежит в основе этого опыта? Опишите физические свойства исследуемого газа.
Налейте в пробирку (на 1 /4 ее объема) дистиллированную воду, подкрасьте ее фиолетовым раст
вором лакмуса и пропускайте через эту воду углекислый газ до изменения окраски индикатора. Почему изменилась окраска лакмуса? Составьте уравнение соответствующей реакции. Нагрейте содержимое пробирки до начала кипения. Почему снова изменился цвет лакмуса? Объясните это с помощью уравнения реакции.
3. Прилейте в пробирку (на 1/4 ее объема) известковую воду и пропускайте через нее углекислый газ. Что вы наблюдаете? Где используется в практике эта реакция? Продолжайте пропускать углекислый газ через мутную смесь до полного осветления раствора. Что произошло? Составьте уравнения наблюдаемых реакций.
Содержимое пробирки с полученным гидрокарбонатом кальция разделите на две равные части. В одну пробирку добавьте известковую воду, а другую нагрейте до начала кипения раствора. Что вы наблюдаете? Объясните происходящее явление с помощью уравнений реакций. Сделайте выводы: а) каким образом карбонаты можно превратить в гидрокарбонаты;б) как можно гидрокарбонаты превратить в карбонаты.
4. Из выданных вам минералов с помощью химических реакций определите известняк. Составьте ионные уравнения проделанной реакции.
5. Получите реакцией обмена карбонат бария. Опытным путем докажите, что выпавший осадок действительно является карбонатом. Составьте полные и сокращенные ионные уравнения проделанных реакций.
1.
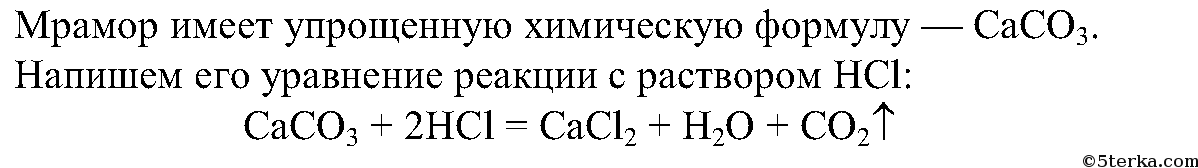
Картонным кружком стакан прикрывают для того, чтобы не улетучивался углекислый газ.
2.
При внесении в стакан с углекислым газом спичка тухнет, т.к. углекислый газ не поддерживает горения. Углекислый газ можно переливать из одного стакан в другой, т.к. он тяжелее воздуха и оседает на дне.
Физические свойства.

3.
Наблюдается помутнение раствора, на практике это используется при побелке стен. Происходит реакция:
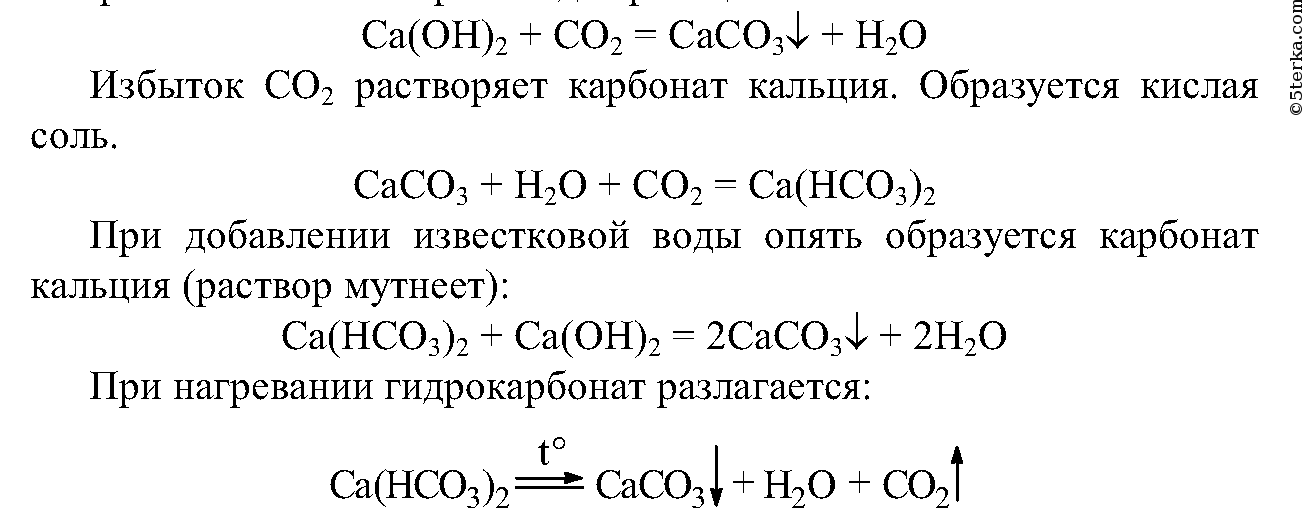
Выводы:
а) карбонаты можно перевести в гидрокарбонаты, пропуская через них углекислый газ;
б) гидрокарбонаты можно перевести в карбонаты нагреванием или добавлением известковой воды.
4.
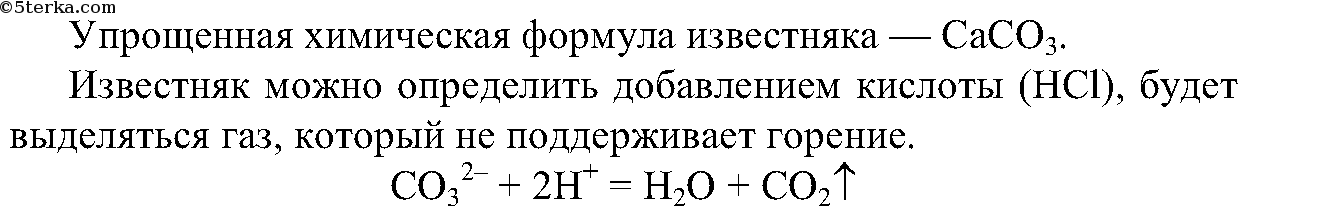
5.
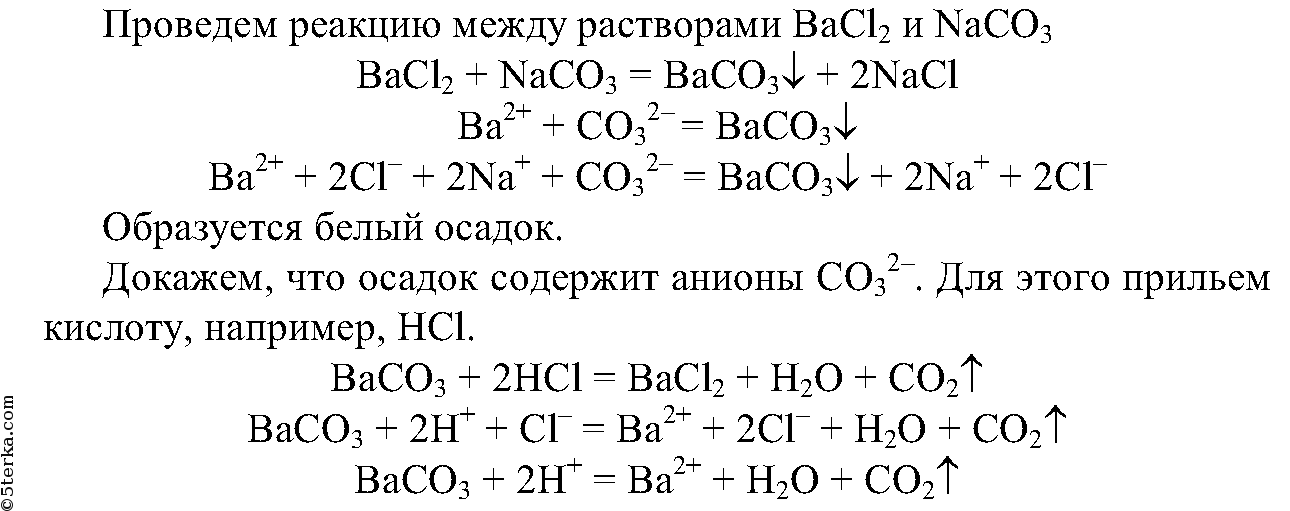
Выделяется газ, который не поддерживает горение.
Урок № 43
Дата:
Тема: Практическая работа 5.
Получение оксида углерода (IV) и изучение его свойств. Свойства карбонатов.
Цели урока.
Образовательная: на практических примерах закрепить знания уч-ся о лабораторных способах получения, физических и химических свойствах оксида углерода (IV), свойствах карбонатов и гидрокарбонатов и способах их распознавания.
Развивающая: совершенствовать умения уч-ся собирать прибор для получения газов и пользоваться им. Научить собирать оксид углерода (IV) вытеснением воздуха и подтверждать, что собран именно этот газ. Закрепить навыки выполнения химических опытов, характеризующих свойства оксида углерода (IV) и карбонатов.
Оборудование: аппарат Кирюшкина для получения газообразных веществ, CaCO3 (мел или мрамор ), HCl, Ca(OH)2 (известковая вода ), Na2CO3, NaHCO3, NaCl, Na2SO4, лучинка, спиртовка, спички, химические стаканы, стакан с водой, лакмус 7-8 пробирок, микролаборатория, учебник И.И. Новошинский, Н.С. Новошинская «Химия 9 класс».
Ход урока: I. Организация класса.
Актуализация внимания уч-ся:
каковы формулы углекислого газа, угольной кислоты, карбонатов натрия, кальция, алюминия, гидрокарбонатов натрия, кальция?
как в лаборатории можно получить углекислый газ? Как его можно распознать?
какими методами можно собрать углекислый газ?
как происходит взаимопревращение карбонатов и гидрокарбонатов?
как можно распознать карбонаты (какая качественная реакция существует для распознавания карбонатов)?
Оформление уч-ся таблицы проведения опытов:
Название опыта, исходные вещества
Условия и признаки реакций
Уравнения реакций (в молекулярном и ионно — молекуляр-ном виде)
Выводы
1. Получить углекислый газ с помощью аппарата Кирюшкина. Исходные вещества: CaCO3, HCl.
1. Выделение пузырьков газа
1. CaCO3 + HCl
1. Углекислый газ в лаборатории можно получить при взаимодействии карбонатов и сильной кислоты.
2. Изучение физических свойств углекислого газа: наполнить стакан, проверить наполнение горящей лучинкой, «перелить» газ в другой стакан, определить наличие газа в обоих стаканах.
2. Горящая лучинка тухнет в атмосфере углекислого газа.
2. а) Углекислый газ не поддерживает горение;
б) Углекислый газ – газ, б/ц, б/в, б/з, мало растворим в воде, тяжелее воздуха.
3. Изучение химических свойств углекислого газа: пропустить через раствор известковой воды углекислый газ; полученный прозрачный раствор гидрокарбоната кальция нагреть до кипения.
Исходные вещества: CO2, Ca(OH)2.
3. а)помутнение раствора (образование осадка);
б) раствор осветлился (растворение осадка)
в) нагревание, помутнение раствора.
3. а) CO2 + +Ca(OH)2СаСО3 + +Н2О
б) CaCO3+CO2+ H2O Ca(HCO3)2
в) Ca(HCO3)2 –t
CaCO3+CO2+ H2O
3. а) оксид углерода (IV) – кислотный оксид, реагирует с основными оксидами и основаниями.
б) карбонат можно превратить в гидрокарбонат при пропускании через него в растворе углекислого газа.
в) гидрокарбонат при нагревании превращается в карбонат.
4. Отношение карбонатов к действию кислот. Исходные вещества: Na2CO3, NaHCO3, CaCO3, HCl.
4. а) выделение пузырьков газа
б) выделение пузырьков газа.
в) выделение пузырьков газа.
4.a) Na2CO3+HCl
б) NaHCO3+HCl
в) CaCO3+HCl
4. карбонаты и гидрокарбонаты реагируют с сильными кислотами с образованием углекислого газа.
5. Распознавание карбонатов. Исходные вещества: NaCl, Na2CO3, Na2SO4, HCl.
5. выделение пузырьков газа.
5. Na2CO3 + HCl
5. Качественным реагентом на карбонаты являются сильные кислоты (Н+)
IV. Проведение опытов, заполнение соответствующих граф таблицы.
Домашнее задание: повт. пар. 37, 38,39, стр. 158 № 4 (задача).
Далее раздаточный материал для учащихся.
Название опыта, исходные вещества
Условия и признаки реакций
Уравнения реакций (в молекулярном и ионно — молекуляр-ном виде)
Выводы
1. Получить углекислый газ с помощью аппарата Кирюшкина. Исходные вещества: CaCO3, HCl.
1.
1.
1.
2. Изучение физических свойств углекислого газа: наполнить стакан, проверить наполнение горящей лучинкой, «перелить» газ в другой стакан, определить наличие газа в обоих стаканах.
2.
2. а)
б)
3. Изучение химических свойств углекислого газа: пропустить через раствор известковой воды углекислый газ; полученный прозрачный раствор гидрокарбоната кальция нагреть до кипения.
Исходные вещества: CO2, Ca(OH)2.
3. а)
б)
в)
3. а)
б)
в)
3. а)
б)
в)
4. Отношение карбонатов к действию кислот. Исходные вещества: Na2CO3, NaHCO3, CaCO3, HCl.
4. а)
б)
в)
4.a)
б)
в)
4.
5. Распознавание карбонатов. Исходные вещества: NaCl, Na2CO3, Na2SO4, HCl.
5.
5.
5.
задания. 1. получите углекислый газ взаимодействием мрамора с соляной кислотой.
2. изучите некоторые физические свойства диоксида углерода (iv) (цвет, запах, растворимость в воде, относительную плотность).
3. а) изучите взаимодействие углекислого газа с водой;б) осуществите следующие превращения;


4. распознайте известняк среди выданных образцов минералов.
5. получите карбонат бария с помощью реакции обмена.
оборудование. прибор для получения газов, заправленный кусочками мрамора и соляной кислотой, лабораторный штатив, штатив с пробирками, пипетки, стаканы на 150 мл (2 шт.), картонный кружок для стакана, пробиркодержатели (2 шт.), нагревательный прибор.
вещества. 10%-е растворы карбоната натрия и хлорида бария, 10%-я соляная кислота, известковая вода, раствор лакмуса, дистиллированная вода, минералы гипс, каолин, известняк, кварц.
выполнение работы
1. получение оксида углерода (iv). зарядите прибор для получения углекислого газа (рис. 22.4). получите углекислый газ, соберите его в химический стакан и прикройте картонным кружком. (для чего?)

2. изучение свойств оксида углерода (iv). внесите в стакан горящую спичку. что наблюдаете? «перелейте» содержимое в другой стакан. убедитесь с помощью горящей спички, что углекислый газ действительно «перелился» из одного стакана в другой.
какое свойство углекислого газа лежит в основе этого опыта? опишите физические свойства исследуемого газа.
налейте в пробирку (на 1 /4 ее объема) дистиллированную воду, подкрасьте ее фиолетовым раст
вором лакмуса и пропускайте через эту воду углекислый газ до изменения окраски индикатора. почему изменилась окраска лакмуса? составьте уравнение соответствующей реакции. нагрейте содержимое пробирки до начала кипения. почему снова изменился цвет лакмуса? объясните это с помощью уравнения реакции.
3. прилейте в пробирку (на 1/4 ее объема) известковую воду и пропускайте через нее углекислый газ. что вы наблюдаете? где используется в практике эта реакция? продолжайте пропускать углекислый газ через мутную смесь до полного осветления раствора. что произошло? составьте уравнения наблюдаемых реакций.
содержимое пробирки с полученным гидрокарбонатом кальция разделите на две равные части. в одну пробирку добавьте известковую воду, а другую нагрейте до начала кипения раствора. что вы наблюдаете? объясните происходящее явление с помощью уравнений реакций. сделайте выводы: а) каким образом карбонаты можно превратить в гидрокарбонаты;б) как можно гидрокарбонаты превратить в карбонаты.
4. из выданных вам минералов с помощью химических реакций определите известняк. составьте ионные уравнения проделанной реакции.
5. получите реакцией обмена карбонат бария. опытным путем докажите, что выпавший осадок действительно является карбонатом. составьте полные и сокращенные ионные уравнения проделанных реакций.
1.

картонным кружком стакан прикрывают для того, чтобы не улетучивался углекислый газ.
2.
при внесении в стакан с углекислым газом спичка тухнет, т.к. углекислый газ не поддерживает горения. углекислый газ можно переливать из одного стакан в другой, т.к. он тяжелее воздуха и оседает на дне.
физические свойства.

3.
наблюдается помутнение раствора, на практике это используется при побелке стен. происходит реакция:

выводы:
а) карбонаты можно перевести в гидрокарбонаты, пропуская через них углекислый газ;
б) гидрокарбонаты можно перевести в карбонаты нагреванием или добавлением известковой воды.
4.

5.

выделяется газ, который не поддерживает горение.
Если к данной задачи нет решения — не переживайте. Наши администраторы стараются дополнять сайт решениями для тех задач
и упражнения где это требуется и которые не даны в решебниках и сборниках с ГДЗ. Попробуйте зайти позже. Вероятно, вы найдете то, что искали 🙂
- Главная
- Вопросы & Ответы
- Вопрос 1079104
 Гость:
Гость:
7 лет назад
6
1
Лучший ответ:


Гость:
лучина не будет загораться, т.к. углекислый газ горение не поддерживает
7 лет назад
Ваш ответ (не менее 20 символов):
Ваше имя (не менее 2 символов):

Лучшее из галереи:































Другие вопросы:
 Гость:
Гость:
РЕШИТЕ ПРИМЕР 9094+523920 РАЗДЕЛИТЬ НА 236 -19044 РАЗДЕЛИТЬ НА 36
7 лет назад
Смотреть ответ
5
1
 Гость:
Гость:
Випиши речення з однорідними присудками. Море дедалі більше втрачало спокій.Чайки знімались з одиноких берегових скель, припадали грудьми до хвиль і плакали над морем. Море стемніло, змінилось. Дрібні хвилі зливались докупи і непомітно підкрадались до берега, падали на пісок і розбивались на білу пі…
7 лет назад
Смотреть ответ
4
1
 Гость:
Гость:
задание разложите на множетели сделать три 2 и три 4 во вложениях
7 лет назад
Смотреть ответ
30
1
 Гость:
Гость:
В прямоугольнике ABCD — биссектриса угла А пересекает ВС в точке К. Найти АК, если AD = 11, периметр ABCD = 38
7 лет назад
Смотреть ответ
6
1
 Гость:
Гость:
ФСУ. Разность квадратов. помогите пож-ста решить
7 лет назад
Смотреть ответ
57
1
ПРАКТИЧЕСКАЯ РАБОТА №1.
ТЕМА: ПОЛУЧЕНИЕ КАРБОН (IV) ОКСИДА И ИЗУЧЕНИЕ ЕГО
СВОЙСТВ. ПРЕВРАЩЕНИЕ КАРБОНАТОВ И ГИДРОГЕНКАРБОНАТОВ.
Цели урока:
- продолжить формирование экспериментальных навыков учащихся с химическими веществами и лабораторным оборудованием;
- проверить знания техники безопасности во время работы в кабинете химии;
- углубить знания о химических свойствах оксидов на примере свойств карбон (IV) оксида;
- выяснить уровень усвоения знаний о химических свойствах оксидов неметаллов на примере карбон (IV) оксида.
Тип урока: практическое применение знаний, умений и навыков.
Формы работы: выполнение эксперимента, написание отчёта.
Оборудование: пробирка, воронка, газоотводная трубка, штатив, пинцет, спиртовка, держатель, химический стакан.
ХОД УРОКА
І. Организация класса.
ІІ. Повторение правил техники безопасности в кабинете химии, во время проведения химического эксперимента. Инструктаж перед началом практической работы. Техника безопасности. Следует соблюдать правила работы с растворами кислот. Не допускать попадания кислот на кожу и слизистые оболочки.
ІІІ. Выполнение практической работы.
Опыт 1. Получение углекислого газа и его обнаружение.
Подготовьте прибор для получения углекислого газа, проверьте
его на герметичность.
Положите
в пробирку несколько кусочков мела и долейте 1-2 мл соляной кислоты,
чтобы только покрыть их поверхность. Закройте быстро пробирку пробкой с
газоотводной трубкой и погрузите ее конец в пустую пробирку примерно на
минуту. С помощью зажженой лучины определите наличие в пробирке
углекислого газа.
СаCO3 + 2HCl = CaCl2 + CO2 ↑ +H2O
Видеоролик: Получение углекислого газа и опыты с ним.
Опыт 2. Реакция углекислого газа с кальций гидроксидом (известковой водой).
Пропустите следующую порцию углекислого газа в пробирку с 1 — 2 мл известковой воды до образования осадка.
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
Карбонаты
– соли угольной кислоты, в которых замещены оба иона водорода. Когда
замещен только один ион водорода – получаются гидрокарбонаты.
Большинство карбонатов – нерастворимые соединения, все гидрокарбонаты –
растворимые. Нерастворимый карбонат превращается в растворимый
гидрокарбонат при пропускании через раствор избытка углекислого газа.
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
При нагревании раствора гидрокарбоната выделяется углекислый газ, и вновь образуется нерастворимый карбонат кальция.
Ca(HCO3)2 = CaCO3↓ + CO2 + H2O
Какая
соль образовалась? Продолжайте пропускать углекислый газ до образования
прозрачного раствора. Какая соль образовалась? Прокипятите полученный
раствор к образованию осадка.
Видеоролик: Взаимопревращение карбонатов и гидрокарбонатов.
Опыт 3. Распознавание карбонатов.
В
четырех пронумерованных пробирках содержатся растворы натрий сульфата,
натрия хлорида, натрий карбоната и натрий силиката. Определите
содержимое каждой пробирки химическим способом.
ІV. Контрольные задания
1. Объясните, благодаря каким свойствам угольной кислоты
возможна реакция между ее солью и соляной кислотой. Можно
ли считать ее качественной на соли угольной кислоты? Почему?
2. Перечислите физические свойства углекислого газа, которые наблюдались во время его получения.
3. Выясните, какое свойство углекислого газа лежит в основе
его определения с помощью зажженной лучины.
4.
Объясните, почему при пропускании углекислого газа через
известковую воду она сначала мутнеет, затем становится прозрачной, а
при нагревании выпадает осадок.
V. Сделайте обобщающий вывод.
VI. Домашнее задание: Повторить химические свойства неметаллов и их оксидов. Подготовиться к письменному опросу.
ПРИЛОЖЕНИЯ
1. История открытия углекислого газа
Углекислый
газ был первым между всеми другими газами противопоставлен воздуху под
названием “дикого газа” алхимиком XVI в. Вант Гельмонтом. Открытием СО2
было положено начало новой отрасли химии – пневматохимии (химии газов).
Шотландский химик Джозеф Блэк (1728 – 1799 г.г.) в 1754 году установил,
что известковый минерал мрамор (карбонат кальция) при нагревании
разлагается с выделением газа и образует негашеную известь (оксид
кальция):
CaCO3 = CaO + CO2
карбонат кальция оксид кальция углекислый газ
Выделяющийся газ можно было вновь соединить с оксидом кальция и вновь получить карбонат кальция :
CaO + CO2 = CaCO3
оксид кальция углекислый газ карбонат кальция
Этот
газ был идентичен открытому Ван Гельмонтом “дикому газу”, но Блэк дал
ему новое название – “связанный воздух” – так как этот газ можно было
связать и вновь получить твердую субстанцию, а также он обладал
способностью притягиваться известковой водой (гидроксидом кальция) и
вызывать её помутнение:
CO2 + Ca(OH)2 = CaCO3 + H2O
углекислый газ гидроксид кальция карбонат кальция
Несколько лет спустя Кавендиш обнаружил еще два характерных физических свойства углекислого газа – его высокую плотность и значительную растворимость в воде.
Джозеф Пристли (1733—1804) Джозеф Пристли
— английский философ и химик. Открыл кислород, аммиак, сернистый газ.
Растворив в воде углекислый газ, впервые приготовил газированную воду.
Первым использовал в химии электрический ток. Ему принадлежит открытие
«метода исправления воздуха» — явление фотосинтеза. Считал, что ученый
должен давать свободу воображению и стремиться к сочетанию далеких друг
от друга идей.
2. Углекислый газ в природе
Содержание
углекислого газа в атмосфере относительно небольшое, всего 0,04–0,03%
(по объему). CO2, сосредоточенный в атмосфере, имеет массу 2200
биллионов тонн. В 60 раз больше углекислого газа содержится в
растворенном виде в морях и океанах. В течение каждого года из атмосферы
извлекается примерно 1/50 часть всего содержащегося в ней CO2
растительным покровом земного шара в процессе фотосинтеза, превращающего
минеральные вещества в органические.
Основная
масса углекислого газа в природе образуется в результате различных
процессов разложения органических веществ. Углекислый газ выделяется при
дыхании растений, животных, микроорганизмов. Непрерывно увеличивается
количество углекислого газа, выделяемого различными производствами.
Углекислый газ содержится в составе вулканических газов, выделяется он и
из земли в вулканических местностях. Несколько столетий функционирует в
качестве постоянно действующего генератора CO2 “Собачья пещера” вблизи
города Неаполя в Италии. Она знаменита тем, что собаки в ней не могут
находиться, а человек может там пребывать в нормальном состоянии. Дело в
том, что в этой пещере углекислый газ выделяется из земли, а так как он
в 1,5 раза тяжелее воздуха, то располагается внизу, примерно на высоте
роста собаки (0,5 м). В таком воздухе, где углекислого газа 14% , собаки
(и другие животные, разумеется) дышать не могут, но стоящий на ногах
взрослый человек не ощущает избытка углекислого газа в этой пещере.
Такие же пещеры существуют в Йеллоустонском национальном парке (США).
Природные
источники углекислого газа называются мофетами. Мофеты характерны для
последней, поздней стадии затухания вулканов в которой находится, в
частности, знаменитый вулкан Эльбрус. Поэтому там наблюдаются
многочисленные выходы пробивающихся сквозь снега и льды горячих
источников, насыщенных углекислым газом. Вне земного шара оксид углерода
(IV) обнаружен в атмосферах Марса и Венеры – планетах “земного типа”.
3. Практическое применение углекислого газа
Прессованный твердый углекислый газ получил название “сухого льда”.
Твердый
CO2 скорее похож на спрессованный плотный снег, по твердости
напоминающий мел. Температура “сухого льда” –78оС. Сухой лед, в отличие
от водяного льда, плотный. Он тонет в воде, резко охлаждая её. Горящий
бензин можно быстро потушить, бросив в пламя несколько кусочков сухого
льда.
Главное
применение сухого льда – хранение и перевозка продуктов питания: рыбы,
мяса, мороженого и др. Ценность сухого льда заключается не только в его
охлаждающем действии, но и в том, что продукты в углекислом газе не
плесневеют и не гниют.
Сухим
льдом испытывают в лабораториях детали, приборы, механизмы, которые
будут служить в условиях пониженных температур. С помощью сухого льда
испытывают морозоустойчивость резиновых покрышек автомобилей. Углекислый
газ применяют для газирования фруктовых и минеральных вод, а в медицине
– для углекислотных ванн. Жидкий углекислый газ используют в
углекислотных огнетушителях, огнетушительных системах самолетов и
кораблей и в пожарных углекислотных машинах. Он особенно эффективен в
тех случаях, когда вода непригодна, например, при тушении загоревшихся
огнеопасных жидкостей или при наличии в помещении невыключенной
электропроводки или уникального оборудования, которое от воды может
пострадать. Во многих случаях CO2 используют не в готовом виде, а
получают в процессе использования, например, хлебопекарных порошков,
содержащих смесь бикарбоната натрия с кислым виннокислым калием. При
смешивании таких порошков с тестом соли растворяются и возникает реакция
с выделением CO2 . В результате тесто всходит, наполняясь пузырьками
углекислого газа, и выпеченный из него продукт получается мягким и
вкусным.
