|  | Упражнение: 1  Дайте характеристику элементов: а) фосфора; б) калия. Дайте характеристику элементов: а) фосфора; б) калия.
|  а) а)
1. P — фосфор порядковый номер:
Z = N(p+) = N(e) = 15,
A = 31, N(n0) = A – Z = 31 – 15 = 16
Фосфор P находится в III периоде, V группе главной подгруппе. +15P 2e, 8e, 5e
2. P — неметалл
3. Неметаллические свойства N > P > As
4. Неметаллические свойства Si
5. Высший оксид P2O5 – кислотный
6.Высший гидроксид H4PO4 – кислотный
7.Летучее водородное соединение PH3 — фосфин
|  б) б)
1. K — калий порядковый номер:
Z = N(p+) = N(e) = 19,
A = 39, N(n0) = A – Z = 39 – 19 = 20
Калий K находится в IV периоде, I группе главной подгруппе. +19K 2e, 8e, 8e, 1e
2. K — металл
3. Металлические свойства Na
4. Металлические свойства K > Ca
5. Высший оксид K2O – основный
6.Высший гидроксид KOH – основный
7.Летучего водородного соединения нет.
| Упражнение: 2  Запишите уравнения химических реакций, характеризующие свойства: а) MgO и SO2; б)Mg(OH)2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме. Запишите уравнения химических реакций, характеризующие свойства: а) MgO и SO2; б)Mg(OH)2 и H2SO4. Уравнения реакций с участием электролитов запишите также в ионной форме.
| 
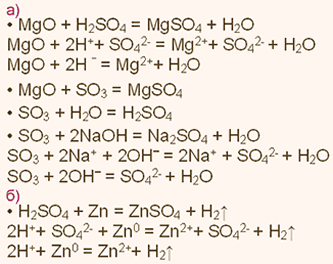
| 
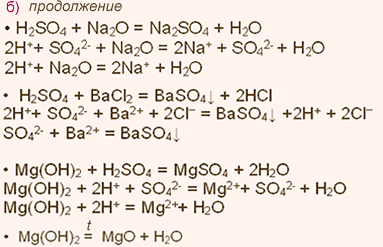
| Упражнение: 3  Дайте характеристику магния простого вещества. Какой тип связи наблюдается в нем? Запишите уравнения реакций магния со следующими веществами: а) кислородом; б) хлором4 в) серой; г) азотом N2; д) соляной кислотой. Дайте характеристику магния простого вещества. Какой тип связи наблюдается в нем? Запишите уравнения реакций магния со следующими веществами: а) кислородом; б) хлором4 в) серой; г) азотом N2; д) соляной кислотой.
| 
Для магния (Mg) простого вещества характерна металлическая кристаллическая решетка и металлическая химическая связь, а отсюда типичные для металлов свойства: металлический блеск, тепло- и электропроводность, пластичность.
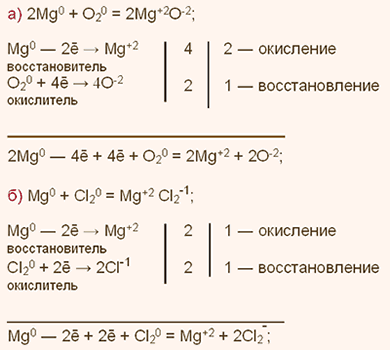
|  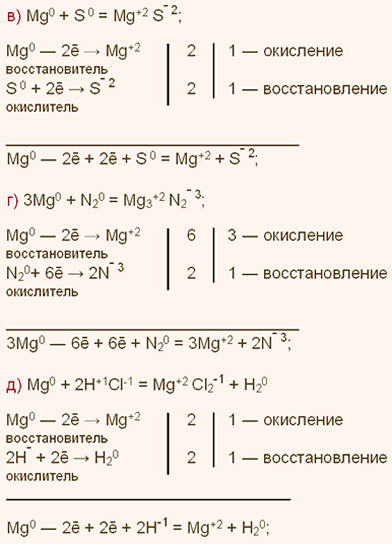
| Упражнение: 4  Что такое аллотропия? Какой тип химической связи реализуется в молекулах состава: а) S8; б) H2S? Какие физические свойства имеет наиболее устойчивая модификация серы – ромбическая сера? Запишите уравнения реакций серы со следующими веществами: а) натрием; б) кальцием; в) алюминием; г) кислородом; д) водородом; е) фтором F2. Что такое аллотропия? Какой тип химической связи реализуется в молекулах состава: а) S8; б) H2S? Какие физические свойства имеет наиболее устойчивая модификация серы – ромбическая сера? Запишите уравнения реакций серы со следующими веществами: а) натрием; б) кальцием; в) алюминием; г) кислородом; д) водородом; е) фтором F2.
Рассмотрите их с позиций процессов окисления-восстановления.
 Аллотропия – это способность атомов одного химического вещества образовывать несколько простых веществ, а эти простые вещества называют аллотропными модификациями. Аллотропия – это способность атомов одного химического вещества образовывать несколько простых веществ, а эти простые вещества называют аллотропными модификациями.
а) S8 – ковалентная неполярная
б) H2S – ковалентная полярная
S8 – ромбическая сера, молекулярная кристаллическая решетка. Лимонно-желтый цвет, Тпл. 112,80С, не растворима в воде, мало растворима в этиловом спирте, хорошо растворима в сероуглероде. Кристаллы серы в воде тонут, а порошок плавает на поверхности воды, так как мелкие кристаллики серы не смачиваются водой и поддерживаются на плаву мелкими пузырьками воздуха (процесс наз. флотация см. стр. 131 учебника) |  |  | | Упражнение: 5  Сравните свойства простого вещества кремния со свойствами простых веществ, образованных химическими элементами – соседями кремния по периоду. Сравните свойства простого вещества кремния со свойствами простых веществ, образованных химическими элементами – соседями кремния по периоду.

Неметаллические свойства Al
Неметаллические свойства кремния выражены сильнее, чем у алюминия, но слабее, чем у фосфора.
Потому что число внешних электронных оболочек у алюминия, кремния и фосфора одинаковое: 3, а число внешних электронов у кремния (4) меньше, чем у фосфора (5), но больше чем у алюминия (3).
| Упражнение: 6  У высшего оксида какого химического элемента наиболее выражены кислотные свойства: а) азота или фосфора, б) фосфора или серы? У высшего оксида какого химического элемента наиболее выражены кислотные свойства: а) азота или фосфора, б) фосфора или серы?

а) Кислотные свойства N2O5 > P2O5
б) Кислотные свойства P2O53
| Упражнение: 7  Вычислите объем воздуха (примите объемную долю кислорода в нем равной 0,2), который потребуется для сжигания 120 мг образца магния, содержащего 2% негорючих примесей. Вычислите объем воздуха (примите объемную долю кислорода в нем равной 0,2), который потребуется для сжигания 120 мг образца магния, содержащего 2% негорючих примесей.

Дано:
Mg, O2
mсмеси= 120 мг
ωпримеси = 0,02
ω(O2) = 0,2
Vвозд. =? | Решение:
m(Mg) = mсмеси • ω( Mg) = mсмеси • (1 — ωпримеси)
m(Mg) = 120 • (1 – 0,02) = 117,6 мг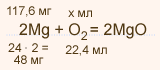
117,6 : 48 = х : 22,4; х = 54,88 мл. – объем кислорода В 100 л. воздуха содержится 20 л. O2
В х л. воздуха содержится 54,88 л O2 20 • х = 100 • 54,88 х = 274,4 мл. – объем воздуха
Ответ: Vвозд. = 274,4 мл. |
| Упражнение: 8  8. Вычислите объем оксида серы (IV) (н.у.), который может быть получен при сжигании 1,6 кг серы, если выход продукта составляет 80% от теоретически возможного. 8. Вычислите объем оксида серы (IV) (н.у.), который может быть получен при сжигании 1,6 кг серы, если выход продукта составляет 80% от теоретически возможного.

Дано:
S, O2, SO2
m(S) = 1,6 кг
W( SO2) = 0,8
V(SO2) =? | Решение:
M(S) = 32 кг / кмоль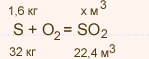
1,6 : 32 = х : 22,4; х = 1,12 м3 — это теоретический объем оксида серы
Найдем практический оъем оксида серы с помощью выхода продукта:
Vпракт. = W( SO2) • V теор.
Vпракт. = 0,8 •1,12 = 0,896 м3
Ответ: Vпракт.(SO2) = 0,896 м3 |
| Упражнение: 9  Можно ли утверждать, что высшему оксиду серы SO3 соответствует сернистая кислотаH2SO3? Почему? Можно ли утверждать, что высшему оксиду серы SO3 соответствует сернистая кислотаH2SO3? Почему?
 Нет оксиду серы(VI) — S+6O3, сответсвует серная кислота H2S+6O4. Нет оксиду серы(VI) — S+6O3, сответсвует серная кислота H2S+6O4.
Степень окисления серы в оксиде серы SO3: +6, а степень окисления серы в сернистой кислоте H2SO4: +4.
| Упражнение: 10  Используя метод электронного баланса, определите коэффициенты в схемах химических реакций: Используя метод электронного баланса, определите коэффициенты в схемах химических реакций:
а) Mg + CO2 → MgO + C
б) S + KCO3 → KCl + SO2.


|
|
|
|

