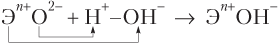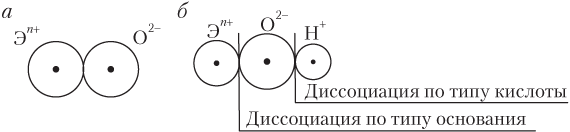У какого оксида наиболее выражены основные свойства
Характерные химические свойства: оксидов: основных, амфотерных, кислотных.
1. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) вода и соляная кислота
2) кислород и оксид магния
3) вода и медь
4) оксид кальция и гидроксид натрия
2. Оксид углерода (IV) реагирует с каждым из двух веществ:
1) гидроксидом натрия и оксидом кальция
2) оксидом кальция и оксидом серы (IV)
3) кислородом и водой
4) хлоридом натрия и оксидом азота (IV)
3. Оксид серы (IV) взаимодействует с
1) СО2 2) Н2О 3) Na2SO44) НС1
4. Диоксид углерода в водном растворе реагирует с каждым из двух веществ:
1) Н2О, КС1
2) Ba(OH)2,SiO2
3) K2SO4,BaCO3
4) СаСОз, КОН
5. Способны взаимодействовать между собой
1) SiO2 и Н2О
2) СО2 и H2SO4
3) CO2 и Са(ОН)2
4) Na2O и Са(ОН)2
6. Ни с водой, ни с раствором гидроксида натрия не реагирует
1) SiО2 2) SO3 3) ВаО 4) NО
7. Реагирует с соляной кислотой, но не с водой, оксид
1) SiО2 2) N2O3 3) Na2О 4) Fе20з
8. В уравнении реакции
X + 4НС1 = МnС12 + С12 + 2Н2О
веществом «X» является
1) оксид марганца (II)
2) оксид марганца (IV)
3) оксид марганца (VI)
4) оксид марганца (VII)
9. Между собой взаимодействуют
1) NO и А12Оз
2) СО и ВаО
3) Р2О5 и SCl4
4) ВаО и SO2
10.Между собой взаимодействуют
1) СuО и FeO
2) СО2 и ВаО
3) Р2О5 и NO
4) СгО3 и SO3
11. Реакция возможна между
1) Н2О и А12О3
2) СО и СаО
3) Р2О3 и SO2
4) Н2О и ВаО
12. И с раствором гидроксида натрия, и с соляной кислотой реагирует оксид
1) SiО2 2) AI2O3 3) СО2 4) MgO
13. Реакция возможна между
1) ВаО и NH3
2) А12О3 и Н2О
3) Р2О5 и НС1
4) MgO и SO3
14. Оксид натрия не взаимодействует с
1) Н2О 2) СО2 3) CaO 4) А12О3
15.Оксид углерода (IV) реагирует с каждым из двух веществ:
1) водой и оксидом кальция
2) кислородом и водой
3) сульфатом калия и гидроксидом натрия
4) оксидом кремния (IV) и водородом
16. Основные свойства наиболее выражены у оксида, формула которого
1) Fe2O3 2) FeO 3) Cr2O3 4) СгО3
17. Какие из двух оксидов могут взаимодействовать между собой?
1) СаО и СгО
2) СаО и NO
3) К2O и СО2
4) SiO2 и SO2
18. Реакция возможна между:
1) Н2О и ВаО
2) СО и СаО
3) Р2O3 и SO2
4) Н2О и А12О3
19. Верны ли следующие суждения о свойствах оксидов алюминия и хрома (III)?
А. Эти оксиды проявляют амфотерные свойства.
Б. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
20. Верны ли следующие суждения об оксидах цинка и алюминия?
А. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
Б. Эти оксиды взаимодействуют как с кислотами, так и со щелочами.
1) верно толь ко А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
21. Оксид фосфора (V) взаимодействует с каждым из двух веществ:
1) Fe и NaOH
2) NaOH и H2О
3) Н2О и НС1
4) Н2 и КС1
22. Оксид фосфора (V)
1) не проявляет кислотно-основных свойств
2) проявляет только основные свойства
3) проявляет только кислотные свойства
4) проявляет как основные, так и кислотные свойства
23. Оксид углерода (II) взаимодействует с каждым из двух веществ:
1) О3 и СuО
2) Н2О и SО2
3) H2SO4 и Na
4) NaOH и НС1
24. Верны ли следующие суждения об оксиде азота (V)?
А. При взаимодействии со щелочами оксид образует как кислые, так и средние соли.
Б. Растворяясь в воде, оксид дает сильную одноосновную кислоту.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
25. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) | вода и соляная кислота |
2) | кислород и оксид магния |
3) | оксид кальция и гидроксид натрия |
4) | вода и медь |
26. Окислительные свойства оксид серы (IV) проявляет в реакции
1) | SO2 + NaOH = NaHSO3 |
2) | SO2 + Br2 + 2H2O = H2SO4 + 2HBr |
3) | SO2 + 2H2S = 3S + 2H2O |
4) | 2SO2 + O2 = 2SO3 |
27. Оксид серы (IV) взаимодействует с
1) | KNО3 | 2) | H2O | 3) | Na2SO4 | 4) | НCl |
28. Между собой могут взаимодействовать
1) | SiO2 и H2O |
2) | CO2 и H2SO4 |
3) | CO2 и Сa(OH)2 |
4) | Na2O и Сa(OH)2 |
29. Оксид серы (IV) взаимодействует с каждым из двух веществ:
1) | H2O и KCl |
2) | Ba(OH)2 и CaO |
3) | CaCO3 и ZnSO3 |
4) | Ca(OH)2 и N2 |
30. Оксид серы (VI) взаимодействует с каждым из двух веществ:
1) | вода и соляная кислота |
2) | кислород и оксид магния |
3) | оксид кальция и гидроксид натрия |
4) | вода и медь |
Ответы: 1-4, 2-1, 3-2, 4-4, 5-3, 6-4, 7-4, 8-2, 9-4, 10-2, 11-4, 12-2, 13-4, 14-3, 15-1, 16-2, 17-3, 18-1, 19-1, 20-2, 21-2, 22-3, 23-1, 24-2, 25-1, 26-3, 27-2, 28-3, 29-2, 30-3.
Инструкция
— Выберите один из вариантов в каждом из 29 вопросов;
— Нажмите на кнопку «Показать результат»;
— Посмотрите на задание. Если ответ правильный, то цвет вопроса остался прежним. Если Вы ошиблись, то цвет вопроса изменился;
— За каждый правильный ответ начисляется 1 балл;
— Оценки: менее 14.5 баллов — НЕУДОВЛЕТВОРИТЕЛЬНО, от 14.5 но менее 21.75 — УДОВЛЕТВОРИТЕЛЬНО, 21.75 и менее 29 — ХОРОШО, 29 — ОТЛИЧНО;
— Чтобы сбросить результат тестирования, нажмите кнопку «Сбросить ответы».
Тест 10. Химические свойства оксидов
Оксид серы (VI) взаимодействует с каждым из двух веществ:
вода и соляная кислота
кислород и оксид магния
вода и медь
оксид кальция и гидроксид натрияОксид углерода (IV) реагирует с каждым из двух веществ:
гидроксидом натрия и оксидом кальция
оксидом кальция и оксидом серы (IV)
кислородом и водой
хлоридом натрия и оксидом азота (IV)Оксид серы (IV) взаимодействует с
СО2
Н2О
Na2SO4
НСlДиоксид углерода в водном растворе реагирует с каждым из двух веществ:
Н2О, КСl
СаСО3, КОН
Ba(OH)2, SiO2
K2SO4, BaCO3Способны взаимодействовать между собой
CO2 и Са(ОН)2
SiO2 и Н2О
СО2 и H2SO4
Na2O и Са(ОН)2Ни с водой, ни с раствором гидроксида натрия не реагирует
SiО2
SO3
NО
ВаОРеагирует с соляной кислотой, но не с водой, оксид
SiО2
N2O3
Na2О
Fе2О3В уравнении реакции X + 4НСl = МnСl2 + Сl2 + 2Н2О, веществом «X» является
оксид марганца (II)
оксид марганца (IV)
оксид марганца (VI)
оксид марганца (VII)Между собой взаимодействуют
NO и Аl2О3
СО и ВаО
Р2О5 и SCl4
ВаО и SO2Между собой взаимодействуют
СuО и FeO
СО2 и ВаО
Р2О5 и NO
СrО3 и SO3Реакция возможна между
Н2О и Аl2О3
СО и СаО
Р2О3 и SO2
Н2О и ВаОИ с раствором гидроксида натрия, и с соляной кислотой реагирует оксид
Al2O3
SiО2
СО2
MgOРеакция возможна между
ВаО и NH3
Аl2О3 и Н2О
MgO и SO3
Р2О5 и НСlОксид натрия не взаимодействует с
CaO
Н2О
СО2
Аl2О3Оксид углерода (IV) реагирует с каждым из двух веществ:
кислородом и водой
водой и оксидом кальция
сульфатом калия и гидроксидом натрия
оксидом кремния (IV) и водородомОсновные свойства наиболее выражены у оксида, формула которого
Fe2O3
FeO
Cr2O3
СrО3Какие из двух оксидов могут взаимодействовать между собой?
СаО и СrО
СаО и NO
К2O и СО2
SiO2 и SO2Верны ли следующие суждения о свойствах оксидов алюминия и хрома (III)?
А. Эти оксиды проявляют амфотерные свойства.
Б. В результате взаимодействия этих оксидов с водой получаются гидроксиды.верно только А
верно только Б
верны оба суждения
оба суждения неверныВерны ли следующие суждения об оксидах цинка и алюминия?
А. В результате взаимодействия этих оксидов с водой получаются гидроксиды.
Б. Эти оксиды взаимодействуют как с кислотами, так и со щелочами.верно только А
верно только Б
верны оба суждения
оба суждения неверныОксид фосфора (V) взаимодействует с каждым из двух веществ:
Fe и NaOH
NaOH и H2О
Н2О и НСl
Н2 и КСlОксид фосфора (V)
не проявляет кислотно-основных свойств
проявляет только основные свойства
проявляет только кислотные свойства
проявляет как основные, так и кислотные свойстваОксид углерода (II) взаимодействует с каждым из двух веществ:
О2 и СuО
Н2О и SО2
H2SO4 и Na
NaOH и НСlВерны ли следующие суждения об оксиде азота (V)?
А. При взаимодействии со щелочами оксид образует как кислые, так и средние соли.
Б. Растворяясь в воде, оксид дает сильную одноосновную кислоту.верно только А
верно только Б
верны оба суждения
оба суждения неверныОксид серы (VI) взаимодействует с каждым из двух веществ:
вода и соляная кислота
кислород и оксид магния
оксид кальция и гидроксид натрия
вода и медьОкислительные свойства оксид серы (IV) проявляет в реакции
SO2 + NaOH = NaHSO3
SO2 + Br2 + 2H2O = H2SO4 + 2HBr
SO2 + 2H2S = 3S + 2H2O
2SO2 + O2 = 2SO3Оксид серы (IV) взаимодействует с
KNО3
H2O
Na2SO4
НClМежду собой могут взаимодействовать
SiO2 и H2O
CO2 и H2SO4
CO2 и Сa(OH)2
Na2O и Сa(OH)2Оксид серы (IV) взаимодействует с каждым из двух веществ:
H2O и KCl
Ba(OH)2 и CaO
CaCO3 и ZnSO3
Ca(OH)2 и N2Оксид серы (VI) взаимодействует с каждым из двух веществ:
вода и соляная кислота
кислород и оксид магния
вода и медь
оксид кальция и гидроксид натрия
3. Периодический закон и периодическая система химических элементов
3.4. Периодическое изменение свойств веществ
Периодически изменяются следующие свойства простых и сложных веществ:
- строение простых веществ (вначале немолекулярное, например от Li к C, а затем молекулярное: N2 — Ne);
- температуры плавления и кипения простых веществ: при движении слева направо по периоду t
пл и t
кип вначале, в целом, возрастают (алмаз — самое тугоплавкое вещество), а затем уменьшаются, что связано с изменением строения простых веществ (см. выше); - металлические и неметаллические свойства простых веществ. По периоду с ростом Z способность атомов отдавать электрон уменьшается (Е
и растет), соответственно металлические свойства простых веществ ослабевают (неметаллические — усиливаются, поскольку увеличивается Е
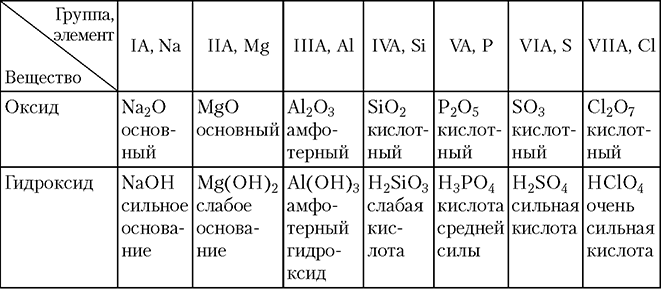
ср атомов). Сверху вниз по группам А, напротив, металлические свойства простых веществ усиливаются, а неметаллические — ослабевают; - состав и кислотно-основные свойства оксидов и гидроксидов (табл. 3.1–3.2).
Таблица 3.1
Состав высших оксидов и простейших водородных соединений элементов А-групп
| Группа | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
|---|---|---|---|---|---|---|---|
| Формула высшего оксида | Э2O | ЭO | Э2O3 | ЭO2 | Э2O5 | ЭO3 | Э2O7 |
| Формула простейшего водородного соединения | ЭH | ЭH2 | ЭH3 | ЭH4 | ЭH3 | ЭH2 (Н2Э) | ЭH (НЭ) |
Как видно из табл. 3.1, состав высших оксидов изменяется плавно в соответствии с постепенным возрастанием ковалентности (степени окисления) атома.
С ростом заряда ядра атома в периоде основные свойства оксидов и гидроксидов ослабевают, а кислотные — усиливаются. Переход от основных оксидов и гидроксидов к кислотным в каждом периоде происходит постепенно, через амфотерные оксиды и гидроксиды. В качестве примера в табл. 3.2 показано изменение свойств оксидов и гидроксидов элементов 3-го периода.
Таблица 3.2
Оксиды и гидроксиды, образованные элементами 3-го периода, и их классификация
В группах А с ростом заряда ядра атома происходит усиление основных свойств оксидов и гидроксидов. Например, для IIA-группы имеем:
1. BeO, Be(OH)2 — амфотерные (слабые основные и кислотные свойства).
2. MgO, Mg(OH)2 — слабые, основные свойства.
3. CaO, Ca(OH)2 — выраженные основные свойства (щелочи).
4. SrO, Sr(OH)2 — выраженные основные свойства (щелочи).
5. BaO, Ba(OH)2 — выраженные основные свойства (щелочи).
6. RaO, Ra(OH)2 — выраженные основные свойства (щелочи).
Такие же тенденции прослеживаются и для элементов других групп (состав и кислотно-основные свойства бинарных водородных соединений см. в табл. 3.1). В целом с ростом атомного номера по периоду основные свойства водородных соединений ослабевают, а кислотные свойства их растворов усиливаются: гидрид натрия растворяется в воде с образованием щелочи:
NaH + H2O = NaOH + H2,
а водные растворы H2S и HCl — кислоты, причем более сильной является хлороводородная кислота.
1. В группах А с ростом заряда ядра атома сила бескислородных кислот также возрастает.
2. В водородных соединениях число атомов водорода в молекуле (или формульной единице) сначала возрастает от 1 до 4 (группы IA–IVA), а затем уменьшается от 4 до 1 (группы IVA–VIIA).
3. Летучими (газообразными) при н.у. являются только водородные соединения элементов IVA–VIIA групп (кроме H2O и HF)
Описанные тенденции в изменении свойств атомов химических элементов и их соединений суммированы в табл. 3.3
Таблица 3.3
Изменение свойств атомов элементов и их соединений с ростом заряда ядра атома
| Свойства | Тенденция изменения | |
|---|---|---|
| в периодах | в группах А | |
| Радиус атома | Уменьшается | Растет |
| Энергия ионизации | Возрастает | Уменьшается |
| Сродство к электрону | Возрастает | Уменьшается |
| Восстановительные (металлические) свойства атомов | Ослабевают | Усиливаются |
| Окислительные (неметаллические) свойства атомов | Усиливаются | Ослабевают |
| Электроотрицательность | Возрастает | Уменьшается |
| Максимальная степень окисления | Возрастает | Постоянная |
| Кислотные свойства оксидов | Усиливаются | Ослабевают |
| Кислотные свойства гидроксидов | Усиливаются | Ослабевают |
| Кислотные свойства водородных соединений | Усиливаются | Усиливаются |
| Металлические свойства простых веществ | Ослабевают | Усиливаются |
| Неметаллические свойства простых веществ | Усиливаются | Ослабевают |
Пример 3.3.
Укажите формулу оксида с наиболее выраженными кислотными свойствами:
1) Br2O7;
2) SiO2;
3) Al2O3;
4) Cl2O7.
Решение. Кислотные свойства оксидов усиливаются слева направо по периоду, а сверху вниз по группе А ослабевают. С учетом этого приходим к выводу, что кислотные свойства наиболее выражены у оксида Cl2O7.
Ответ: 4).
Пример 3.4. Анион элемента Э2− имеет электронную конфигурацию атома аргона. Укажите формулу высшего оксида атома элемента:
1) ЭО3;
2) Э2О7;
3) Э2О5;
4) ЭО2.
Решение. Электронная конфигурация атома аргона 1s
22s
22p
63s
23p
6, следовательно электронная конфигурация атома Э (атом Э содержит на 2 электрона меньше, чем ион Э2−) – 1s
22s
22p
63s
23p
4, что отвечает атому серы. Элемент сера находится в VIA-группе, формула высшего оксида элементов этой группы ЭО3.
Ответ: 1).
Пример 3.5. Укажите символ элемента, атом которого имеет три электронных слоя и образует летучее (н.у.) соединение состава ЭН2(H2Э):
1) P;
2) Mg;
3) S;
4) Cl.
Решение. Водородные соединения состава ЭН2(H2Э) образуют атомы элементов IIA- и VIA-групп, однако летучими при н.у. являются соединения элементов VIA-группы, к числу которых относится сера.
Ответ: 3).
Охарактеризованные тенденции в изменении кислотно-основных свойств оксидов и гидроксидов можно понять на основании анализа следующих упрощенных схем строения оксидов и гидроксидов (рис. 3.1).
Из упрощенной схемы реакции
следует, что эффективность взаимодействия оксида с водой с образованием основания возрастает (согласно закону Кулона) с увеличением заряда на ионе Эn
+. Величина же этого заряда увеличивается по мере усиления металлических свойств элементов, т.е. справа налево по периоду и сверху вниз по группе. Именно в таком порядке увеличиваются и основные свойства элементов.
Рис. 3.1. Схема строения оксидов (а) и гидроксидов (б)
Рассмотрим причины, лежащие в основе описанных изменений кислотно-основных свойств гидроксидов.
При возрастании степени окисления элемента +n и уменьшении радиуса иона Эn
+ (это как раз и наблюдается с ростом заряда ядра атома элемента слева направо по периоду) связь Э–О упрочняется, а связь О–Н ослабевает; более вероятным становится процесс диссоциации гидроксида по кислотному типу.
Сверху вниз по группе радиус Эn
+ возрастает, а значение n+ не изменяется, в результате прочность связи Э–О уменьшается, облегчается ее разрыв и более вероятным становится процесс диссоциации гидроксида по основному типу.
Елена Казакова
Высший разум
(122036)
12 лет назад
CuO -основной,
Sn2О3 — амфотерный.
Остальное верно.
Отличить так.
Амфотерные оксиды – солеобразующие оксиды, проявляющие в зависимости от условий либо осно́вные, либо кислотные свойства (т. е. проявляющие амфотерность) . Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют валентность II,III,IV.
Желательно знать свойства гидроксидов, которые соответствуют этим оксидам.
Можно рассуждать по-разному. Если из трех нужно выбрать один, то лучше действовать методом исключения. Например: SO3 — кислотный оксид, так как ему соответствует серная кислота H2SO4. Кроме того, S — неметалл. Na2O — основный оксид, так как ему соответствует основание NaOH. Кроме того, Na — неметалл. А Al2O3 — амфотерный оксид, так как ему соотвествует амфотерный гидроксид Аl(OH)3. Кроме того, алюминий — переходный металл.
А можно знать самые распространенные кислотные, основные и амфотерные оксиды.
Примеры амфотерных оксидов:
Оксид цинка ZnO
Оксид хрома (III) Cr2O3
Оксид алюминия Al2O3
Оксид олова (II) SnO
Оксид олова (IV) SnO2
Оксид свинца (II) PbO
Оксид свинца (IV) PbO2
Оксид титана (IV) TiO2
Примеры основных оксидов
Оксид натрия Na2O;
Оксид кальция CaO;
Оксид магния MgO;
Оксид железа (III) Fe2O3;
Оксид хрома (II) CrO;
Оксид марганца (II) MnO;
Примеры кислотных оксидов
Оксид углерода (IV) CO2;
Оксид серы (IV) SO2;
Оксид серы (VI) SO3;
Оксид кремния (IV) SiO2;
Оксид фосфора (III) P2O3;
Оксид хрома (VI) CrO3;
Оксид марганца (VII) Mn2O7;
Еще добавлю, что кислотные оксиды — это оксиды неметаллов и металлов с валентностью VI и VII и VIII.
Еще можно определять какой это оксид, зная его свойства (с чем и как он реагирует) или свойства гидроксида, который ему соответствует.
Падла
Знаток
(376)
12 лет назад
Основные оксиды- эт те, в которых немтал+О
Амфотерные- амфотерный елемент+О
Амфотерный елемент- эт тот, который проявляет свойства металов и неметалов одновременно
~ psiXora ~
Гуру
(4534)
12 лет назад
Эт ты по валентности смотри. Валентность — по номеру группы атома элемента. Например, если вот такой вот Al2О3 — это амфотерный, потому что у аллюминия валентность три, а у кислорода — два.. . Вообщем, там много объяснять. Скажу только то, что у тебя не правильно CuO и Sn2O3, наоборот.
од
Знаток
(464)
3 года назад
Оксид меди (II) — не основный, а амфотерный, так как все оксиды переходных металлов (элементов побочной подгруппы Д. И. Менделеева) в степенях окисления +2, +3 и +4 проявляют амфотерные свойства. В случае же элементов главной подгруппы только в степенях окисления этих металлов +3 и +4. не путайтесь!
А так Елена во всем остальном (кроме того, что Натрий неметалл) все правильно расписала.
Роман ДубравцевПрофи (518)
10 месяцев назад
Не дезинформируйте. По вашей логике оксид серебра (II) тоже будет амфотерным, а это не так. Там амфотерность выражается лишь в реакции с аммиаком и то весьма слабо, прям еле-еле. Оксид меди (II) так же преобладает по основным свойствам, а кислотные свойства выражены крайне слабо. Поэтому эти два оксида принято считать основными.
Отвечаю про бериллий и цинк: они амфотерные, да.