У какого элемента выражены неметаллические свойства фосфор азот мышьяк
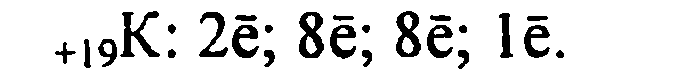
Голосование за лучший ответ
Людмила Лукьянова
Мастер
(1101)
11 лет назад
Азот имеет более выраженные неметаллические свойства (по сравнению с мышьяком) , т. к. радиус атома азота меньше, а количество электронов на внешнем слое у данных атомов одинаковое. Азот сильнее удерживает внешние (валентные) электроны.
глеб редько
Знаток
(426)
2 года назад
У какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее выражены свойства неметалла:
у мышьяка или азотаУ какого элемента сильнее
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
В результате успешного освоения материала этой главы студент должен:
знать
- • химические свойства азота, фосфора и их важнейших химических соединений (аммиака и его производных, оксидов азота и фосфора, азотистой, азотной, ортофосфорпой кислот и их солей);
- • азотные и фосфорные удобрения и экологические аспекты их применения;
уметь
- • составлять уравнения окислительно-восстановительных реакций с участием соединений азота;
- • вычислять массовую долю Р2О5 в соединениях и pH растворов аммиака, азотной и азотистой кислот;
владеть
• представлениями об особенностях химических связей азота с водородом, углеродом и кислородом, фосфора с кислородом, о термодинамической неустойчивости большинства соединений азота, о круговороте азота в природе, о конденсированных фосфорных кислотах и их солях, о фосфорноватистой и фосфористой кислотах и их солях, об особенностях азота и фосфора как биогенных элементов.
Общие свойства азота, фосфора и других элементов 15-й группы
Элементы 15-й группы: азот N, фосфор Р, мышьяк As, сурьма Sb и висмут Bi — сильнее различаются по свойствам, чем элементы других групп. Эти различия ярко проявляются в химических формах существования элементов 15-й группы, а также в типах и функциях образуемых ими биологически активных веществ (табл. 19.1).
Таблица 19.1
Распространенность и тины природных соединений элементов 15-й группы
Элемент | Кларк, % | Минералы | Биологически активные соединения и их важнейшие функции |
N | 110 2 | Натриевая селитра NaNC>3, калиевая селитра KNO3 | Белки, нуклеиновые кислоты. Все важнейшие биохимические функции клетки |
Р | 0,105 | Апатит Ca5(P04)3F | ДНК, РНК, мембранные фосфолипиды, АТФ, АДФ. Перенос и накопление химической энергии |
As | 1,7 Ю’4 | Арсекопирит FeAsS, реальгар AS4S4, аурипиг- мент AS2S3 | Очень токсичен |
Sb | 5 * 10-5 | Антимонит Sb2S3, самородная сурьма | Токсична |
Bi | 2 10 5 | Висмутин Bi2S3, самородный висмут | Токсичен |
Распространение в природе. Большая часть азота на Земле находится в свободном состоянии в виде двухатомных молекул N2в атмосфере. Массовая доля азота в воздухе составляет 75,6%, а объемная доля равна 78,09%. В воздухе содержатся также небольшие количества аммиака NH3, образующегося при гниении органических веществ, и кислородсодержащих соединений азота (оксидов и кислот), источниками которых служат грозы, извержения вулканов, деятельность почвенных микроорганизмов и человека. Промышленное значение имеют биогенные месторождения натриевой (чилийской) селитры NaN03 и калиевой (индийской) селитры KNO3, которые образовались в местностях с устойчивым сухим и жарким климатом. Азот содержится также в каменном угле (1,0—2,5%) и нефти (0,2—1,7%). Суммарное содержание всех химических форм азота в гидросфере составляет 5- 10-J моль/л. Массовая доля азота в живом веществе биосферы намного выше, чем в литосфере. Общее содержание азота в биомассе составляет примерно 10 млрд т.
Важнейший фосфорсодержащий минерал — апатит Са5(Р04)зХ. Чаще всего X = F, в этом случае минерал называют фторапатитом. Фторид-ионы могут замещаться также на С1″ (тогда минерал называется хлорапатит), ОН- (гидроксилапатит), СО2- (карбонатапатит) и О2- (оксиапатит). Апатиты — главная составная часть горных пород фосфоритов, которые служат сырьем для производства фосфорных удобрений. В живом веществе биосферы содержится 5-109 т фосфора.
Мышьяк, сурьма и висмут изредка встречаются в самородном состоянии, но главным образом в виде соединений, чаще всего сульфидов.
Свойства атомов. Сопоставление внутренних электронных остовов, валентных и вакантных подуровней показывает, что различия в физических и химических свойствах элементов обусловлены в основном особенностями строения электронных оболочек атомов (табл. 19.2). Атомы элементов этой подгруппы имеют совпадающие по строению валентные подуровни (ns2np3), различные электронные остовы и вакантные подуровни. Два электрона валентных s-подуровней спарены, три электрона /^-подуровней заселяют орбитали этих подуровней по одному. Электронная структура азота выделяется отсутствием вакантных подуровней, энергетически близких к наполовину заполненному 2/;-подуровню. У фосфора есть один вакантный ^-подуровень, а мышьяк, сурьма и висмут имеют несколько вакантных подуровней, близко расположенных к валентным подуровням.
Химические свойства. Азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют промежуточный между металлами и неметаллами характер, а у висмута преобладают металлические свойства.
Большие различия химии азота и фосфора определяются и отражаются приведенными ниже энергиями связей их атомов с атомами электроотрицательных элементов:
Связь N-H N—С N=C N—N N-O N=0 N-F
Энергия, кДж/моль 391 292 615 163 201 607 272
Связь Р-Н Р-С Р=С Р—N P-О Р=0 P-F
Энергия, кДж/моль 322 272 — — 415 584 490
Энергия a-связей азота с водородом и углеродом заметно выше, чем энергии ст-связей фосфора с теми же элементами. Отсюда естественно ожидать, что соединений со связями N—I I должно быть много, а соединений со связями Р—Н и Р—С сравнительно мало. Кроме одинарных a-связей азот образует более прочные связи N=C, N=N и N=N. Напротив, а-свя- зи азота с кислородом и фтором гораздо менее прочны, чем
Характеристики свойств элементов 15-й группы
Таблица 19.2
Свойства | N | Р | As | Sb | Bi |
Внутренние электронные остовы | [Не] | [Ne] | |Ar|3rf10 | [Kr]4«f10 | |Xe]4/Md10 |
Конфигурация валентных подуровней | 2s22p:> | 3s23p3 | As2 Ар3 | 5s25p3 | 6 s?6p3 |
Электроотрицательность | 3,04 | 2,19 | 2,18 | 2,05 | 2,02 |
Степени окисления | -3, -2, 0, +1, +2, +3, +4, +5 | -3,+1, +3,±5 | -3, +3, ±5 | -3, +3, ±5 | -3, +3, ±5 |
Ковалентный радиус, пм | 55 | 95 | 125 | 145 | 155 |
Радиус Ван-дер- Ваальса, пм | 150 | 190 | 200 | 220 | — |
Основные типы гибридизации | ч 2 sp, sp | sp3, sp3d, sp3d2 | |||
Основные геометрические формы соединений | Триго- нальная пирамида, тетраэдр, плоский треугольник | Тригональная пирамида с валентным углом -90°, тетраэдр, тригональная бипирамида, октаэдр | |||
Плотность, г/см3 | 1,025 10 3 (газ) |
| 5,72 | 6,69 | 9,79 |
Температура плавления,°С | -210 |
| 815 | 630 | 271 |
Температура кипения, °С | -195,8 |
|
| 1637 | 1560 |
связи Р—О и N=0. Двойные связи Р=0 и N=0 имеют приблизительно равные энергии, но связи азота с кислородом не придают соответствующим соединениям азота термодинамической устойчивости.
Благодаря высокой прочности связей фосфора с кислородом и галогенами широко распространены соответствующие неорганические и органические соединения этого элемента. В органических веществах, кроме того, большую роль играют связи Р—С.
Тест по химии. ЕГЭ. Неметаллы. Ответы.
Общая характеристика неметаллов главных подгрупп IV –
VII групп в связи с их положением в периодической системе химических элементов
Д.И. Менделеева и особенностями строения их атомов.
1. Верны ли
следующие суждения о неметаллах?
А. В
периодической системе химических элементов Д.И. Менделеева все неметаллы
располагаются в главных подгруппах. Б. Все неметаллы являются
р-элементами.
1) верно
только А
2) верно
только Б
3) верны оба
суждения
4) оба
суждения неверны
2. При
обычных условиях из двухатомных молекул состоят
1) гелий и
аргон
2) азот и
неон
3) сера и
фосфор
4) водород и
кислород
3. Верны ли
следующие суждения о неметаллах?
А. Все
неметаллы являются химически активными веществами. Б. Неметаллы обладают только
окислительными свойствами.
1) верно
только А
2) верно
только Б
3) верны оба
суждения
4) оба
суждения неверны
4. «Верны ли
следующие суждения о неметаллах?
А.
Неметаллы образуют с
щелочными металлами соединения
преимущественно с ионной связью.
Б.
Между собой неметаллы образуют соединения с ковалентной связью.
1) верно
только А
2) верно
только Б
3) верны оба
суждения
4) оба
суждения неверны
5. У атомов
химических элементов, расположенных в ряду: P-S-C1, увеличивается
1) радиус
2)
окислительная способность
3)
восстановительная способность
4) число
неспаренных электронов
6.
Соединения состава NaHЭO3 и NaHЭO4 может образовать
1)
углерод
2)
сера
3) хлор
4) фосфор
7. Наиболее
сильными кислотными свойствами обладает
1) НС1О4
2) H2SO3 3) Н3РО4 4) H2SiО3
8.
Соединения состава КЭО2 и КЭО3 образует элемент
1) азот
2) фосфор 3)
сера
4) марганец
9. Водород
проявляет окислительные свойства при реакции с
1) натрием
2) хлором 3)
азотом 4)
кислородом
10.
Способность атомов химических
элементов принимать электроны усиливается в ряду:
1)F —>O —>N
2) N —>F —>0
3) N —>O —>F
4) O —>N —>F
11. Степени
окисления хлора, брома и йода в высших оксидах и водородных соединениях
соответственно равны:
1)+1и-1
2)+7и-1
3)+7и-7 4)+5и-1
12. Сера
проявляет как окислительные, так и восстановительные свойства при
взаимодействии с
1)
водородом и железом
2)
углеродом и цинком
3)
хлором и фтором
4) натрием
и кислородом
13. В ряду:
Si —>Р —> S —> С1
электроотрицательность
элементов
1)
увеличивается
2)
уменьшается
3)
не изменяется
4) сначала
уменьшается, потом увеличивается
14. В ряду
элементов мышьяк —>селен —> бром возрастает
1)
атомный радиус
2)
число неспаренных электронов в атоме
3) число
электронных слоев в атоме
4) электроотрицательность
15.
Водородное соединение состава Н2Э2 образует
1)
углерод
2)
кремний
3)
бор
4) азот
16. Верны ли
следующие суждения о галогенах?
А. Наиболее
электроотрицательным среди галогенов является иод.
Б. Хлор
вытесняется бромом из хлорида алюминия.
1)
верно только А
2)
верно только Б
3)
верны оба суждения
4) оба
суждения неверны
17. Кислород
не реагирует с
1)
водой и оксидом кальция
2)
железом и оксидом фосфора (V)
3)
водородом и оксидом фосфора (III)
4) сероводородом
и оксидом углерода (IV)
18. Высшему
гидроксиду элемента VIIA группы соответствует формула
1) Н2ЭО3
2) Н2ЭО4 3) НЭО3 4) НЭО4
19. Верны ли
следующие суждения о галогенах?
А.
Фтор в соединениях проявляет
как положительную, так и
отрицательную
степень окисления.
Б. При
нормальных условиях бром и иод являются жидкостями.
1)
верно только А
2)
верно только Б
3)
верны оба суждения
4) оба
суждения неверны
20. Водород
проявляет окислительные свойства при взаимодействии с
1)
натрием
2)
хлором
3) азотом
4) кислородом
21.
Окислительные свойства фосфор проявляет при взаимодействии с
1)
кислородом
2)
магнием
3)
хлором
4) серой
22. Верны ли
следующие суждения о свойствах серы и хлора?
А.
Максимальная валентность серы и хлора в соединениях равна номеру группы.
Б. В
водородных соединениях серы и хлора связь ковалентная полярная.
1)
верно только А
2)
верно только Б
3)
верны оба суждения
4)
оба суждения неверны
23. Фосфор
проявляет окислительные свойства при реакции с
1)
кальцием 2)
серой
3}
хлором
4) кислородом
24. При
взаимодействии высшего оксида хлора с водой образуется кислота
1)
НС1O
2) НС1O2 3) НСlO3 4} HClO4
25. Характерными
степенями окисления хлора в его соединениях являются:
1)
-1, +1, +3, +5, +7
2)
— 2, +4, +6, +8
3)
-3, +3, +5
4)
-1, +2, +5
26. Оцените
справедливость суждений о неметаллах:
А. Атомы
неметалла могут участвовать в образовании как ионных,
так и
ковалентных связей.
Б.
Гидроксиды неметаллов имеют кислотный характер.
1) верно
только А
2) верно
только Б
3) верны оба
суждения
4) оба
суждения неверны
27. Оцените
справедливость суждений о неметаллах:
А. Чем
больше заряд ядра атома, тем сильнее выражены его
неметаллические
свойства.
Б. Чем
сильнее выражены неметаллические свойства элемента, тем
более
кислотный характер имеет его оксид.
1) верно
только А
2) верно
только Б
3) верны оба
суждения
4) оба
суждения неверны
28. Оцените
справедливость суждений о неметаллах:
А. В периоде
с увеличением зарядов атомных ядер происходит
усиление
неметаллических свойств элементов.
Б. В главной
подгруппе с увеличением зарядов атомных ядер
происходит
ослабление кислотных свойств гидроксидов.
1) верно
только А
2) верно
только Б
3) верны оба
суждения
4) оба
суждения неверны
29.
Кислотные свойства наиболее выражены у высшего гидроксида
1) азота
2) фосфора
3) мышьяка
4) сурьмы
30. Только
восстановительные свойства азот проявляет в соединении
1) N2
2) NНз
3) NО2
4) НNОз
Ответы:
1-1, 2-4,
3-4, 4-3, 5-2, 6-2, 7-1, 8-1, 9-1, 10-3, 11-2, 12-4, 13-1, 14-4, 15-1, 16-4,
17-1, 18-4, 19-4, 20-1, 21-2, 22-3, 23-1, 24-4, 25-1, 26-3, 27-2, 28-3, 29-1,
30-2.
