Сравните свойства фенола и бензола какой реакцией это можно подтвердить
Среди мыслительных приемов обучения химии важное место занимает сравнение. Процесс сравнения активизирует познавательную деятельность, развивает абстрактное мышление, сознательное и прочное усвоение знаний. Данный прием состоит из сопоставления, когда выделяются признаки, по которым проводится сравнение, и собственно сравнения, устанавливающего сходство и различие между объектами.
Предметы или явления можно сравнивать по одному или нескольким признакам. В процессе сравнения школьники изучают не только внешние признаки, но и свойства. Сравнение помогает проследить предметы и явления в изменении и развитии.
Сравнивая предметы и явления друг с другом, учащиеся выделяют частные и общие, существенные и несущественные признаки. На выделении общих и существенных признаков основано обобщение. Именно оно ведет к образованию понятий, к познанию закономерных связей и отношений.
Сравнение дает возможность определить новые стороны объектов, их связи, такие черты предметов и явлений, которые не воспринимаются при изучении их в отдельности. В процессе сравнения ученики проникают в сущность объектов, без посторонней помощи замечают неощутимые с первого взгляда свойства, постигают особенности явлений.
При сравнении объектов необходимо соблюдать следующие требования:
Для сравнения следует отбирать объекты, имеющие определенную связь между собой. Например, можно сравнивать строение и химические свойства бензола и фенола; бензола и анилина; бензола, фенола и анилина; строение и свойства водородных соединений в периоде (СН4, NH3, Н2О, НF) и в подгруппе (HF, НСl, НВr, НI).
Необходимо четко определять признаки (свойства) , по которым сравниваются объекты. Так, сравнивать физические свойства металлов можно по плотности, электрической проводимости, теплопроводности и т. п.
Перечень признаков должен быть по возможности более полным, исчерпывающим. Например, для сравнения пространственного строения молекул начальных представителей предельных, этиленовых, ацетиленовых и ароматических углеводородов выделяют совокупность признаков: тип гибридизации, валентный угол, межъядерное расстояние, форма молекул.
Успех учения во многом зависит от того, обладают ли ребята умением определять сходное и различное. Им обязательно нужно научиться замечать сходное там, где с внешней стороны явления сильно отличаются друг от друга, и находить различие в тех случаях, когда ярко внешнее сходство.
Парадоксально, но факт: школьники часто не могут изменить способ действия при выполнении заданий и все делают по шаблону, но в то же время не применяют усвоенные действия там, где это необходимо, потому что не умеют устанавливать сходство. Этим объясняется значительная часть ошибок, допускаемых при обучении химии. Например, ребята затрудняются ответить на вопрос, в чем сходство и различие реакций нейтрализации при взаимодействии растворимых и нерастворимых оснований с кислотами с точки зрения теории электролитической диссоциации, утверждая, что различия между ними не существует, т. к. в обоих случаях сущность реакций сводится к образованию слабодиссоциирующего вещества – воды. Однако составление уравнений таких реакций в сокращенной ионной форме помогает им установить и сходство, и различие.
Как предупредить подобные ошибки? Как можно их устранить, если они уже допущены? Практика показывает, что легче всего различаются противоположные явления. Психологические исследования доказывают, что противопоставление различных по содержанию понятий и правил предохраняет их в дальнейшем от смешения.
Использовать на занятиях противопоставление можно различными способами. В первом случае два понятия (или правила) подаются для сопоставления одновременно. Во втором – сначала изучается одно понятие, а затем после прочного его усвоения вводится второе – как противопоставление первому. Однако есть еще возможность после достаточно хорошего усвоения обоих понятий провести их сравнение. Какой из этих путей наиболее эффективен?
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Кислотные свойства
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода: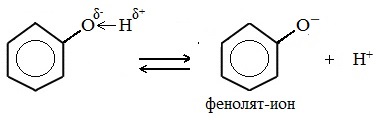
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.

1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
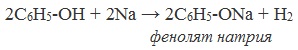
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
![]()
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:![]()
По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2- , Br- )
![]()
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
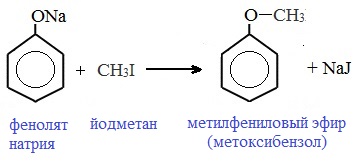
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот: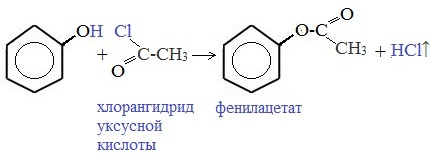
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II. Реакции, с участием бензольного кольца
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+М-эффект ОН-группы):
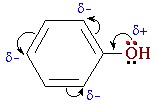
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
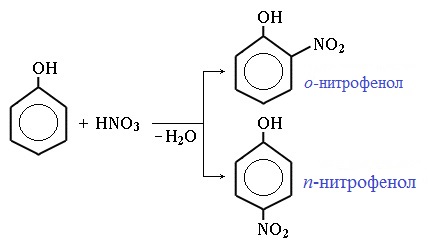
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):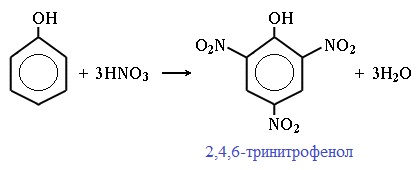
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.

2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол!):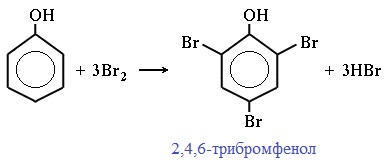
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: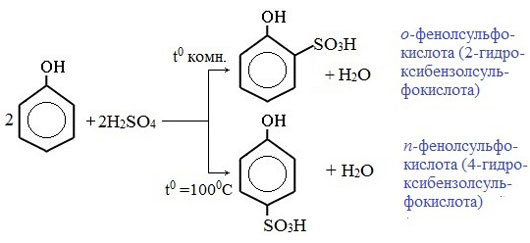 Реакции присоединения
Реакции присоединения
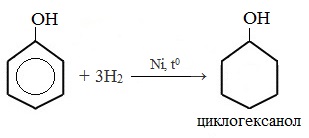
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
![]()
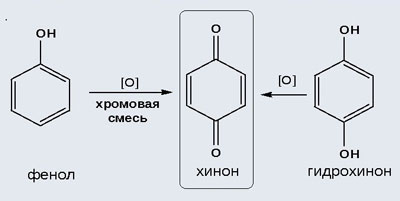
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
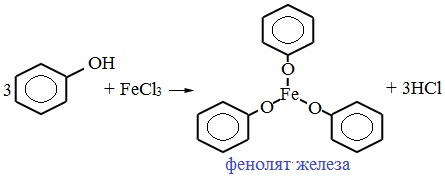
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:

Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Фенолы
- Главная
химия
Marinaa2
30 нояб. 2013 г., 23:18:58 (6 лет назад)
ЯнКаАа
01 дек. 2013 г., 1:43:15 (6 лет назад)
Химические свойства бензола:
1.реакция замещения водорода на другие атомы
а)галогенирование
б)нитрование
2.присоединение
а)гидрирование
б)галогенирование
3.бензол горит коптящим пламенем
Химические свойства фенола:
1.Слабые кислотные свойства фенола в реакциях с щелочами позволяют образовывать соли группы фенолят.
Ответить
Другие вопросы из категории
Vvvitya / 24 нояб. 2013 г., 14:12:19
Fe(OH)3 -> Fe2O3 + H2O
C2H2 + O2 -> CO2 + H2O
Fe(OH)3 + H2SO4 -> Fe2(SO4)3 + H2O
Mg + H3PO4 -> Mg3(PO4)2 + H2 ^
Al + H2SO4 -> Al2(SO4)3 + H2 ^
Cu2(OH)2CO3 -> CuO + CO2 + H2O
Читайте также
Mustab / 25 дек. 2014 г., 22:17:52
Помогите пожалуйста, очень нужно, не успеваю совсем:
1. типы химических связей: ионная, ковалентная (полярная и неполярная), металлическая. (Рассказать о них)
2. А)Соотношение типов химических связей м строения кристалических решеток. Б)реакции, характеризующие свойства оксида кальция.
3. Классификация простых веществ. Сравнение свойств простых веществ: металлов и неметаллов.
4. Классификация сложных веществ. Деление каждого класса сложных веществ на группы. Представители улассов и групп сложных веществ.
5. Явления физические и химические. Привкести примеры. Признаки и условия озникновения химических реакций.
6. Классификация химических реакций по различным поизнакам (агрегатному состоянию веществ, тепловому эффекту, использованию катализатора, направлению). Реакции соединения, разложения, замещения и обмена.
7. Основные классы неорганических соединений.
8. Кислоты, их классификация и общие химические свойства
9. Сравнить строение и свойства атомов натрия , хлора и аргона
10. Строение электронных оболочек атомов химических элементов 1-20. Завершенные и незавершенные энергетические уровни атомов химических элементов.
Lizabon / 25 янв. 2014 г., 3:27:57
Помогите пожалуйста с химией, не понимаю:с 8 класс
Только объясните.
Вообщем нужно найти объём (N2) если известно кол-во вещества: 2 моль, и Масса: 28 грамм. Как найти?
———————————————————————-
А вообще у нас вот такое задание: (если сможете, помогите):
Надо для данной учителем формулой вещества найти: кол-во вещества, объём, масса, число частиц.
(N2) — известно: кол-во вещества 2 моль, масса 28г.
(o2) — известно: масса 32г
(NO) — известно: масса 30г, объем 11,2л
(H2S) — известно: масса 34г, число частиц 18*10 в 23 степени
———————————————————————
Все что я сделала в этой таблице это нашла граммы, и то мне кажется не правильно.. А остальное все было сразу в таблице.
Помогите пожалуйста, и объясните, хочу именно понять.
АринаИсакова / 04 окт. 2014 г., 11:38:01
помогите пожалуйста очень нужно
1. в молекуле воды осуществляется связь:
а) полярная, одинарная
б) неполярная, тройная
в) полярная, двойная
г) неполярная, одинарная
2. Составьте электронную формулу молекулы хлора
3. В схеме химической реакции P+O2=P2O5 расставьте
коэффициенты; укажите окислитель и восстановитель, составьте схему перехода
электронов.
4. Укажите типы химических связей в предложенных веществах KBr, Br2 ,Na.
Составьте схему образования связи для веществ с ковалентной
полярной связью.
5. Может ли происходить превращение Mg=MgO при действие
восстановителя? Ответ обоснуйте. Составьте уравнение
окислительно-восстановительной реакции, соответствующее данной схеме.
Помогите пожалуйста….*)
Marika19991 / 07 дек. 2013 г., 22:38:11
Помогите пожалуйста!!!
Составьте уравнения реакций серной кислоты: а) с гидроксидом бария, б) с гидроксидом алюминия.
Очень нужно, помогите пожалуйста!
Вы находитесь на странице вопроса «Помогите пожалуйста с заданием. Нужно сравнить химические свойства бензола и фенола,в чем сходства и различия«, категории «химия«. Данный вопрос относится к разделу «5-9» классов. Здесь вы сможете получить ответ, а также обсудить вопрос с посетителями сайта. Автоматический умный поиск поможет найти похожие вопросы в категории «химия«. Если ваш вопрос отличается или ответы не подходят, вы можете задать новый вопрос, воспользовавшись кнопкой в верхней части сайта.
Данная статья может быть интересна в первую очередь ученикам 10-11 классов, которые на данный момент проходят курс органической химии или готовятся к сдачи ЕГЭ. Однако, она может заинтересовать и тех, кто уже во взрослой жизни решил вспомнить курс школьной химии и сравнить, насколько сильно усложнилась программа школы за определенное количество лет. Итак, тема нашей сегодняшней статьи, фенолы.
Что же это соединения?
Фенолы – это органические вещества, в молекулах которых радикал фенил связан с одной или несколькими гидроксильными группами (-OH).
Например:
Не следует путать фенолы с ароматическими спиртами, у которых гидроксильная группа (-OH) находится в боковой цепи:
Простейший представитель и родоначальник данного класса органических соединений, имеющий формулу C6H5OH, носит имя всего класса веществ – фенол.
Фенол представляет собой белые игольчатые кристаллы с характерным запахом, быстро розовеющие на воздухе в результате окисления. Данное вещество плохо растворимо в холодной воде, но почти неограниченно растворимо в горячей. Исторически сложившееся название этого вещества – карболовая кислота. Это подтверждает лакмусовая бумажка, которая в растворе фенола окрашивается в красный цвет (показывая кислотную среду раствора).
Особенности строения молекулы фенола.
Свойства фенола обусловлены сочетанием двух участков в составе его молекулы- это ароматический углеводородный радикал фенил и гидроксогруппа (-OH).
Важно отметить, что влияние фенила на гидроксил заключается в том, что он еще более поляризует ковалентную связь между атомами кислорода и водорода в гидроксиле. Атом водорода при этом становится более подвижным по сравнению со спиртами, что обуславливает кислотные свойства фенола.
Таким образом, фенол способен диссоциировать как кислота, но слабо и обратимо:
Способы получения фенолов.
1. Получение фенолов из каменного угля. Это важнейший промышленный способ получения фенолов.
2. Синтез из бензола, через промежуточный продукт хлорбензол:
C6H6 + Cl2 → C6H5Cl + HCl
C6H5Cl+NaOH → C6H5OH + NaCl
3. Феноляты можно получить, сплавлением солей сульфокислот со щелочами:
C6H5-SO3Na + 2NaOH → C6H5ONa + Na2SO3 + H2O
4. Гомологи фенола получают путем его алкилирования:
Химические свойства фенола.
1. Взаимодействие с металлами.
Как кислота, фенол способен взаимодействовать с некоторыми металлами. Однако, в связи с тем, что его кислотные свойства проявлены очень слабо, список металлов с которыми он может реагировать сводится только к щелочным и щелочноземельным (например Li, Na, K, Ca, Sr, Ba).
2. Взаимодействие со щелочами.
Как кислота, фенол может взаимодействовать так же и со щелочами, выдавая все те же соли феноляты.
3. Фенол легко можно вытеснить из его солей кислотами.
Более сильная кислота может замещать более слабую кислоту, поэтому фенол можно вытеснить из его солей даже угольной кислотой.
4. Соли фенола (феноляты) можно алкилировать до простых эфиров.
5. Феноляты можно ацилировать до сложных эфиров.
Ацилирование — введение ацильного остатка RCO- (ацила) в состав органического соединения, обычно, путём замещения атома водорода, введение остатка уксусной кислоты CH3CO— называют ацетилированием, бензойной C6H5CO- — бензоилированием, муравьиной HCO- — формилированием.
6. Как видно из приведенного выше определения, сложный эфир можно получить и при взаимодействие фенола с уже знакомым нам соединением (хлорангидридом карбоновой кислоты).
Хлорангидрид карбоновой кислоты — это производное карбоновой кислоты, в которой гидроксильная группа -OH в карбоксильной группе -COOH заменена на атом хлора.
Из неорганических аналогов можно вспомнить фосген:
Он является хлорангидридом угольной кислоты, применяется как отравляющее вещество и может быть получен при взаимодействие угарного газа с хлором, на свету или при нагревание:
CO + Cl2 = COCl2
7. Алкилирование фенола алкенами.
Реакция протекает по следующему механизму:
8. Нитрирование фенола.
В зависимости от условий реакции могут быть получены разные продукты:
Либо:
9. Сульфирование фенола (взаимодействие с серной кислотой).
10. Галогенирование.
Рассмотрим на примере бромирования, так как эта реакция является качественной и сопровождается выпадением белого осадка.
11. Взаимодействие фенола с хлоридом железа III (FeCl3).
Это так же качественная реакция, сопровождающаяся фиолетовым окрашиванием, даже если раствор содержит очень незначительное количество фенола.
12. Фенол способен вступать в реакцию поликонденсации с формальдегидом, в результате чего получается фенолформальдегидная смола.
13. Гидрирование фенола (взаимодействие с водородом).
14. Горение.
Самое очевидное свойство. Уравнение реакции горения фенола следующее:
C6Н5ОН +7О2 = 6CO2+3H2O
Применение фенолов:
1. В качестве дезинфицирующих средств.
2. Как сырье при производстве красителей
3. В производстве фенолоформальдегидных пластмасс.
4. При производстве многих лекарственных средств (салициловой и ацетилсалициловой кислоты, парацетамола и пр..)
5. Гидрохинон используется в фотографии.
Интересно:
Фенолформальдегидную смолу широко используют для производства древесностружечных плит (ДСП). Мебель изготовленная из ДСП, выделяет в атмосферу квартир и домов немалое количество фенола, который очень вреден для здоровья, поэтому комнаты с такой мебелью надо проветривать, а лучше – дать отстояться новой мебели в нежилом помещение с открытым окном.
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов

Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам.
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.

Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты:

В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.

Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
- фенол не реагирует с галогеноводородами: ОН- группа очень прочно связана с бензольным кольцом, её нельзя заместить;
- фенол не вступает в реакцию этерификации, эфиры фенола получают косвенным путем;
- фенол не вступает в реакции дегидратации.
- фенол обладает более сильными кислотными свойствами и вступает в реакцию со щелочами.
1. Кислотные свойства фенолов
Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия

Видеоопыт взаимодействия фенола с гидроксидом натрия можно посмотреть здесь.
Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:

1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода.

Видеоопыт взаимодействия фенола с натрием можно посмотреть здесь.
2. Реакции фенола по бензольному кольцу
Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце.
2.1. Галогенирование
Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол).
Видеоопыт взаимодействия фенола с бромом можно посмотреть здесь.
2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
Видеоопыт взаимодействия фенола с хлоридом железа (III) можно посмотреть здесь.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.

1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.

При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.

2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:

Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:

Суммарное уравнение реакции:

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:

Получается фенолят натрия, из которого затем выделяют фенол:
