С какими веществами кислород проявляет окислительные свойства
Кислород (лат. Oxygenium) — элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает
группу халькогенов — элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po — халькогены. Халькогены (греч. χαλκος — руда + γενος —
рождающий) — входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Среди элементов VIa группы O, S, Se — неметаллы. Te, Po — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np4:
- O — 2s22p4
- S — 3s23p4
- Se — 4s24p4
- Te — 5s25p4
- Po — 6s26p4
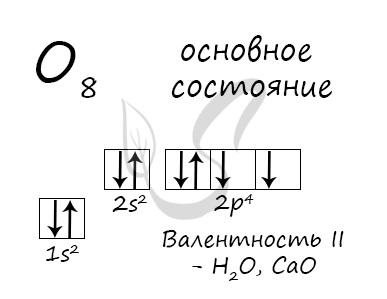
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более
высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.
Природные соединения
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых
устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция
каталитического разложения пероксида водорода.
KMnO4 → K2MnO4 + MnO2 + O2↑
KClO3 → KCl + O2↑
H2O2 → (кат. — MnO2) H2O + O2
На подводных лодках для получения кислорода применяют следующую реакцию:
Na2O2 + CO2 → Na2CO3 + O2↑

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции
с кислородом экзотермичны (горение), ускоряются при повышении температуры.
- Реакции с неметаллами
- Реакции с металлами
- Горение воды
- Окисление органических веществ
- Контролируемое окисление
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
NO + O2 → (t) NO2
S + O2 → (t) SO2
2C + O2 = (t) 2CO (неполное окисление — угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O+2)
В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Li + O2 → Li2O (оксид)
Na + O2 → Na2O2 (пероксид)
K + O2 → KO2 (супероксид)
Известна реакция горения воды во фторе.
F2 + H2O → HF + O2

Все органические вещества сгорают с образованием углекислого газа и воды.
C3H7 + O2 = CO2 + H2O

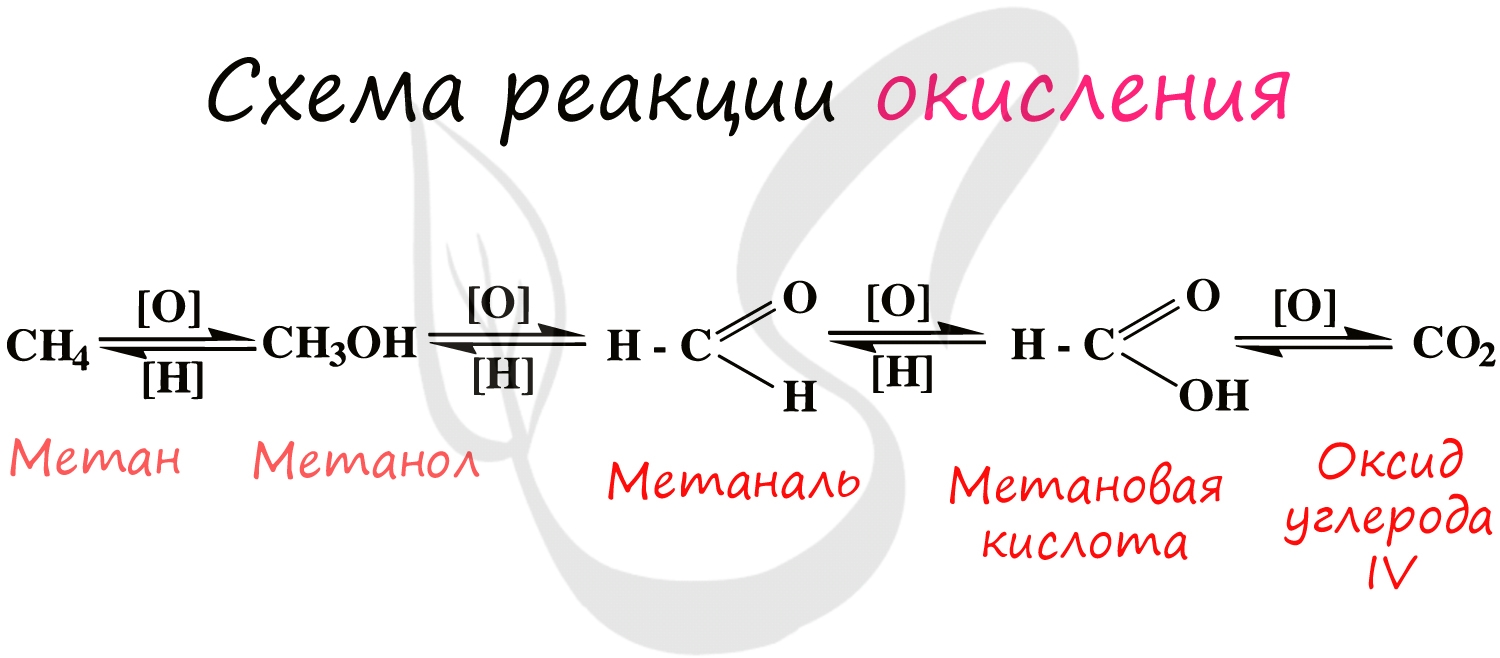
При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются
до спиртов, спирты — до альдегидов, альдегиды — до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства кислорода
Химический элемент кислород может существовать в виде двух аллотропных модификаций, т.е. образует два простых вещества. Оба этих вещества имеют молекулярное строение. Одно из них имеет формулу O2 и имеет название кислород, т.е. такое же, как и название химического элемента, которым оно образовано.
Другое простое вещество, образованное кислородом, называется озон. Озон в отличие от кислорода состоит из трехатомных молекул, т.е. имеет формулу O3.
Поскольку основной и наиболее распространенной формой кислорода является молекулярный кислород O2, прежде всего мы рассмотрим именно его химические свойства.
Химический элемент кислород находится на втором месте по значению электроотрицательности среди всех элементов и уступает лишь фтору. В связи с этим логично предположить высокую активность кислорода и наличие у него практически только окислительных свойств. Действительно, список простых и сложных веществ, с которыми может реагировать кислород огромен. Однако, следует отметить, что поскольку в молекуле кислорода имеет место прочная двойная связь, для осуществления большинства реакций с кислородом требуется прибегать к нагреванию. Чаще всего сильный нагрев требуется в самом начале реакции (поджиг) после чего многие реакции идут далее уже самостоятельно без подвода тепла извне.
Среди простых веществ не окисляются кислородом лишь благородные металлы (Ag, Pt, Au), галогены и инертные газы.
Сера сгорает в кислороде с образованием диоксида серы:
Фосфор в зависимости от избытка или недостатка кислорода может образовать как оксида фосфора (V), так и оксид фосфора (III):
Взаимодействие кислорода с азотом протекает в крайне жестких условиях, в виду того что энергии связи в молекулах кислорода и особенно азота очень велики. Также свой вклад в сложность протекания реакции делает высокая электроотрицательность обоих элементов. Реакция начинается лишь при температуре более 2000 oC и является обратимой:
Не все простые вещества, реагируя с кислородом образуют оксиды. Так, например, натрий, сгорая в кислороде образует пероксид:
а калий – надпероксид:
Чаще всего, при сгорании в кислороде сложных веществ образуется смесь оксидов элементов, которыми было образовано исходное вещество. Так, например:
Однако, при сгорании в кислороде азотсодержащих органических веществ вместо оксида азота образуется молекулярный азот N2. Например:
При сгорании в кислороде хлорпроизводных вместо оксидов хлора образуется хлороводород:
Химические свойства озона:
Озон является более сильным окислителем, чем кислород. Обусловлено это тем, что одна из кислород-кислородных связей в молекуле озона легко рвется и в результате образуется чрезвычайно активный атомарный кислород. Озон в отличие от кислорода не требует для проявления своих высоких окислительных свойств нагревания. Он проявляет свою активность при обычной и даже низкой температурах:
PbS + 4O3 = PbSO4 + 4O2
Как было сказано выше, серебро с кислородом не реагирует, однако, реагирует с озоном:
2Ag + O3 = Ag2O + O2
Качественной реакцией на наличие озона является то, что при пропускании исследуемого газа через раствор иодида калия наблюдается образование йода:
2KI + O3 + H2O = I2↓ + O2 + 2KOH
Химические свойства серы
Сера как химический элемент может существовать в нескольких аллотропных модификациях. Различают ромбическую, моноклинную и пластическую серу. Моноклинная сера может быть получена при медленном охлаждении расплава ромбической серы , а пластическая напротив получается при резком охлаждении расплава серы, предварительно доведенного до кипения. Пластическая сера обладает редким для неорганических веществ свойством эластичности – она способна обратимо растягиваться под действием внешнего усилия, возвращаясь в исходную форму при прекращении этого воздействия. Наиболее устойчива в обычных условиях ромбическая сера и все иные аллотропные модификации со временем переходят в нее.
Молекулы ромбической серы состоят из восьми атомов, т.е. ее формулу можно записать как S8. Однако, поскольку химические свойства всех модификаций достаточно схожи, чтобы не затруднять запись уравнений реакций любую серу обозначают просто символом S.
Сера может взаимодействовать и с простыми и со сложными веществами. В химических реакциях проявлет как окислительные, так и восстановительные свойства.
Окислительные свойства серы проявляются при ее взаимодействии с металлами, а также неметаллами, образованными атомами менее электроотрицательного элемента (водород, углерод, фосфор):
Как восстановитель сера выступает при взаимодействии с неметаллами, образованными более электроотрицательными элементами (кислород, галогены), а также сложными веществами с ярко выраженной окислительной функцией, например, серной и азотной концентрированной кислотами:
Также сера взаимодействует при кипячении с концентрированными водными растворами щелочей. Взаимодействие протекает по типу диспропорционирования, т.е. сера одновременно и понижает, и повышает свою степень окисления:
СТРОЕНИЕ кислорода
Кислород — наиболее распространенный в природе элемент, его содержание в атмосфере Земли составляет 21% (по объему), в земной коре в виде соединений его содержится около 50% (по массе) и в гидросфере — 88,8% (по массе). Кислород необходим для существования жизни на земле: животные и растения потребляют кислород в процессе дыхания, а растения выделяют кислород в процессе фотосинтеза. Живая материя содержит связанный кислород не только в составе жидкостей организма (в клетках крови и др.), но и в составе углеводов (сахар, целлюлоза, крахмал, гликоген), а также жиров и белков. Почва, глины, песок, горные породы состоят из силикатов и других кислородсодержащих неорганических соединений, таких, как оксиды, гидроксиды, карбонаты, сульфаты и нитраты.
Любой природный атом кислорода содержит 8 протонов в ядре, но число нейтронов может быть разным и равно 8, 9 или 10, поэтому кислород образует три соответствующих изотопа. Наиболее распространенный из трех изотопов кислорода (99,76%) — это $^{16}_8O$ (8 протонов и 8 нейтронов).
Итак, в атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов — на внешнем. Поэтому в химических реакциях кислород может принимать от доноров до двух электронов, достраивая свою внешнюю оболочку до 8 электронов и образуя избыточный отрицательный заряд. Характерная степень окисления кислорода в соединениях с другими элементами равна -2.
Кислород образует двухатомную молекулу, при образовании которой выделяется много энергии (490 кДж/моль) и соответственно столько же энергии необходимо затратить для разрушения двойной связи в молекуле.
Прочность связи O=O настолько высока, что при $2300^0C$ С только 1% молекул кислорода диссоциирует на атомы. С увеличением кратности связи ее прочность увеличивается. Так, при образовании молекулы азота $N_2$ прочность тройной связи N≡N составляет 710 кДж/моль.,
СВОЙСТВА кислорода
Молекулярный кислород реагирует практически со всеми простыми веществами (металлами и неметаллами), кроме благородных газов и является сильным окислителем. Однако при комнатных условиях только наиболее активные элементы реагируют с кислородом достаточно быстро. Наиболее активно реагируют с кислородом щелочные (Li, Na, K) и щелочноземельные (Ca, Sr, Ba) металлы с образованием пероксидов:
$2Na +O_2 longrightarrow Na2O2$
$Ba +O_2 longrightarrow BaO_2$
Остальные металлы и неметаллы реагируют с кислородом при нагревании с образованием соответствующих оксидов, например:
$S+ O_2 longrightarrow SO_2$
,
$2Cu+O_2 longrightarrow 2CuO$
Именно благодаря способности кислорода вступать в реакции окисления, большинство металлов встречается в природе в виде оксидов (руды).


ПРИМЕНЕНИЕ И ПОЛУЧЕНИЕ
Кислород хранят в танках и баллонах. Он используется в больших количествах как окислитель керосина и других горючих в ракетах и космических аппаратах. Сталелитейная промышленность потребляет газообразный кислород для продувки через расплав чугуна по методу Бессемера для быстрого и эффективного удаления примесей C, S и P. Сталь при кислородном дутье получается быстрее и качественнее, чем при воздушном. Кислород используется также для сварки и резки металлов (кислородно-ацетиленовое пламя). Применяют кислород и в медицине, например, для обогащения дыхательной среды пациентов с затрудненном дыханием.
Кислород можно получать различными химическими методами, некоторые из которых применяют для получения малых количеств чистого кислорода в лабораторной практике.
1. Наиболее эффективным промышленным методом получения кислорода является сжижение воздуха, из которого удаляют примеси, $CO_2$, пыль и т.д. химическими и физическими методами. Циклический процесс включает сжатие, охлаждение и расширение, что и приводит к сжижению воздуха. При медленном подъеме температуры (метод фракционной дистилляции) из жидкого воздуха испаряются сначала благородные газы (наиболее трудно сжижаемые), затем азот и остается жидкий кислород.
2. Одним из методов получения кислорода является электролиз воды, содержащей небольшие добавки NaOH или $H_2SO_4$ в качестве катализатора:
$2H_2O$ (г) $xrightarrow{cur} 2H_2 + O_2$
.
3. Важным лабораторным методом получения кислорода, является термический метод, предложенный Дж.Пристли, который заключается в термическом разложении оксидов тяжелых металлов, например оксида ртути:
$2HgO$ (r)$longrightarrow 2Hg + O_2$
.
4. Наиболее часто в лаборатории получают кислород разложением при нагревании таких веществ, в состав которых кислород входит в связанном виде, например перманганата калия (марганцовка), хлората калия (бертолетова соль), нитрата калия (селитра):
$2KMnO_4 longrightarrow K_2MnO_4 + MnO_2 +O_2$
.
Данная реакция является окислительно-восстановительной и относится к реакциям диспропорционирования.
$2KClO_3 longrightarrow 2KCl + 3O_2$
$2KNO_3 longrightarrow 2KNO_2 +O_2$
5. Кислород можно также получать разложением перекиси водорода:
$2H_2O_2 longrightarrow H_2O + O_2$
Раствор перекиси водорода применяется как дезинфицирующее средство при обработке царапин и мелких ран. Он мало устойчив и уже при стоянии медленно разлагается на кислород и воду. Выделяющийся атомарный кислород является очень сильным окислителем, поэтому убивает бактерии.
Общая характеристика неметаллов
Строение атомов неметаллов
большое число электронов на внешнем слое;
маленький атомный радиус (Ra)
Строение атомов неметаллов:
Правило:
Чем
меньше радиус атома неметалла и чем больше электронов на внешнем
электронном слое атома, тем сильнее выражены у неметалла окислительные
свойства и слабее — восстановительные.
???
1. Где в периодической системе располагаются неметаллы?
2. У какого неметалла самое большое значение электроотрицательности?
3. Какой неметалл обладает более окислительными свойствами: а) азот или фосфор; б) сера или хлор; в) теллур или йод?
Простые вещества — неметаллы
Простые вещества — неметаллы имеют молекулярную и атомную кристаллическую решетки.
Молекулярная кристаллическая решетка | Атомная кристаллическая решетка |
1) Инертные газы состоят из одноатомных молекул — He, Ne, Ar, Kr, Xe, Rn. | У ряда неметаллов все атомы связаны между собой ковалентными связями, образуя гигантские полимеры: (С)n, (Si)n, (B)n. |
По агрегатному состоянию вещества с молекулярной кристаллической решеткой (при н.у.) — газы (He, Ne, Ar, Kr, Xe, Rn, H2, O2, N2, F2, Cl2, O3), жидкости (бром Br2) или легкоплавкие летучие твердые вещества (белый фосфор P4, ромбическая сера S8, иод I2). | Вещества с атомной кристаллической решеткой твердые, тугоплавкие. |
Все | |
Аллотропия — явление существования химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам.
Простые вещества, образованные одним и тем же химическим элементом, называются аллотропными модификациями.
??? 4. Выберите вещества с молекулярной кристаллической решеткой: С, S, N2, B, Br2.
5. О каком веществе идет речь: Цвет
кристаллов разнообразный (обычно бесцветные или желтоватые, но известны
также голубые, зеленые, ярко-желтые, розово-лиловые, дымчато-вишневые,
красные кристаллы; встречаются и черные). Обладает очень большой
твердостью. Порошок его белый или бесцветный. Плотность вещества – 3,5.
Диэлектрик. Из какого химического элемента состоит вещество? Какие аллотропные модификации этого элемента вы еще знаете?
6. Почему кислород О2 и озон O3 обладают различными свойствами, несмотря на то, что они образованы одним химическим элементом?
Химические свойства неметаллов
Ряд электроотрицательности:
F, O, N, Cl, Br, I, S, C, Se, P, H, B, Si, Al, Mg, Ca, Li, Na…
——————————————————————>
электроотрицательность уменьшается
Окислительные свойства неметаллов | Восстановительные свойства неметаллов (кроме фтора) |
1. С металлами Cl2 + 2Na = 2NaCl | 1. С неметаллами |
2. С неметаллами Окислительные свойства проявляются в реакции с неметаллами, имеющими меньшую электроотрицательность. 5Cl2 + 2P = 2PCl5 | 2. С оксидами металлов |
3. С солями Cl2 + 2NaI = 2NaCl + I2 | 3. С кислотами |
4. С оксидами неметаллов Cl2 + CO = COCl2 |
Вывод: Чем больше электроотрицательность элемента, тем более окислительные свойства проявляет элемент.
???
7. С какими веществами кислород проявляет окислительные свойства: углерод, фосфор, фтор, азот?
8. С какими веществами углерод проявляет восстановительные свойства: оксид железа (III), кислород, кремний, кальций?
9. С какими веществами сера проявляет окислительные свойства: углерод, кислород, фтор, натрий?
Ответы на вопросы и задания, которые вы встретили в конспекте, вы можете отправить в отдельное задание.

