С какими именно химическими свойствами

Объектом химии считается вещество и влияние на него звуковых и магнитных полей. Само понятие имеет массу и бывает в трёх агрегатных состояниях — твёрдом, газообразном и жидком. Для каждого компонента характерны определённые химические свойства. При их вступлении в реакцию получается новое образование, например, нагретый сахар превращается в уголь и воду.

На уроках химии школьники изучают особенности превращения одних веществ в другие. К задачам предмета относится определение, с какими химическими компонентами при определённых условиях реагирует то либо иное вещество, что при этом образуется. Дополнительно изучаются условия, при которых протекают подобные превращения, и методы получения нужного состояния.
Под химсвойствами подразумевается совокупность информации о том, с какими иными компонентами и при каких условиях вступает во взаимодействие данное вещество. Атомы — частицы, которые участвуют в превращениях. При реакции они перегруппировываются. Старые связи между ними разрушаются, но возникают новые.

Для каждого вида атома характерен конкретный химический элемент (ХМ) — совокупность атомов с близкими либо одинаковыми характеристиками. В природе известно до 90 разных ХМ. Учёные в области физики способны создать новые виды атомов, которые отсутствуют на Земле. Такие компоненты называются искусственными. Их число превышает два десятка. У ХМ имеется латинское название и символ из 1−2 букв. От класса соединения зависит, какие химические свойства (ХС) характерны: кислоты, галогены, спирт.
Под ХС понимается способность взаимодействовать с иными компонентами, а также распадаться и диссоциироваться. Главное свойство — электроотрицательность. Чтобы описать реакционную способность, используются некоторые численные значения. Каждое из них зависит от определённых условий измерения.
ХС зависит от структуры молекул, степени их пространственности. Для веществ с одним составом и структурой характерны одинаковые виды химических свойств, кроме реакций с ХМ иной пространственной конфигурации.
Электролиты и галогены
Кислоты участвуют в реакциях с переходом электрона. Химические характеристики, свойственные для образования, зависят от его названия. Электролиты появляются в результате диссоциации водорода, который легко замещается металлами с последующим формированием соли.

Для кислот характерно сообразование гидратированных ионов, которые придают соответствующий вкус и способность изменять цвет. Другое химическое вещество — галоген. В переводе с греческого означает «рождение, происхождение». Компоненты относятся к основной подгруппе VII группы таблицы Менделеева. Им свойственно реагировать с любым простым элементом, кроме неметаллов.
Галогены считаются энергетическими окислителями, поэтому в природе встречаются в качестве соединений. При увеличении номера уменьшается активность галогенов:
- фтор;
- бром;
- хлор.
Взаимодействуя с металлами, формируется ионная связь, образуется соль. Все представители группы, кроме фтора, взаимодействуя с электроотрицательными компонентами, проявляют восстановительные свойства. Для них характерна высокая окислительная активность. Она уменьшается в процессе перехода от фтора к астату.

Сам фтор (F) считается самым активным галогеном. Он реагирует с любым металлом. Без нагрева он реагирует с неметаллами. Облучение способствует образованию инертного газа. Энергично протекает взаимодействие фтора со сложным веществом. Таким методом окисляется вода, а реакция приобретает взрывной характер.
Аналогичное явление наблюдается при освещении хлора (Cl) с водородом. Первый компонент быстро реагирует со сложными ХМ. При нагреве легко вытесняется йод либо бром из соединения хлора с металлом. При взаимодействии с водой наблюдаются следующие явления:
- растворение хлора;
- частичная реакция;
- образование равновесной смеси веществ.
Cl легко диспропорционируется со щелочами. Бром (Br) способен быстро растворяться в воде, частично реагируя с Н2О, образуя бромную воду.
Йод в воде не растворяется и не окисляется при нагревании. При этом он способен расщепляться в иодидных растворах, образуя комплексные анионы, включая раствор Люголя.

Йод отличается от других ХМ своей активностью. Он не вступает в реакцию со многими неметаллами, а с металлами при нагревании реагирует медленно. Для реакции водорода и йода характерна эндотермичность и сильнообратимость. Учёные доказали, что химическая активность галогенов уменьшается последовательно от F к астату (At). Каждый компонент из ряда вытесняет последующий из его соединений с металлом либо водородом. Любой галоген окисляет галогенид-ион любого из последующих галогенов. В процессе диссоциации формируются протоны, ионы.
Взаимодействие со спиртами

К химическим элементам относятся спирты. Они легко вступают в реакцию с иными компонентами и относятся к гидроксильной группе, для которой характерно наличие углеводородной цепи. Чем она больше, тем сильнее влияет на функциональную группу. При этом снижается полярность связи О-Н.
При разрыве связи реакция протекает медленно. На основе гидроксильной группы наблюдается отрицательный индуктивный эффект. В основе классификации спиртов на группы лежат их химические свойства. Специалисты выделяют воду либо оксид водорода, металлы, простые вещества. Первый компонент представлен в виде прозрачной жидкости без цвета, вкуса и запаха. Его свойства:
- возможность преобразовываться в разные состояния (лёд, пар);
- сильная полярность;
- в природе содержит в себе газы, соли.
Н2О считается самым распространённым растворителем на Земле. Химически вода активна. Её полярные молекулы способствуют образованию гидратов и кристаллогидратов. Н2О при комнатной температуре реагирует со следующими компонентами:
- Активные металлы (натрий, кальций, калий).
- Фтор.
- Соли из слабой кислоты.
- Бор.
При нагревании она вступает в реакцию с магнием и железом, метаном и углём. На основе катализаторов образуется ацетилен, алкен, амидам.
К простым ХМ относятся металлы. Для них характерны следующие свойства: высокие электро- и теплопроводность, пластичность, блеск, положительное сопротивление. Внешний электронный уровень представлен в виде незначительного числа электронов (максимум три). Вступая в реакцию, они выполняют функции восстановителей, отдавая свои электроны.
С кислородом взаимодействуют все элементы группы, кроме платины и золота. Реакция с серебром возможна, если достигнута высокая температура. Из-за термической неустойчивости оксид серебра не образуется. Перечень элементов, которые появляются на выходе (зависит от названия металла, который участвует в реакции):

- пероксиды;
- оксиды;
- надпероксиды.
Для получения пероксида используется металл. С малоактивным и средним компонентом реакции возникает при нагревании. Взаимодействие с азотом осуществляется на основе максимально активных металлов (АМ). При комнатной температуре взаимодействует только литий, который способствует появлению нитридов. При нагревании серы и железа получается сульфид.
С водородом и углеродом взаимодействуют наиболее АМ. С кислотами металл реагирует по-разному. ХМ, которые находятся в таблице до водорода, взаимодействуют с любой кислотой. Неокисляющие вещества с металлами участвуют в реакции замещения, для которой свойственно окисление и восстановление.
Окисляющая кислота, вступая в реакцию с металлом, расположенным после водорода, образует следующие продукты:
- водород;
- магний.
При взаимодействии железа и HNO3 различной концентрации получается Cu, NO. Больше вариантов реакций характерно для взаимодействия с АМ. Современные химики разработали технологию легирования, с помощью которой осуществляется ввод в расплав дополнительных ХМ. Они легко модифицируют физические, механические и химические свойства главного материала.
Загрузка…
Õèìè÷åñêèå ñâîéñòâà — óìåíèå âåùåñòâ (õèìè÷åñêèõ ýëåìåíòîâ, ïðîñòûõ âåùåñòâ è õèìè÷åñêèõ ñîåäèíåíèé) âçàèìîäåéñòâîâàòü ñ èíûìè âåùåñòâàìè ëèáî âèäîèçìåíÿòüñÿ ïîä âîçäåéñòâèåì íåêîòîðûõ ôàêòîðîâ. Ðåçóëüòàòîì áóäåò âèäîèçìåíåíèå ïåðâîíà÷àëüíîãî âåùåñòâà ëèáî âåùåñòâ â èíûå âåùåñòâà.
Ê õèìè÷åñêèì ñâîéñòâàì ïðè÷èñëÿþò óìåíèå ðåàãèðîâàòü ñ äðóãèìè âåùåñòâàìè è óìåíèå ðàçëàãàòüñÿ.
Õèìè÷åñêèå ñâîéñòâà âåùåñòâà îáóñëîâëåíû íå òîëüêî òåì, êàêèìè õèìè÷åñêèìè ýëåìåíòàìè îíî îáðàçîâàíî, íî è ñòðîåíèåì ìîëåêóëû âåùåñòâà, à òàê æå ïðîñòðàíñòâåííîé êîíôèãóðàöèåé ìîëåêóë. ×àùå âñåãî, âåùåñòâàì ñ èäåíòè÷íûì ñîñòàâîì è ñòðóêòóðîé áóäóò ïðèñóùè è îäíîòèïíûå õèìè÷åñêèå ñâîéñòâà, èñêëþ÷åíèå ñîñòàâëÿåò âçàèìîäåéñòâèå ñ âåùåñòâàìè ñ íåñõîæåé ïðîñòðàíñòâåííîé êîíôèãóðàöèåé.
Ê ïðèìåðó, êèñëîòíûå ñâîéñòâà äåìîíñòðèðóþò òå âåùåñòâà, êîòîðûå ñâîåîáðàçíî ìåíÿþò öâåò èíäèêàòîðîâ (ìåòèëîðàíæà ñ îðàíæåâîãî íà êðàñíûé); ìîãóò ðàñòâîðÿòü ïðåîáëàäàþùåå ÷èñëî ìåòàëëîâ ñ âûäåëåíèåì (â ïîäàâëÿþùåì ÷èñëå îïûòîâ) âîäîðîäà; ðàñòâîðÿþò çíà÷èòåëüíóþ ÷àñòü îêñèäîâ ìåòàëëîâ (îñíîâíûõ îêñèäîâ); ðåàêöèè ñî ùåëî÷àìè ïðîòåêàþò ñ ôîðìèðîâàíèåì ñîëè è âîäû.
Êàëüêóëÿòîðû ïî ôèçèêå | |
| Ðåøåíèå çàäà÷ ïî ôèçèêå, ïîäãîòîâêà ê ÝÃÅ è ÃÈÀ, ìåõàíèêà òåðìîäèíàìèêà è äð. | |
| Êàëüêóëÿòîðû ïî ôèçèêå | |
Êàëüêóëÿòîðû ïî õèìèè | |
| Õèìèÿ îíëàéí íà íàøåì ñàéòå äëÿ ðåøåíèÿ çàäà÷ è óðàâíåíèé. | |
| Êàëüêóëÿòîðû ïî õèìèè | |
Õèìè÷åñêèå âåùåñòâà | |
| Ìîëåêóëÿðíîå ñòðîåíèå âåùåñòâ, ôèçè÷åñêèå è õèìè÷åñêèå ñâîéñòâà âåùåñòâ, ñòðîåíèå âåùåñòâà. | |
| Õèìè÷åñêèå âåùåñòâà | |
Ôèçèêà 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó ôèçèêè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Ôèçèêà 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
| Îñíîâíàÿ èíôîðìàöèÿ ïî êóðñó õèìèè äëÿ îáó÷åíèÿ è ïîäãîòîâêè â ýêçàìåíàì, ÃÂÝ, ÅÃÝ, ÎÃÝ, ÃÈÀ | |
| Õèìèÿ 7,8,9,10,11 êëàññ, ÅÃÝ, ÃÈÀ | |
Âåùåñòâî. Ôèçè÷åñêèå ñâîéñòâà âåùåñòâà. | |
| Ôèçè÷åñêèå ñâîéñòâà âåùåñòâà. Ê ôèçè÷åñêèì ñâîéñòâàì âåùåñòâà ïðèíÿòî îòíîñèòü òå, êîòîðûå ôèêñèðóþòñÿ íàáëþäåíèåì ëèáî èçìåðåíèåì, áåç ïåðåõîäà â èíîå âåùåñòâî. | |
| Âåùåñòâî. Ôèçè÷åñêèå ñâîéñòâà âåùåñòâà. | |
Ïîõîæèå ïîñòû
Ñóëüôèä æåëåçà(II) (FeS) — âåùåñòâî, êîòîðîå îáðàçóåòñÿ ïðè âçàèìîäåéñòâèè æåëåçà ñ ñåðîé. Ïðèìåíÿåòñÿ êàê ñûðüå â ïðîèçâîäñòâå ÷óãóíà, à òàêæå ÿâëÿåòñÿ òâåðäûì èñòî÷íèêîì ñåðîâîäîðîäà. Íà ôîòîãðàôèÿõ ìîæíî çàìåòèòü ÷àñòèöû ìåòàëëè÷åñêîãî æåëåçà, êîòîðîå íå ïðîðåàãèðîâàëî ñ ñåðîé.
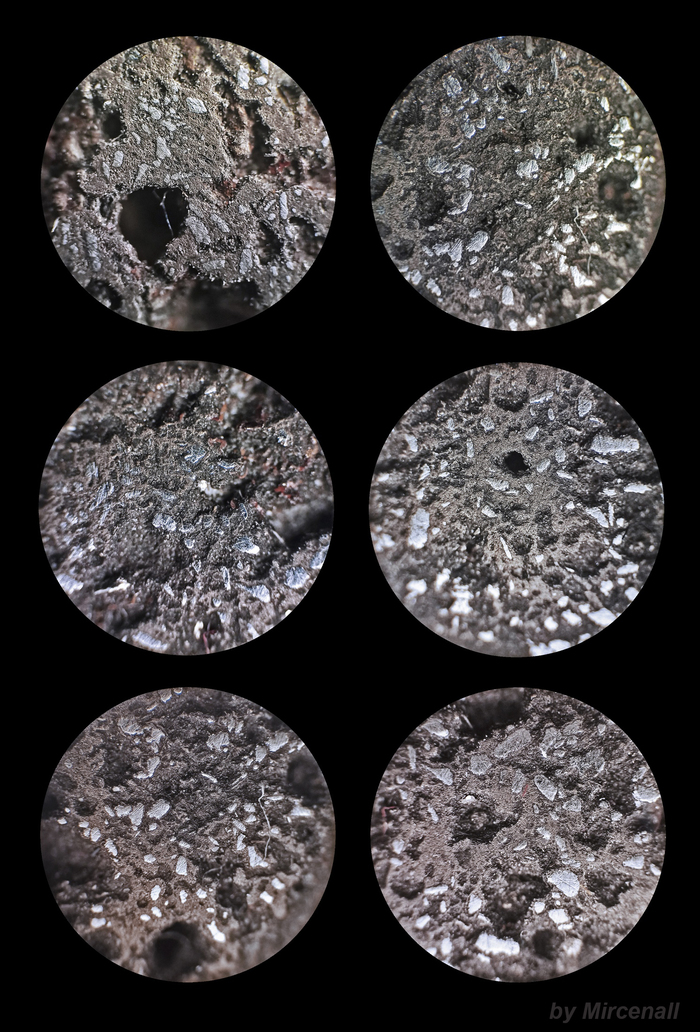
 ïðèðîäå ñóëüôèä æåëåçà(II) âñòðå÷àåòñÿ êðàéíå ðåäêî, îäíàêî ðàñïðîñòðàí¸í äèñóëüôèä æåëåçà(II) (FeS2), èçâåñòíûé êàê ìèíåðàë ïèðèò èëè ñåðíûé êîë÷åäàí.
vk.com/mircenall

Ïîêàçàòü ïîëíîñòüþ
3
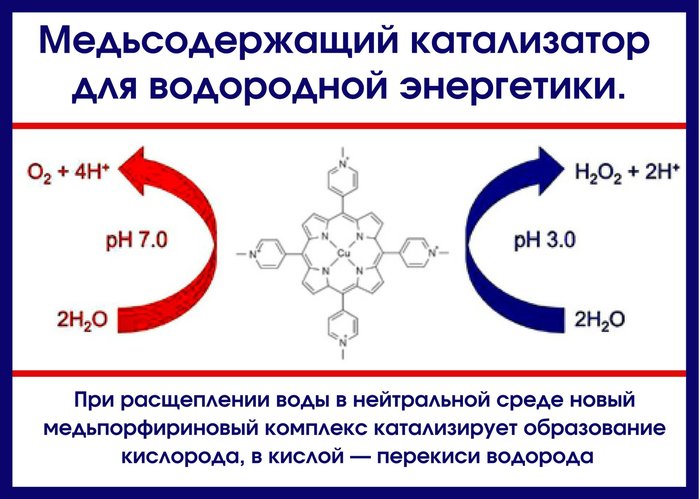
Íîâûé ìåäüñîäåðæàùèé êîìïëåêñ, èäåþ ñòðîåíèÿ êîòîðîãî ïîäñêàçàëà ïðèðîäà, ýôôåêòèâíî ðàñùåïëÿåò âîäó â íåéòðàëüíîé ñðåäå. Ýòî îòêðûòèå ìîæåò ñäåëàòü áîëåå äîñòóïíûì ïîëó÷åíèå âîäîðîäà ñ ïîìîùüþ âîññòàíîâëåíèÿ âîäû.
Ìîëåêóëÿðíûé âîäîðîä äàâíî ðàññìàòðèâàþò êàê àëüòåðíàòèâó íåôòè è ãàçó. Åäèíñòâåííûé ïðîäóêò ñãîðàíèÿ âîäîðîäà âîäà, êîòîðàÿ ñàìà ìîæåò áûòü èñòî÷íèêîì âîäîðîäà. Ìíîãèå èññëåäîâàòåëüñêèå ãðóïïû ïî âñåìó ìèðó ñòàðàþòñÿ ðàçðàáîòàòü êàòàëèçàòîðû, ñïîñîáíûå ïîíèçèòü ýíåðãèþ âîññòàíîâëåíèÿ âîäû äî ìîëåêóëÿðíîãî âîäîðîäà è îáëåã÷èòü ïðîòåêàíèå ýòîé ðåàêöèè. Íàèáîëåå ýôôåêòèâíûå êàòàëèçàòîðû ðàñùåïëåíèÿ âîäû â íàñòîÿùåå âðåìÿ êîîðäèíàöèîííûå ñîåäèíåíèÿ ðóòåíèÿ è èðèäèÿ. Ê íåäîñòàòêàì îáîèõ ìåòàëëîâ ìîæíî îòíåñòè èõ íèçêèå êîíöåíòðàöèè â çåìíîé êîðå è âûñîêóþ ñòîèìîñòü.
Íîâîå èññëåäîâàíèå äåìîíñòðèðóåò, ÷òî â ïðèñóòñòâèè ïîðôèðèíîâîãî êîìïëåêñà ìåäè ýëåêòðîêàòàëèòè÷åñêîå ðàñùåïëåíèå âîäû ïðîèñõîäèò ïðè íåéòðàëüíûõ çíà÷åíèÿõ ðÍ è ïðè íèçêîì çíà÷åíèè ýëåêòðîäíîãî ïîòåíöèàëà. Ïðè 310 ì è ðÍ 7 âîäà îêèñëÿåòñÿ ñ âûäåëåíèåì ìîëåêóëÿðíîãî êèñëîðîäà, à â êèñëîé ñðåäå (ïðè òîì æå ýëåêòðîäíîì ïîòåíöèàëå) äî ïåðåêèñè âîäîðîäà. Õîòÿ ìåäíûé êîìïëåêñ è íå ïðåâîñõîäèò ïî ïðîèçâîäèòåëüíîñòè êîìïëåêñû áëàãîðîäíûõ ìåòàëëîâ, âñå æå ýòî áîëüøîé øàã âïåðåä ìåíüøàÿ ýôôåêòèâíîñòü ïðîèçâîäíûõ ìåäè êîìïåíñèðóåòñÿ åå áîëüøåé ðàñïðîñòðàíåííîñòüþ è äåøåâèçíîé. Êàòàëèçàòîðû ðàñùåïëåíèÿ âîäû íà îñíîâå ìåäè áûëè èçâåñòíû è ðàíåå, íî îíè ðàáîòàëè â ñèëüíîùåëî÷íîé ñðåäå è ïðè áîëüøîì çíà÷åíèè ýëåêòðîäíîãî ïîòåíöèàëà.
Èññëåäîâàòåëè èñõîäèëè èç òîãî, ÷òî â ïðîöåññå ôîòîñèíòåçà êëþ÷åâóþ ðîëü â îêèñëåíèè âîäû è âûäåëåíèè êèñëîðîäà èãðàåò ìàãíèéïîðôèðèíîâûé êîìïëåêñ. Òåì íå ìåíåå ñïîñîáíîñòü ìåäüïîðôèðèíîâîãî êîìïëåêñà êàòàëèçèðîâàòü îêèñëåíèå âîäû îêàçàëàñü ïðèÿòíîé íåîæèäàííîñòüþ äëÿ ìíîãèõ õèìèêîâ êàê ñïåöèàëèñòîâ ïî õèìèè ïîðôèðèíîâûõ êîìïëåêñîâ, òàê è òåõ, êòî çàíèìàëñÿ ðàñùåïëåíèåì âîäû. Åùå îäíà íåîáû÷íàÿ ÷åðòà ýòîãî êàòàëèçàòîðà îêèñëåíèå âîäû äî ïåðåêèñè âîäîðîäà ïðè íèçêèõ çíà÷åíèÿõ ðÍ. Ýòîò ïðîöåññ íå ñòîèò ðàññìàòðèâàòü êàê íîâûé ñïîñîá ïîëó÷åíèÿ H2O2, è âñå æå îí òðåáóåò âíèìàíèÿ. Óñòàíîâèâ, êàê îáðàçóåòñÿ ïåðåêèñü âîäîðîäà, èññëåäîâàòåëè ñìîãóò îïðåäåëèòü ìåõàíèçì ýòîé êàòàëèòè÷åñêîé ðåàêöèè è âûÿñíèòü, êàê ïîâûñèòü ýôôåêòèâíîñòü ðàñùåïëåíèÿ âîäû.

Ïîêàçàòü ïîëíîñòüþ
3
 îäíîì èç ïîñòîâ îá îëîâå ïèêàáóøíèêîâ çàèíòåðåñîâàëà òàêàÿ äåòàëü — ïðè òåìïåðàòóðå íèæå 13.2°C êîâêîå è ïëàñòè÷íîå îëîâî ïåðåõîäèò â äðóãóþ «ñåðóþ» àëëîòðîïíóþ ìîäèôèêàöèþ.

Ïðè ýòîì ïåðåõîä ñîïðîâîæäàåòñÿ óâåëè÷åíèåì îáúåìà íà 25,6 %, â ñâÿçè ñ ÷åì âîçíèê âîïðîñ
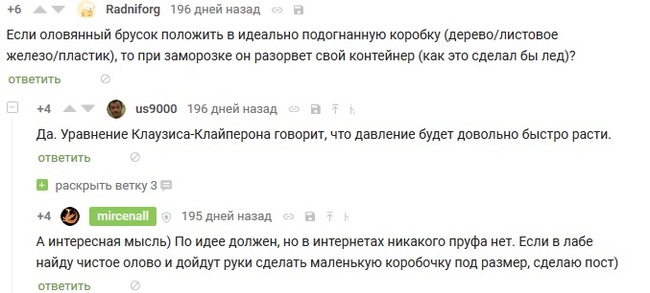
Ñîáñòâåííî ýòî ÿ è ðåøèë ïðîâåðèòü.
Ïåðâûì äåëîì íàøåë â ëàáîðàòîðèè ÷èñòîå îëîâî (ïðîâîëîêà ïðèïîÿ íå ïîäîéäåò, èáî îíà ñîäåðæèò ñâèíåö, êîòîðûé êàê ðàç òàêè ïðåäîòâðàùàåò ðàçðóøåíèå). Îëîâî õðàíèòñÿ â âèäå ìàëåíüêèõ ãðàíóë, íî ÿ ïåðåïëàâèë åãî â êóñîê ïîáîëüøå.

Äåëàòü èäåàëüíóþ äåðåâÿííóþ êîðîáêó áûëî áû ñëèøêîì äîëãî, òàê ÷òî ðåøèë çàëèòü êóñîê ìåòàëëà â ãèïñ è âûñòàâèòü íà ìîðîç íà äîëãîå âðåìÿ â çàêðûòîé êîðîáêå.


Êðîìå òîãî, ÷åì íèæå òåìïåðàòóðà, òåì áûñòðåå îñóùåñòâëÿåòñÿ ïåðåõîä (íàèáîëåå áûñòðîå ïðåâðàùåíèå íàáëþäàåòñÿ ïðè òåìïåðàòóðå íèæå -33°C). Ïîñêîëüêó íà÷àëî çèìû â ñòîëèöå âûäàëîñü òåïëûì, ÿ ðåøèë ïðîâîäèòü ýòîò ýêñïåðèìåíò ñ ñåðåäèíû ÿíâàðÿ. Ãèïñîâûé ñëåïîê ñ îëîâîì ÿ ïîëîæèë â êîðîáêó (äàáû çàùèòèòü åãî îò âîäû) è îñòàâèë íà ïîäîêîííèêå, ðåøèâ îòêðûòü ñïóñòÿ ìåñÿö.

×åðåç ìåñÿö ôîðìà îñòàëàñü ëåæàòü, êàê ëåæàëà. Îäíàêî êàê ðàç ñ ñåðåäèíû ôåâðàëÿ óäàðèëè ñèëüíûå ìîðîçû è ïðîöåññ äîëæåí áûë óñêîðèòüñÿ (òåì âðåìåíåì ïèêàáó íà÷àëî íàïîìèíàòü î ñåáå)

Îòêðûâ êîðîáêó óæå â ìàðòå, ÿ óâèäåë æåëàííîå èçìåíåíèå — òðåùèíó, ðàçäåëèâøóþ ñëåïîê íà äâå ïîëîâèíû!

Àêêóðàòíî äîñòàâ åãî, ÿ ðàçäåëèë ïîëîâèíêè ôîðìû è îòòóäà ïîñûïàëñÿ òåìíûé ïîðîøîê ñ ìåòàëëè÷åñêèì áëåñêîì (è îñòàòîê êóñêà áåëîãî îëîâà, ïîâåðõíîñòü êîòîðîãî áûëà òàêæå âñÿ â ñåðîé ìîäèôèêàöèè ).  êîíöå êîíöîâ îíî-òàêè ðàçîðâàëî ãèïñ.

Ñåðîå îëîâî ñêîðåå ïîõîæå íà ãðàôèò ñ áëåñêîì ñâèíöà, ÷åì íà ìåòàëë. ×òîáû íàãëÿäíî ïðîäåìîíñòðèðîâàòü îòëè÷èå, ÿ âûñûïàë ðÿäîì ïîðîøîê áåëîãî îëîâà è ïîëó÷åííîå ñåðîå. Îäíàêî âåðíóòü åìó èñõîäíîå ñîñòîÿíèå íå ñîñòàâëÿåò òðóäà — òðåáóåòñÿ ëèøü ðàñïëàâèòü α-îëîâî è ñëèòîê ñíîâà áóäåò ÿâëÿòüñÿ áåëûì β-îëîâîì

Òàêèì îáðàçîì ïðåäïîëîæåíèå î ðàçðûâàþùåì êîíòåéíåðå îëîâå ïîäòâåðæäåíî

P.S. îòäåëüíàÿ áëàãîäàðíîñòü ñåäüìîé ïàðòèè ãðàíóëèðîâàííîãî îëîâà Óðàëüñêîãî çàâîäà õèìðåàêòèâîâ îò íîÿáðÿ 1977 ãîäà. Èíà÷å áû ýêñïåðèìåíò íå ñîñòîÿëñÿ.


Ïîêàçàòü ïîëíîñòüþ
12
Êðèñòàëëû ñåðåáðà íà ìåäè.

Ñåðåáðî âûäåëÿåòñÿ íà òðåóãîëüíûõ ìåäíûõ ïëàñòèíêàõ, ïîãðóæåííûõ â ðàñòâîð íèòðàòà ñåðåáðà

Ìåäü
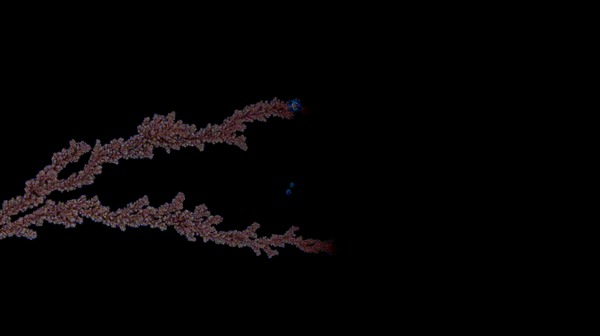
Öèíê

Ñåðåáðî

Îëîâî

Ñâèíåö

Ïîêàçàòü ïîëíîñòüþ
2
Îáðàçîâàíèå êðèñòàëëîâ îëîâà ïðè ýëåêòðîëèçå ðàñòâîðà õëîðèäà îëîâà â ñåðíîé êèñëîòå

Îáðàçîâàíèå îëîâÿííûõ êðèñòàëëîâ ïîä ìèêðîñêîïîì
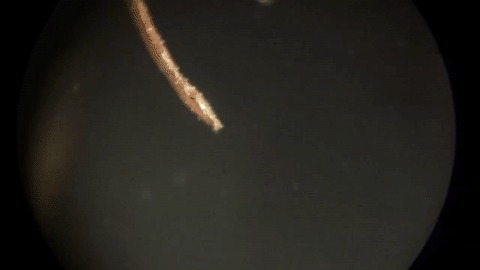
Îáðàçîâàíèå îëîâÿííûõ êðèñòàëëîâ ïðè íèçêîé êîíöåíòðàöèè õëîðèäà îëîâà è ìàëûõ îáúåìàõ ðàñòâîðà (òàêæå óâåëè÷åíî)

Ðåàêöèÿ îëîâà ñ àçîòíîé êèñëîòîé

Ðåàêöèÿ îëîâà ñ ñîëÿíîé êèñëîòîé

Ðåàêöèÿ îëîâà ñ öàðñêîé âîäêîé (ñìåñü àçîòíîé è ñîëÿíîé êèñëîòû) ïðîòåêàåò, îäíàêî, áîëåå áóðíî

«Îëîâÿííàÿ ÷óìà» — îñîáîå ñâîéñòâî ýëåìåíòà, êîòîðîå çàêëþ÷àåòñÿ â òîì, ÷òî ïðè òåìïåðàòóðå íèæå 13,2 °C ìåòàëëè÷åñêîå (áåëîå) îëîâî (β-Sn) ïåðåõîäèò â äðóãîå ôàçîâîå ñîñòîÿíèå ñåðîå îëîâî (α-Sn), â êðèñòàëëè÷åñêîé ðåø¸òêå êîòîðîãî àòîìû ðàñïîëàãàþòñÿ ìåíåå ïëîòíî. Ïðîèñõîäèò ýòî ïðî ïðè÷èíå óâåëè÷åíèÿ óäåëüíîãî îáú¸ìà ÷èñòîãî îëîâà íà 25,6 %

Îëîâî èìååò íåáîëüøóþ òåìïåðàòóðó ïëàâëåíèÿ (232 °C) è ëåãêî ïåðåõîäèò â æèäêîå ñîñòîÿíèå ïîä äåéñòâèåì ïëàìåíè ãîðåëêè

Ãîðåíèå ìàëåíüêîãî êóñî÷êà îëîâà (ìîìåíòàëüíîå îêèñëåíèå)

Ïîêàçàòü ïîëíîñòüþ
6

Ðîñò êðèñòàëëîâ ñåðåáðà íà ìåäíîé ïðîâîëîêå (â ðàñòâîðå íèòðàòà ñåðåáðà)

Ðåàêöèÿ ñåðåáðà ñ àçîòíîé êèñëîòîé (ñ âûäåëåíèåì äèîêñèäà àçîòà)

Îáðàçîâàíèå õëîðèäà ñåðåáðà

Ðåàêöèÿ «Ñåðåáðÿíîå çåðêàëî» (â ïðèñóòñòâèè àëüäåãèäîâ èäåò âîññòàíîâëåíèå ìåòàëëà èç àììèà÷íîãî êîìïëåêñà)

Îáðàçîâàíèå ñóëüôèäà ñåðåáðà ïðè äîáàâëåíèè òèîñóëüôàòà

Îáðàçîâàíèå õðîìàòà ñåðåáðà

Âçðûâ îò íàãðåâàíèÿ àöåòèëåíèäà ñåðåáðà

Îáðàçîâàíèå áðîìèäà è èîäèäà ñåðåáðà

Ñåðåáðî ìîæíî ðàñïëàâèòü õîðîøåé ãàçîâîé ãîðåëêîé

Ïîêàçàòü ïîëíîñòüþ
6
Ðåàêöèÿ ñìåñè æåëåçà è ñåðû îò íàãðåòîé ïàëî÷êè (îáðàçîâàíèå ñóëüôèäà)

Îáðàçîâàíèå ñèëèêàòà æåëåçà, ïðè äîáàâëåíèè õëîðèäà ê ðàñòâîðó ñèëèêàòà íàòðèÿ
