Продуктами какой реакции могут быть h2o и co2

Общие химические свойства углекислого газа: CO2 инертен, то есть химически не активен; при попадании в водный раствор легко вступает в реакции.
Большинство кислотных оксидов устойчивы к высоким температурам, но углекислота при их воздействии восстанавливается.
Взаимодействие с другими веществами:
1) Углекислота относится к кислотным оксидам, то есть в сочетании с водой образуется кислота. Однако угольная кислота неустойчива и распадается сразу. Эта реакция имеет обратимый характер:
СО2 + H2O ↔ CO2 × H2O (растворение) ↔ Н2СО3
Диоксид углерода + вода ↔ угольная кислота

Молекула угольной кислоты
2) При взаимодействии углекислого газа и соединений азота с водородом (аммиаком) в водном растворе происходит разложение до углеаммонийной соли.
2NH3 + CO2 + H2O = NH4HCO3
Аммиак + углекислота = гидрокарбонат аммония

Углеаммонийная соль
Полученное вещество часто используется в приготовлении хлеба и различных кондитерских изделий.
3) Ход некоторых реакций должен поддерживаться высокими температурами. Примером является производство мочевины при 130 °C и давлении 200 атм., схематически изображаемое так:
2NH3 + СО2 → (NH2)2СО + H2O
Аммиак + диоксид углерода → карбамид + вода
Также под воздействием температуры около 800 градусов протекает реакция образования оксида цинка:
Zn + CO2 → ZnO + CO

Оксид цинка
Цинк + двуокись углерода → оксид цинка + оксид углерода
4) Возможно уравнение с гидроксидом бария, при котором выделяется средняя соль.
Ba(OH)2+CO2 = BaCO3 + H2O
Гидроксид бария + углекислота = карбонат бария + оксид водорода.
Применяется для регулировки калориметров по теплоемкости. Также вещество используют в промышленности для производства красных кирпичей, синтетических тканей, фейерверков, гончарных изделий, плитки для ванн и туалетов.
5) Углекислый газ выделяется при реакциях горения.
Горение метана.
CH4 + 2O2 → CO2 + 2H2O + 891кДж

Горение газа на плите
Метан + кислород = углекислота + вода (в газообразном состоянии) + энергия
Горение этилена
C2H4 + 3O2 → 2CO2 + 2H2O + Q
Этилен + кислород = диоксид углерода + оксид водорода + энергия
Горение этана
2С2Н6 + 7О2 → 4CO2 + 6H2O + Q
Этан + кислород = двуокись углерода + вода + энергия
Горение этанола
C2H5OH + 3O2 = 3H2O + 2CO2 + Q

Молекула этанола
Этанол + кислород = вода + углекислота + энергия
6) Газ не поддерживает горения, этот процесс возможен только с некоторыми активными металлами, например, магнием.
2Mg + CO2 = C + 2MgO
Магний + углекислота = углерод + оксид магния.
MgO активно применяется при производстве косметических средств. Вещество используют в пищевой промышленности как пищевую добавку.
7) Двуокись углерода реагирует с гидроксидами с получением солей, которые существуют в двух формах, как карбонаты и бикарбонаты. Например, углекислый газ и гидроксид натрия, согласно формуле, образуют гидрокарбонат Na:
CO2 + NaOH → NaHCO3
диоксид углерода + гидроксид натрия → гидрокарбонат натрия.
Или же при большем количестве NaOH образуется карбонат Na с образованием воды:
CO2 + 2 NaOH → Na2CO3 + H2O
Диоксид углерода + гидроксид натрия → карбонат натрия + вода
Кислотно-щелочные реакции углекислоты используются на протяжении веков для затвердевания известкового раствора, что может быть выражено простым уравнением:
Ca(OH)2 + CO2 → CaCO3 + H2O
Гидроксид кальция + двуокись углерода → карбонат кальция + оксид водорода
8) В зелёных растениях играет важную роль в процессе фотосинтеза:
6CO2 + 6H2O → C6H12O6 + 6O2

Образование глюкозы
Диоксид углерода + вода → глюкоза + кислород.
9) Химические свойства углекислоты используются в промышленности при производстве соды, суть этого процесса можно выразить суммарным уравнением:
NaCl + CO2 + NH3 + H2O → NaHCO3 + NH4Cl
Хлорид натрия + Диоксид углерода + аммиак + вода → гидрокарбонат натрия + хлорид аммония
10) Фенолят Na разлагается при взаимодействии с углекислым газом, при этом малорастворимый фенол выпадает в осадок:
C6H5ONa + CO2 + H2O = C6H5OH + NaHCO3
Фенолят натрия + двуокись углерода + оксид водорода = фенол + гидрокарбонат натрия
11) Пероксид натрия и углекислый газ, взаимодействуя, образуют среднюю соль карбоната Na с выделением кислорода.
2Na2O2 + 2CO2 → 2N2CO3 + O2
Пероксид натрия + углекислота → карбонат натрия + кислород

Колба с пероксидом натрия
Образование углекислоты происходит при растворении в воде кальцинированной соды (стиральной соды).
NaHCO3 + H2O → CO2 + H2O + NaOH
Гидрокарбонат натрия + вода → углекислота + вода + гидроксид натрия
При этой реакции (гидролиз по катиону) образуется сильнощелочная среда.
12) CO2 вступает в реакцию с гидроксидом калия, последний образуется путем электролиза хлористого калия.
2KOH + CO2 → K2CO3 + H2O
Гидроксид калия + углекислота → карбонат калия + вода
13) Газ в силу своего строения не реагирует с благородными газами, то есть гелием, неоном, аргоном, криптоном, ксеноном, радоном, оганесоном.
Заключение
Мы привели большую часть химических реакций, в которых участвует CO2. Ученые всего мира пытаются решить проблему увеличения концентрации углекислоты в воздухе, не без помощи реакций с другими веществами, которые известны химикам. А какие химические формулы взаимодействия углекислого газа знаете вы?
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
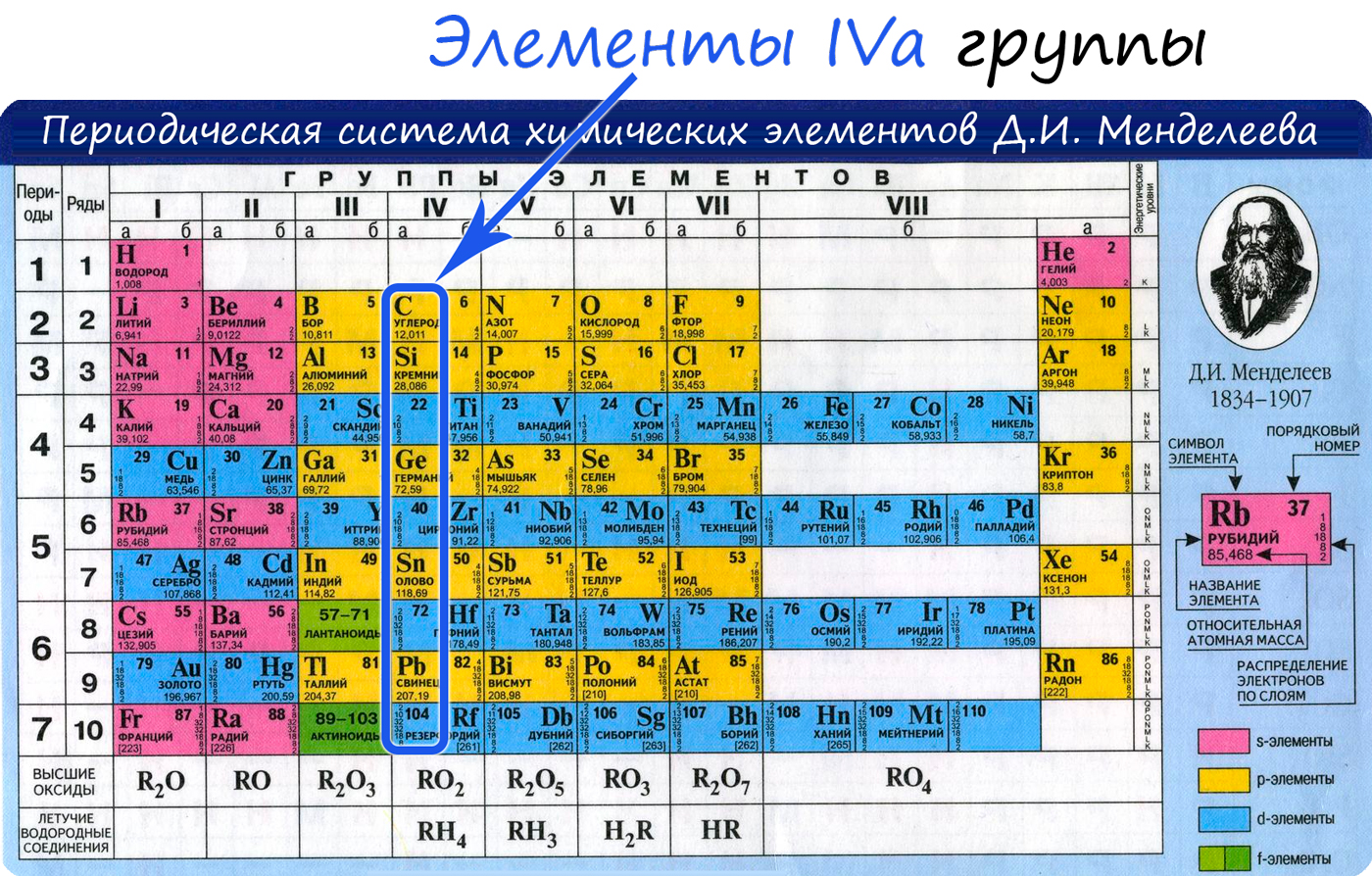
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C + H2 (пиролиз этана)
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C + H2 → (t) CH4 (метан)
2С + O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С + F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 + C → Fe + CO2
ZnO + C → Zn + CO
FeO + C → Fe + CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:
CO2 + C → CO

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C + H2O → CO↑ + H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C + HNO 3(конц.) → (t) CO2 + NO2 + H2
C + HNO3 → CO2 + NO + H2O
C + H2SO4(конц.) → CO2 + SO2 + H2O

Оксид углерода II — СO
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода
и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 + C → (t) CO
C + H2O → (t) CO + H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO + H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO + O2 → CO2
Fe2O3 + CO → Fe + CO2
FeO + CO → Fe + CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe + CO → (t) Fe(CO)5

Оксид углерода IV — CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO + CO2↑
C6H12O6 → C2H5OH + CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 + HCl → CaCl2 + H2O + CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 + O2 → CO2 + H2O

Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 + H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания),
кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание — кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
Na2O + CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного
газа без запаха.
MgCO3 + HCl → MgCl2 + CO2↑ + H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа —
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 + CO2 → CaCO3 (осадок выпадает)
CaCO3 + H2O + CO2 → Ca(HCO3)2 (осадок растворяется)

Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 + LiOH → Li2CO3 + H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO + CO2
KHCO3 → (t) K2CO3 + CO2↑ + H2O
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Классификация реакций
Химические реакции — явления, при которых происходит разрыв одних и образование других химических связей. При этом из одних химических веществ получаются другие вещества (или другое вещество).
По изменению состава веществ реакции делятся на
- Реакции, при которых не происходит изменение состава веществ
а) аллотропные превращения: С(графит) С(алмаз); O2 O3 и др.
б) реакции изомеризация: NH4OCN (NH2)2CO; CH3—CH2—CH2—CH3 CH3—CH(CH3)—CH3 и др. - Реакции, при которых происходит изменение состава веществ — все остальные реакции.
а) реакции соединения: S + O2 = SO2; CaO + CO2 = CaCO3; C2H4 + Br2 = C2H4Br2 и т. п.
б) реакции разложения: 2HgO = 2Hg + O2; MgCO3 = MgO + CO2; C2H5OH = C2H4 + H2O и т. п.
в) реакции замещения: Zn + 2HCl = ZnCl2 + H2; CaCO3 + SiO2 = CaSiO3 + CO2; CH4 + Cl2 = CH3Cl + HCl и др.
г) реакции обмена: CuO + H2SO4 = CuSO4 + H2O; NaOH + HCl = NaCl + H2O; HCOOH + CH3OH = HCOOCH3 + H2O; и другие, более сложные, реакции.
По изменению степени окисления реакции делятся на реакции, протекающие с изменением степени окисления (окислительно-восстановительные реакции, ОВР):
Fe0 + S0 = Fe+IIS-II;
и реакции, протекающие без изменения степени окисления.
По изменению внутренней энергии (по тепловому эффекту реакции) реакции делятся на
экзотермические: 2Mg + O2 = 2MgO + Q; CH4 + 2O2 = CO2 + 2H2O + Q (тепло выделяется);
эндотермические: CaCO3 = CaO + CO2 — Q; C8H18 C4H10 + C4H8 — Q. (тепло поглощается)
По направлению протекания реакции делятся на
необратимые: AgNO3 + NaCl = AgCl + NaNO3; CH4 + Cl2 = CH3Cl + HCl (протекают в одном направлении)
обратимые: K2SO3 + H2O KHSO3 + KOH; C2H6 C2H4 + H2 (протекают в двух направлениях)
По числу фаз в реагирующей смеси различают
гомофазные («гомогенные») реакции:
2CO(г) + O2(г) = 2CO2(г) (одна фаза — газ);
CH3NH2(р-р)+ HCl(р-р) = [CH3NH3]Cl(р-р) (одна фаза — водный раствор);
гетерофазные («гетерогенные») реакции:
Fe(т) + CuSO4(р-р) = Cu(т) + FeSO4(р-р) (три фазы — две твердых фазы и водный раствор);
2Na(т) + 2C2H5OH(ж) = 2C2H5ONa(р-р) + H2(г) (три фазы — газ, твердая фаза и спиртовой раствор).
По участию в реакции катализатора выделяют каталитические реакции:
2H2O2 2H2O + O2; C2H4 + H2 C2H6
Есть и другие классификационные признаки: скорость, механизм и т. д.
Одну и ту же реакцию по разным признакам можно отнести одновременно к нескольким типам, например, реакция
N2 + 3H2 2NH3 + Q
является экзотермической обратимой гомофазной (формально) каталитической окислительно-восстановительной реакцией соединения.
Реакции обмена, протекающие в растворах, идут до конца, если образуется осадок, газ или малодиссоциированное вещество (в частности, вода)
BaCl2 + Na2SO4 = BaSO4 + 2NaCl
NH4Cl + NaOH = NaCl + NH3 + H2O
KNO2 + HCl = KCl + HNO2 (молекулярное уравнение)
K+ + NO2- + H+ + Cl- = K+ + Cl- + HNO2 (полное ионное уравнение)
H+ + NO2- = HNO2 (сокращенное ионное уравнение, ионное уравнение)
Скорость химической реакции
Скорость гомофазной реакции — отношение изменения концентрации реагента или продукта реакции ко времени протекания реакции.
Скорость гетерофазной реакции — отношение изменения количества вещества реагента или продукта реакции ко времени протекания реакции и площади соприкосновения реагирующих веществ.
Факторы, влияющие на скорость реакции.
1. Природа реагирующих веществ (состав, строение, энергия активации).
Энергия активации (Ea) — избыточная энергия (по сравнению со средней), необходимая для эффективного соударения реагирующих частиц.
Чем меньше энергия активации, тем больше скорость реакции, и, чем больше энергия активации, тем меньше скорость реакции. Например, реакции обмена в водных растворах, приводящие к образованию осадка протекают очень быстро, так как у них очень маленькая энергия активации. Напротив, реакция получения аммиака из водорода и азота при комнатной температуре практически не идет, так как у нее очень большая энергия активации.
2. Температура. При увеличении температуры увеличивается скорость движения молекул и их кинетическая энергия, уменьшается прочность связей, все это приводит к возрастанию числа частиц с энергией, равной энергии активации, и увеличению скорости реакции.
Правило Вант-Гоффа. При увеличении температуры на 10oС скорость реакции возрастает в 2 … 4 раза.
3. Концентрации реагентов. Чем больше концентрация реагирующих веществ, тем чаще их частицы соударяются, и тем больше скорость реакции. Для реакции aA + bB = dD, протекающей в одну стадию, скорость реакции v = k·(cA)a·(cB)b. Это выражение называется законом действующих масс для скорости реакции. Постоянная (при постоянной температуре) величина k называется константой скорости реакции. Она равна скорости реакции при единичных концентрациях реагентов.
4. Наличие катализатора. Катализаторы — вещества, с помощью которых медленная реакция заменяется последовательностью более быстрых реакций с меньшими энергиями активации. Катализаторы вступают в первую реакцию этой последовательности и выделяются в химически неизменном виде в результате последней реакции. Поэтому создается впечатление, что катализаторы увеличивают скорость реакции.
Ингибиторы — вещества, уменьшающие скорость реакции; ингибиторы, в отличие от катализаторов, в ходе реакции расходуются.
5. Скорость гетерофазных реакций зависит также от состояния поверхности (например, чистая или загрязненная), характера образующихся продуктов (например, растворимы продукты или нет), условий подвода реагентов и отвода продуктов реакции (например, используется перемешивание, или нет).
Если реакция протекает на границе газовой фазы и твёрдой (или жидкой) фазы, то на скорость реакции не влияют концентрации жидких и твердых веществ, а если на границе жидкой и твёрдой фазы, то — концентрации твердых веществ.
Обратимые реакции. Химическое равновесие.
Необратимые реакции протекают только в одном направлении.
Обратимые реакции — реакции, которые при одних и тех же условиях протекают как в прямом, так и в обратном направлениях.
| H2 + I2 | 2HI |
| реагенты | продукт |
Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции называется химическим равновесием. Химическое равновесие — равновесие динамическое.
Принцип Ле Шателье: если на систему, находящуюся в равновесии оказать внешнее воздействие, то равновесие в системе сместится в том направлении, в котором происходит частичная компенсация этого воздействия.
- при увеличении концентрации исходного вещества равновесие смещается в сторону продуктов реакции;
- при увеличении концентрации продуктов реакции — в сторону реагентов (исходных веществ);
- при увеличении давления (если в системе есть газы) — в сторону меньшего объема;
- при уменьшении давления — в сторону большего объема;
- при увеличении температуры — в сторону продуктов эндотермической реакции;
- при уменьшении температуры — в сторону продуктов экзотермической реакции.
Введение катализатора не смещает равновесия, но ускоряет его достижение.
Тепловой эффект реакции.
Тепловой эффект реакции — количество теплоты, выделяющейся, или поглощающейся при протекании реакции с теми количествами вещества реагентов, которые задаются коэффициентами в термохимическом уравнении.
| C2H4 + 3O2 = 2CO2 + 2H2O + 1400 кДж | Экзотермическая реакция; |
| CaCO3 = CaO + CO2 — 157 кДж | Эндотермическая реакция. |
Тепловой эффект возникает прежде всего из-за разницы в энергиях связей в исходных веществах (реагентах) и продуктах реакции (см. вышеприведенный рис.)
Теория электролитической диссоциации
Вещества с ионой или сильно полярной ковалентной связью могут при растворении или плавлении (только ионные вещества) образовывать подвижные ионы, за счет которых эти растворы или расплавы проводят электрический ток. Такие вещества называют электролитами, а процесс образования ионов — электролитической диссоциацией.
- Электролитами являются:
- соли NaCl = Na+ + Cl-
- основания NaOH = Na+ + OH-
- кислоты HCl = H+ + Cl-
Сильные электролиты — электролиты, которые в разбавленном растворе полностью (необратимо) диссоциируют.
Слабые электролиты — электролиты, которые в разбавленном растворе диссоциируют частично (обратимо) и незначительно.
Степень диссоциации — отношение числа продиссоциировавших в растворе молекул к числу исходных молекул (молекул, попавших в раствор). Степень диссоциации зависит от концентрации и температуры. С увеличением концентрации степень диссоциации уменьшается, а с увеличением температуры — возрастает.
Некоторые электролиты диссоциируют ступенчато:
H2S H+ + HS- (первая ступень); HS- H+ + S2- (вторая ступень).
Степень диссоциации по второй ступени всегда меньше, чем по первой ступени.
Свойства разбавленных растворов сильных электролитов определяются свойствами ионов, находящихся в этих растворах (молекул в них нет): свойства кислот — свойствами ионов водорода, свойства щелочей — свойствами гидорксидных ионов, свойства солей — свойствами ионов, входящих в состав данной соли.
