Предельные углеводороды какие свойства

Предельные, углеводороды ряда метана (алканы)
Алканы, или парафины — алифатические
предельные углеводороды, в молекулах которых атомы углерода связаны между собой
простой s-связью.
Оставшиеся валентности углеродного атома, не затраченные на связь с другими
атомами углерода, полностью насыщены водородом. Поэтому предельные углеводороды
содержат в молекуле максимальное число водородных атомов.
Углеводороды ряда алканов имеют общую
формулу CnH2n+2. В таблице представлены некоторые
представители ряда алканов и их некоторые физические свойства.
Формула | Название | Название | Т | Т |
CH4 | метан | метил | -184 | -162 |
C2H6 | этан | этил | -172 | -88 |
C3H8 | пропан | пропил | -190 | -42 |
C4H10 | бутан | бутил | -135 | -0,5 |
C4H10 | изобутан | изобутил | -140 | -10 |
C5H12 | пентан | пентил | -132 | 36 |
C5H12 | изопентан | изопентил | -161 | 28 |
C5H12 | неопентан | неопентил | -20 | 10 |
C6H14 | гексан | гексил | -94 | 69 |
C7H16 | гептан | гептил | -90 | 98 |
C10H22 | декан | децил | -30 | 174 |
C15H32 | пентадекан | 10 | 271 | |
C20H42 | эйкозан | 37 | 348 |
Из таблицы видно, что эти углеводороды
отличаются друг от друга количеством групп — СН2-.Такой ряд сходных
по строению, обладающих близкими химическими свойствами и отличающихся друг от
друга числом данных групп называется гомологическим рядом. А вещества,
составляющие его, называются гомологами.
Тренажёр
№1 — Гомологи и изомеры
Тренажёр
№2. — Гомологический ряд предельных углеводородов
Физические
свойства
Первые четыре
члена гомологического ряда метана — газообразные вещества, начиная с пентана —
жидкости, а углеводороды с числом углеродных атомов 16 и выше — твердые
вещества (при обычной температуре). Алканы — неполярные соединения и трудно
поляризуемые. Они легче воды и в ней практически не растворяются. Не
растворяются также в других растворителях с высокой полярностью. Жидкие алканы
— хорошие растворители для многих органических веществ. Метан и этан, а также
высшие алканы не имеют запаха. Алканы — горючие вещества. Метан горит
бесцветным пламенем.
Получение
алканов
Для получения
алканов используют в основном природные источники.
Газообразные
алканы получают из природного и попутных нефтяных газов, а твердые алканы — из
нефти. Природной смесью твердых высокомолекулярных алканов является горный
воск —природный битум.
1. Из
простых веществ:
nC + 2nН2500 °С, кат → СnН2n+ 2
2. Действие
металлического натрия на галогенопроизводные алканов— реакция А.Вюрца:
2CH3-Cl + 2Na → CH3-CH3
+ 2NaCl
Химические свойства алканов
1. Реакции замещения — Галогенирование (стадийно)
CH4 + Cl2 hν → CH3Cl(хлорметан) + HCl (1 стадия)
;
метан
CH3Cl + Cl2 hν → CH2Cl2 (дихлорметан)+ HCl (2 стадия);
СH2Cl2 + Cl2 hν → CHCl3 (трихлорметан)+ HCl (3 стадия);
CHCl3 + Cl2 hν → CCl4 (хлорметан)+ HCl (4 стадия).
2. Реакции горения (горят светлым не коптящим пламенем)
CnH2n+2 + O2t→ nCO2 +
(n+1)H2O
Горение метана
Горение пропан-бутановой смеси
3. Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-)
связи:
C10H22 → C5H12
+ C5H10
б) Пиролиз при температуре 1000°С разрываются все связи,
продукты – С (сажа) и Н2:
СH4 1000°С→
C + 2H2
Применение
·
Предельные
углеводороды находят широкое применение в самых разнообразных сферах жизни и
деятельности человека.
·
Использование
в качестве топлива – в котельных установках, бензин, дизельное топливо,
авиационное топливо, баллоны с пропан-бутановой смесью для бытовых плит
·
Вазелин
используется в медицине, парфюмерии, косметике, высшие алканы входят в состав
смазочных масел, соединения алканов применяются в качестве хладагентов в
домашних холодильниках
·
Смесь
изомерных пентанов и гексанов называется петролейным эфиром и применяется в
качестве растворителя. Циклогексан также широко применяется в качестве
растворителя и для синтеза полимеров.
·
Метан
используется для производства шин и краски
·
Значение
алканов в современном мире огромно. В нефтехимической промышленности предельные
улеводороды являются базой для получения разнообразных органических соединений,
важным сырьем в процессах получения полупродуктов для производства пластмасс,
каучуков, синтетических волокон, моющих средств и многих других веществ. Велико
значение в медицине, парфюмерии и косметике.
Задания для закрепления
№1.
Составьте уравнения реакций горения этана и бутана.
№2.
Составьте
уравнения реакций получения бутана из следующих галогеналканов:
CH3 — Cl (хлорметан) и C2H5 — I (йодэтан).
№3. Осуществите
превращения по схеме, назовите продукты:
C→ CH4 → CH3Cl → C2H6
→ CO2
№4. Реши кроссворд
По горизонтали:
1.
Алкан, имеющий молекулярную формулу С3Н8.
2. Простейший представитель предельных углеводородов.
3. Французский химик, имя которого носит реакция получения углеводородов с
более длинной углеродной цепью взаимодействием галогенопроизводных предельных
углеводородов с металлическим натрием.
4. Геометрическая фигура, которую напоминает пространственное строение молекулы
метана.
5. Трихлорметан.
6. Название радикала С2Н5–.
7. Наиболее характерный вид реакций для алканов.
8. Агрегатное состояние первых четырех представителей алканов при нормальных
условиях.
Если
вы правильно ответили на вопросы, то в выделенном столбце по вертикали получите
одно из названий предельных углеводородов. Назовите это слово?
Предельные углеводороды.
Предельные углеводороды — это
углеводороды, в молекулах которых имеются только простые (одинарные) связи (
-связи). Предельными углеводородами являются алканы и
циклоалканы.
Атомы углерода в предельных углеводородах находятся в состоянии sp3-гибридизации.
Алканы
Алканы — предельные углеводороды, состав
которых выражается общей формулой CnH2n+2. Алканы являются насыщенными
углеводородами.
Изомеры и гомологи
Г о м о л о г и | CH4 метан | ||||
CH3—CH3 этан | |||||
CH3—CH2—CH3 пропан | |||||
CH3—(CH2)2—CH3 бутан | 2-метилпропан | ||||
CH3—(CH2)3—CH3 пентан | 2-метилбутан | 2,2-диметилпропан | |||
CH3—(CH2)4—CH3 гексан | 2-метилпентан | 2,2-диметилбутан | 2,3-диметилбутан | 3-метилпентан | |
и з о м е р ы | |||||
Физические свойства алканов
При комнатной температуре С1-C4 — газы, C5-C15 — жидкости, C16 и следующие — твердые вещества; нерастворимы в воде; плотность меньше 1
г/см3; жидкие — с запахом бензина.
С увеличением числа атомов углерода в молекуле возрастает температура
кипения.
Химические свойства алканов
Малоактивны в обычных условиях, не
реагируют с растворами кислот и щелочей, не обесцвечивают раствор KMnO4 и бромную воду.
- Горение (окисление с разрывом связей C—C и C—H):
CH4 + 2O2
CO2 + 2H2O + Q - Замещение (с разрывом связей C—H):
а) галогенирование
(только с хлором и с бромом):
1-я стадия: CH4 + Cl2
CH3Cl + HCl (при нагревании
или на свету).
При достаточном
количестве галогена происходит дальнейшее замещение атомов водорода:
CH3Cl хлорметан | + Cl2 | CH2Cl2 дихлорметан | + HCl, |
CH2Cl2 + Cl2 | CHCl3 трихлорметан | + HCl, |
CHCl3 + Cl2 | CCl4 тетрахлорметан | + HCl. |
б) нитрование (реакция
Коновалова):
CH4 + HONO2 | CH3NO2 нитрометан | + H2O (при нагревании) |
Получение алканов
Лабораторные способы:
- Гидролиз карбида алюминия (получение метана): Al4C3 + 12H2O
4Al(OH)3 + 3CH4 - Реакция обмена: CH3COONa + NaOH
Na2CO3 + CH4 (при нагревании) - Реакция Вюрца: 2CH3Cl + 2Na
CH3—CH3 + 2NaCl
Промышленные способы:
- Выделение из природных источников (природного
газа, нефти, каменного угля, горючих сланцев). - Газификация твердого топлива: C + 2H2
CH4 (при нагревании под давлением в
присутствии Ni-катализатора)
Циклоалканы
Циклоалканы — предельные углеводороды, состав
которых выражается формулой CnH2n. В состав молекул циклоалканов входят замкнутые
углеродные цепи (циклы).
Изомеры и гомологи
Г о м о л о г и | Циклопропан C3H6 или | ||||
Циклобутан C4H8 или | Метилциклопропан | ||||
Циклопентан C5H10 или | Метилциклобутан | 1,1-диметил-циклопропан | 1,2-диметил-циклопропан | Этилциклопропан | |
И з о м е р ы | |||||
Упрощенно углеводородный цикл часто
изображают правильным многоугольником с соответствующим числом углов. Физические
свойства мало отличаются от свойств алканов.
Химические свойства
За исключением циклопропана и
циклобутана циклоалканы, как и алканы, малоактивны в обычных условиях.
Общие свойства циклоалканов (на примере
циклогексана):
1.
горение (окисление с разрывом связей C—C и C—H):
C6H12 + 9O2
6CO2 + 6H2O + Q
2.
замещение (галогенирование, нитрование):
C6H12 + Cl2
C6H11Cl + HCl (при нагревании или
на свету)
3.
присоединение (гидрирование):
C6H12 + H2
C6H14 (при нагревании под
давлением в присутствии Ni-катализатора)
4.
разложение (дегидрирование, крекинг, пиролиз):
C6H12
C6H6 + 3H2 (при
нагревании с катализатором).
Особые свойства циклопропана и
циклобутана (склонность к реакциям присоединения):
1.
галогенирование:
+ Br2
BrCH2—CH2—CH2Br
2.
гидрогалогенирование:
+ HBr
CH3—CH2—CH2Br
Способы получения циклоалканов
1.
Выделение из природных источников (нефть, природный газ).
2.
Дегидрирование алканов:
CH3—CH2—CH2—CH2—CH2—CH3 | + H2 |
3.
Дегалогенирование галогеналканов:
Br—CH2—CH2—CH2—CH2—Br | + ZnBr2 |
4.
Гидрирование ароматических углеводородов:
Алгоритм составления названий предельных углеводородов
- Найдите главную углеродную цепь: это самая
длинная цепь атомов углерода. - Пронумеруйте атомы углерода в главной цепи,
начиная с того конца, к которому ближе разветвление. - Укажите номер атома углерода в главной цепи, у
которого есть заместитель и дайте название заместителю. Если заместителей
несколько, расположите их по алфавиту. Перед названием одинаковых
заместителей укажите номера всех атомов углерода, с которыми они связаны,
и используйте умножающие приставки (ди-, три-, тетра-). - Напишите название главной цепи с суффиксом -ан.
Корни названий главной цепи: C1 — мет, С2 — эт, С3 — проп, C4 — бут, C5 — пент, C6 — гекс, С7 — гепт, C8 — окт, С9 — нон, C10 — дек. Названия незамещенных циклоалканов образуются из
названия предельного углеводорода с добавлением префикса цикло-. Если в
циклоалкане есть заместители, то атомы углерода в цикле нумеруются от
самого простого заместителя (самого старшего, метила) к более сложному
кратчайшим путем, и положения заместителей указываются так же, как и в
алканах.
Изучив тему, Вы должны
усвоить следующие понятия: предельные углеводороды – алканы, σ-связь. Вы должны
знать: общую формулы алканов, виды изомерии; номенклатурные правила для
углеводородов; типы реакций: горение, замещение (галогенирование), разложение
(дегидрирование, крекинг), способы получения алканов. Убедившись, что все
необходимое усвоено, переходите к выполнению заданий по теме. Желаем успехов.
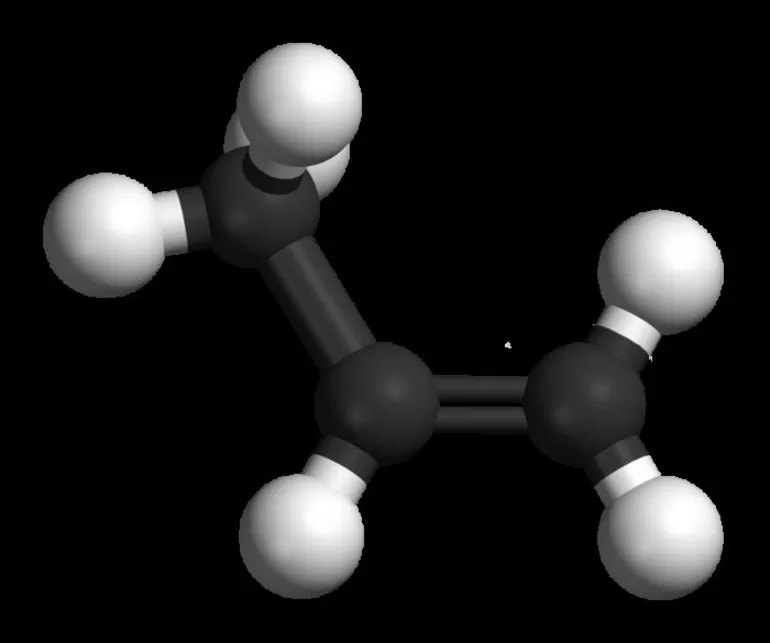
Общая классификация

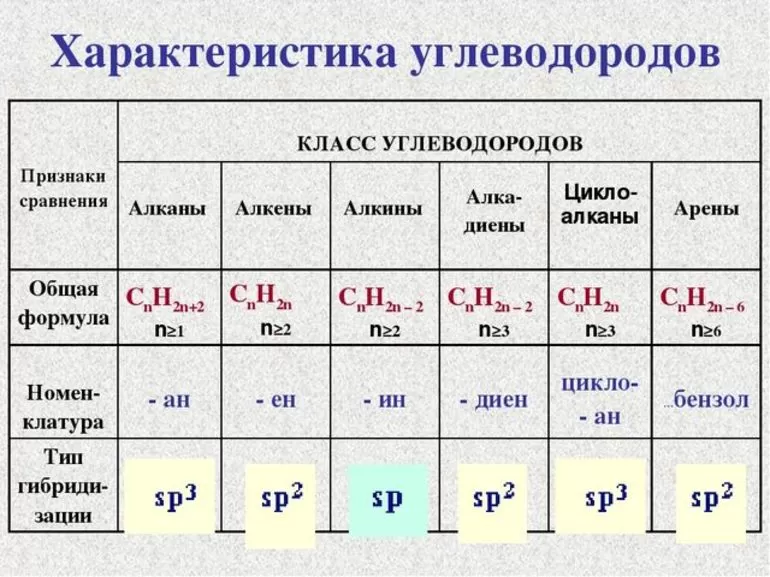
Общая формула предельных углеводородов — CnH2n+2. Если водород образует всего 1 связь, то у углерода их целых 4. Но это не свидетельствует о том, что между ними имеет место соотношение 1 к 4. Существуют не только одинарные, но и двойные, тройные связи между атомами углерода. По такому показателю выделяют классы углеводородов:
- Предельные. Их ещё называют алканами.
- Непредельные, или ненасыщенные алкены и алкины, соответственно, 2 и 3 связи.
Другая классификация относится к характеристикам молекул. В соответствии с ней выделяют углеводороды:
- алифатические;
- карбоциклические.
В первом случае вещества имеют линейную структуру, тогда как во втором они сформированы в виде замкнутой цепи. Карбоциклические подразделяются на ароматические и алициклические. Какие виды изомерии наблюдаются у предельных углеводородов:
- углеродного скелета;
- расположения кратной связи;
- так называемая геометрическая;
- межклассовая.
В отношении углеводородов имеет место и процесс полимеризации. Это ситуация, когда одинаковые молекулы соединяются. В итоге формируется материал, который совершенно не похож на базовый. Классический пример — полиэтилен. Для его получения используется стандартный этилен. Такое возможно, если приходится говорить о ненасыщенных углеводородах.
Отдельную категорию составляют структуры, относящиеся к непредельным. Новые атомы, непохожие на атомы водорода, притягивают новые атомы, пользуясь для этого свободными радикалами. В итоге формируются различные виды органических веществ. К ним можно отнести:
- эфиры;
- амины;
- спирты.
Наглядные примеры
Углеводороды объединяют обширный список веществ. Их рассматривают в школе на уроках химии за 9 класс. Для нахождения формулы этих соединений составляются специальные уравнения. Несмотря на довольно большую классификацию, следует обозначить основные классы и соединения, относящиеся к ним. Вот их названия:

- Предельные. К ним относят гексан, бутан, пропан, метан. В таблице предельных углеводородов представлено очень много веществ, и их список гораздо больше. В большинстве случаев приходится говорить о наиболее распространенных газах.
- Алкены, или как их еще называют, олефины объединяют бутен, пропилен, этилен.
- Алкины включают гексен, пентин, ацетилен.
- Алкадиены и алкадиины. Им соответствуют вещества с двойной и тройной связью, соответственно.
- Циклоалканы представляет собой разновидность углеводородов, у которых цепь имеет замкнутый вид.
Ко второму классу причисляют циклопентен и циклопропен. Существуют циклоалкины, которые не встречаются в естественных условиях. Учёные с давних пор пытаются создавать их искусственным путем. Достигнуть цели удалось только в начале прошлого века. В составе молекул циклоалканов присутствует от 8 атомов углерода. Если их будет меньше, соединение будет отличаться нестабильностью. Объясняется это значительным напряжением.
Ароматические углеводороды включают довольно простые соединения наподобие бензола. Также в эту категорию включены индол и нафталин.
Ключевые параметры
Углеводороды способны объединять большое количество различных соединений. Но если говорить об основных характеристиках, приходится отметить, что общего у них почти нет. Единственное, в чём они сходятся, это состав. Строение всегда отличное. Примечательным является их переход от газообразной формы к твёрдой. Они также могут переходить к нему из жидкого состояния. Происходит это сообразно увеличению числа атомов углерода в начале ряда. Другое сходство, которое можно обнаружить, это способность к горению. Одновременно с этим выделяется большое количество тепла, когда образуются вода и углекислый газ.
Структурные особенности
Алканы являются гомологами метана, то есть его производными. Молекулярная формула этого вещества записывается, как CH4. В случае если отнять от него атом водорода, удастся получить радикал (углеводородный остаток) CH3. В большинстве случаев в молекуле присутствует 4-валентный углерод. Соответственно, объединение двух радикалов приводит к формированию дополнительного представителя ряда гомологов этана C2H6. После отщепления атома гидрогена образуется радикал — этил. При объединении его с CH3 удается получить еще один гомолог — пропан.
Рассматривая структуру пропана, можно установить, что его основу составляет 2 разновидности атомов углерода. Это первичные и вторичные соединения. Любой первичный атом имеет связь с 1 атомом углерода. Если атом гидрогена отщепить от первичного атома пропана, будет сформирован первичный пропил. Объединение метила со вторичным пропилом способствует образованию различных вариантов других гомологов. Это может быть изобутан, имеющий широкую ветвь углеродной цепи либо стандартный бутан, у которого карбоновая цепь является прямой.
Метан представляет собой наиболее типичный вариант алканов. Так называемая сигма-связь характерна для этих соединений. Допустим, у метана присутствует 4 ковалентные связи. Отвечает за это 3 p- и 1 s-орбиталь. Атом углерода образует такие связи благодаря s-орбитали.
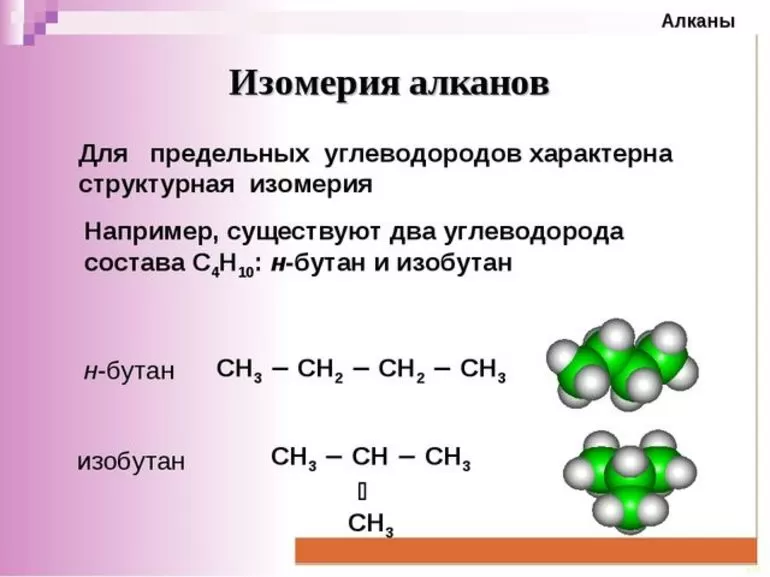
Изомерия и номенклатура
Чтобы определить формулы гомологов, в том числе бутана с его формулой C4H10, необходимо изучить явление изомерии. Что касается бутана, то за стабильность его формулы отвечают два различных соединения, тогда как в отношении формулы C5H12 их 3. Число изомеров постепенно увеличивается по мере повышения числа атомов углерода в молекулах алкана. 5 структурных формул, соответственно, присутствует в формуле C6H14. Если первые четыре соединения являются газами, то с 5 по 12 представлены жидкости. Вещества с 16 и далее имеют твердую структуру.
Химические свойства

Предельные углеводороды причисляются к группе инертных веществ. Это можно объяснить сигма-связью атома водорода и углерода в алканах. Вот почему они не способны притягивать к себе атомы водорода. Вещества могут вступать в реакции расщепления, дегидрирования, нитрирования. Также они принимают участие в процессе радикального галогенирования. В последнем случае молекулы галогенов с лёгкостью могут замещать таковые у гидрогена в составе алкана. Процесс нитрования приводит к тому, что водород во вторичных и третичных соединениях замещается нитрогруппой.
Несколько сложнее этот процесс проходит в случае с первичными и вторичными атомами.
Предельные углеводороды используются в производстве органических веществ различных видов. Непредельные получаются после отсоединения атома водорода от них.
Естественные источники
Помимо синтетических соединений, встречаются и природные источники углеводородов. Они присутствуют в почве в виде залежей. Большую часть нефти и газа составляют именно углеводороды. При обработке нефти это хорошо прослеживается. Во время такого процесса отмечается выделение большого количества веществ, относящихся к углеводородам. В составе газа и вовсе присутствует до 97% метана. Это вещество формируется при разложении органических отходов. Соответственно, чтобы получить его, не приходится прикладывать значительных усилий.
Получить углеводороды можно и в условиях лаборатории. Есть соединения, которые невозможно увидеть в природе. Их добывают синтетическим путем, проводя специальные химические реакции.
Ароматические соединения
Это отдельный гомологический ряд, который имеет формулу СпН2п-6. Такие углеводороды способны вступать практически в любые реакции присоединения: галогенирование, гибридизация и т. д. Многочисленные эксперименты, проведённые в их отношении, показали небольшую химическую активность бензола — классического представителя этой категории. Он демонстрирует увеличение стойкости к окислению. Присоединение становится возможным для него при доступе к ультрафиолетовым лучам. Пребывание в ср2-гибридном состоянии является характерной особенностью бензола. Углеродные атомы находятся в единой плоскости.
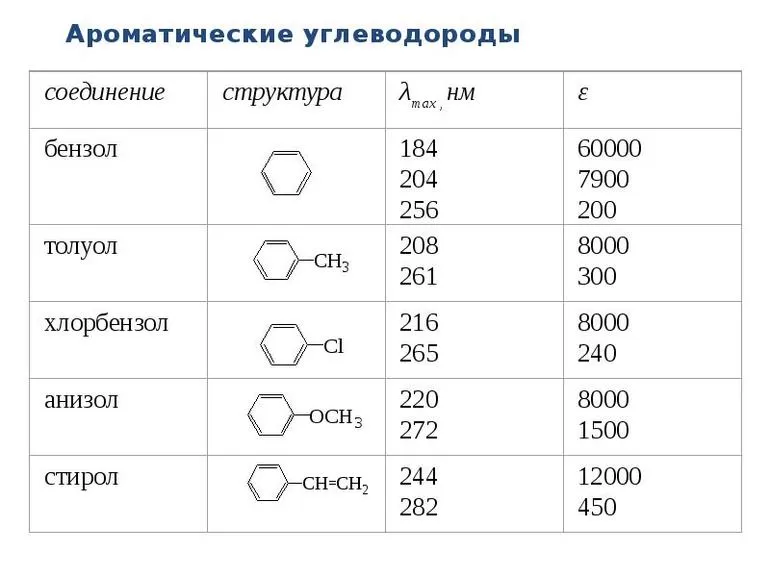
Выделяют чётные и нечётные представителей этого класса. Их нумерация идёт по часовой стрелке, когда выделяют наиболее старших и наиболее младших заместителей. Четные варианты — 2 и 6 обозначают как ортоположения, 3 и 5, то есть нечетное, это метаварианты.
В большинстве случаев это жидкости, обладающие неприятным запахом и запрещённые к использованию без специализированной защиты. Они недостаточно хорошо растворяются в воде, но хорошо реагируют на органические растворители. Мало реагируют они и на кислоты. В смесях с добавлением соли одноосновных кислот органического происхождения вещества распадаются на ионы.
Бензол и другие ароматические углеводороды получают в промышленных условиях. Примером является каменноугольная смола. Ее и другие вещества аналогичного класса получают:
- через отщепление атома водорода от циклопарафинов;
- посредством ароматизации алканов.
Сфера применения
Углеводороды очень важны для полноценного ведения деятельности человека. Применение предельных углеводородов разнообразно. Наиболее ценными ресурсами считаются газ и нефть. Они применяются в качестве энергоносителей и топлива. Но это далеко не полный список всех способов применения веществ этого класса. Углеводороды окружают человека практически всюду. Посредством полимеризации удаётся формировать новые вещества, служащие основой для различных типов тканей, пластмасс. Также необходимо выделить в особую категорию бензин, прочие продукты нефтепереработки, а также лакокрасочные изделия, асфальт, керосин.
Современное общество не может обойтись как без предельных, так и непредельных углеводородов. Несмотря на то что запасы нефти уменьшаются с каждым годом, отказаться от их применения по-прежнему невозможно. Правда, ученые активно занимаются поисками альтернативных источников углеводородов. С другой стороны, той же универсальности применения и эффективности не смог показать ни один из них.
