По каким свойствам простые вещества подразделяются на металлы и неметаллы

Неорганические вещества по составу делят на простые и сложные.
Простые вещества состоят из атомов одного химического элемента и подразделяются на металлы, неметаллы, благородные газы. Сложные вещества состоят из атомов разных элементов, химически связанных друг с другом.
Сложные неорганические вещества по составу и свойствам распределяют по следующим важнейшим классам: оксиды, основания, кислоты, амфотерные гндроксиды, соли.
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых — кислород со степенью окисления (—2),
Общая формула оксидов: ЭmОn, где m — число атомов элемента Э, а n — число атомов кислорода. Оксиды, в свою очередь, классифицируют на солеобразующие и несолеобрадующие. Солеобразующие делятся на основные, амфотерные, кислотные, которым соответствуют основания, амфотерные гидроксиды, кислоты соответственно.
Основания— это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп (-ОН).
Общая формула оснований: М(ОНу, где у — число гидроксогрупп, равное степени окислении металла М (как правило, +1 и +2).
Основания делятся на растворимые (щелочи) и нерастворимые (подробнее в § 21).
Кислоты — это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металла, и кислотных остатков.
Общая формула кислот: НхАс, где Ас — кислотный остаток (от английского «acid» — кислота), х — число атомов водорода, равное заряду иона кислотного остатка (подробнее см. § 20).
Амфотерные гидроксиды— это сложные вещества, которые проявляют и свойства кислот, и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать и в форме кислот, и в форме оснований (см. также § 22).
Соли — это сложные вещества, состоящие из катионов металла и анионов кислотных остатков.
Такое определение относится к средним солям.
Средние соли— это продукты полного замещения ато мое водорода в молекуле кислоты атомами металла или полного замещения гидроксогрупп в молекуле основания кислотными остатками.
Кислыесоли— это продукты неполного замещения атомов водорода в молекулах мноеоосновных кислот атомами металла.
Основные соли— это продукты неполно/о замещения гидрокеогрупп в многокислотных основаниях кислотны ми остатками.
Помимо средних, кислых, основных солей вы встречались с солями более сложного строения.
Металлы
В периодической системе элементы, которые в виде простых в-в проявляют св-ва металлов, находятся в I, II, III (кроме бора) группах, в побочных подгруппах всех групп. Металлы по численности превосходят неметаллы.
От периода к периоду число металлов, составляющих главные подгруппы, увеличивается. Это связано с тем, что от периода к периоду радиус атома , как правило, увеличивается, поэтому внешние электроны становятся более свободными. Это в значительной мере и определяет, будет элемент металлом или нет. Например, во втором периоде имеется только два металла – литий и бериллий; в состав третьего периода входит три металла – натрий, магний, алюминий. Эту закономерность среди элементов главных подгрупп можно продолжить.
Особенностью строения атомов металлов является небольшое число электронов во внешнем электронном слое, как правило, не превышающее трёх. Все элементы побочных подгрупп – металлы, они имеют на внешнем слое, как правило, 1-2 электрона, это во многом определяет их св-ва.
Атомы металлов, имеющие обычно большие радиусы и малое число электронов во внешнем электронном слое, находятся в главных подгруппах I и II групп. Они наиболее активны, т.е.их атомы легко отдают электроны и являются хорошими восстановителями. В качестве примера можно привести схему строения (электронные формулы) некоторых металлов.
11Na 2, 8, 1; 19K 2, 8, 8, 1; 20Ca 2, 8, 8, 2
1s22s22p63s1 1s22s22p63s23p63s1 1s22s22p63s23p63s2
Итак, строение атомов металлов определяет их св-ва как восстановителей. (Восстановители – это элементы, повышающие его степень окисления в процессе р-ции. Это происходит вследствие отдачи электронов окислителями.)
Восстановительные св-ва металлов проявляются в р-циях: а) с неметаллами; б) с кислотами; в) с водой; г) с солями.
а) Многие металлы реагируют с галогенами, кислородом, серой и другими простыми веществами-неметаллами.
2Ca + O2 = 2CaO
Cu + Cl2=CuCl2
Fe + S = FeS
б) Металлы, стоящие в ряду напряжений до водорода, реагируют с растворами соляной и серной кислот с выделением водорода. В этих р-циях металлы выступают как восстановители, а ион водорода как окислитель:
Zn + 2HCl = ZnCl2 + H2
Mg + H2SO4(p-p) = MgSO4 + H2
в) Реакция с водой, приводящая к образованию щелочи, характерна для щелочных металлов, кальция, бария и других металлов, основания которых растворимы в воде:
2Na +2H2O =2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
г) В р-цию замещения с солями металлы вступают в соответствии с рядом напряжений.
Fe + CuCl2 =Cu + FeCl2
В этих р-циях восстановителем является вступающий в реакцию, а окислителем – катион, который входит в состав соли.
Реакции металлов как с простыми, так и со сложными в-вами относятся к о.-в. р-циям. Их сущность можно выразить в общем виде:
Ме –n.е = Ме n+
В таблице ПС хим элементов неметаллы находятся в главных подгруппах VI, V, IV групп, бор принадлежит III группе.
К неметаллам также относят и особое семейство инертных элементов VIII группы. В виде простых в-в они называются газами, состоят из одиночных атомов, находятся в воздухе.
В соответствии с периодическим законом в периоде от элемент к элементу неметаллические св-ва усиливаются; в группе же по мере увеличения порядкового номера атомов наблюдается ослабление неметаллических св-в элементов. В связи с этим от периода к периоду число неметаллов сокращается. Эта закономерность объясняется тем, что радиус атома увеличивается, внешние электроны становятся более свободными, что в значительной мере и определяет, будет элемент металлом или нет.
На внешнем электронном слое у неметаллов находиться от 3-х до 8-ми электронов. Например, у бора на внешнем электронном слое находится три электрона:
у углерода – четыре:
И так от группы к группе число внешних электронов увеличивается вплоть до 8-ми у неона:
Т.о., номер группы равен числу электронов, находящихся на внешнем электронном слое. Это определяет и значение высшей степени окисления элементов. Так у бора она равна+3, у углерода — +4 и т.д. В одном и том же периоде по мере увеличения порядковых (атомных) номеров увеличиваются заряды атомных ядер, число электронов на внешнем слое. Число электронных слоёв в атомах остаётся постоянным, а радиус атома уменьшается за счёт притяжения электронов к ядрам, заряд которых возрастает.
Сравним строение атомов подгруппы кислорода: 8О 2,6(1s22s22p4);
16S 2,8,6,(1s22s22p63s23p4).
Вывод: у металлов одной и той же подгруппы по мере увеличения порядковых номеров увеличиваются заряды атомных ядер, число электронных слоёв в атомах, радиус атома за счёт увеличения электронных слоёв: остаётся постоянным число электронов на внешнем слое атомов.
Усиление неметаллических св-в у элементов происходит закономерно в зависимости от способности атомов принимать электроны от других атомов. Таких возможностей больше у тех элементов, у которых больше заряд атомного ядра, больше электронов во внешнем слое и меньше радиус атома.
Это подтверждает изменение о.-в. св-в простых в-в, образованных химическими элементами подгруппы кислорода.
В подгруппе по мере увеличения атомного номера происходит уменьшение электроотрицательности элементов.
Атомы кислорода и серы, как простых веществ-окислителей могут принимать два электрона от других атомов, при этом их внешний электронный слой будет завершенным, таким же, как у инертного газа неона.
Нет (кроме F фтора) более сильного окислителя, чем кислород. В качестве окислителя он выступает в реакциях с металлами, неметаллами и сложными в-вами.
Степень окисления кислорода уменьшается от 0 до -2.
Сера тоже окислитель, но менее сильный, чем кислород. У неё электроотрицательность атомов существенно меньше, чем у кислорода, поэтому для этого элемента характерен больший разброс значений степеней окисления (-2, 0, +4, +6).
Дата добавления: 2015-04-21; просмотров: 26; Нарушение авторских прав
Все химические элементы условно можно разделить на неметаллы и металлы. Знаете ли вы, по каким признакам они отличаются? Как определить их положение в таблице химических элементов? На эти и другие вопросы вы найдете ответы в нашей статье.
Положение неметаллов и металлов: таблица Менделеева
По внешним признакам и физическим свойствам не всегда можно выяснить, к какой группе относится химический элемент. Свойства металлов и неметаллов можно определить по расположению в периодической таблице.
Для этого нужно зрительно провести диагональ от бора до астата, от 5 до 85 номера. В правом верхнем углу будут преимущественно находиться неметаллы. Их в таблице меньшинство, всего 22 элемента. Металлы находятся в правой части периодической таблицы наверху — в основном в I, II и III группах.
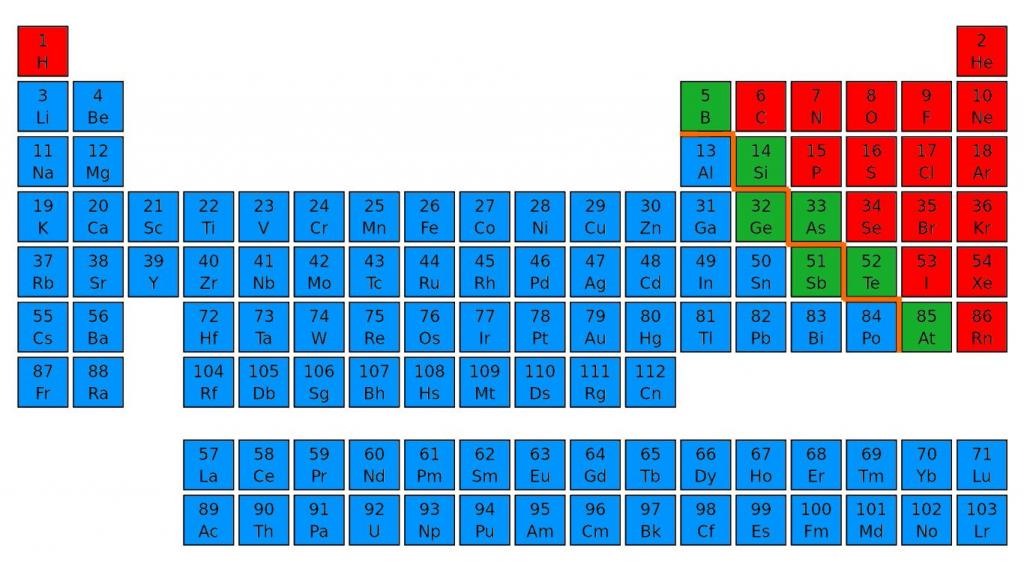
Энергетический уровень
Отличия неметаллов и металлов первоначально обусловлены строением их атомов. Начнем с количества электронов на внешнем энергетическом уровне. У атомов металлов оно варьирует от одного до трех. Как правило, они обладают большим радиусом, поэтому атомы металлов достаточно легко отдают наружные электроны, так как имеют сильные восстановительные свойства.
У неметаллов число электронов на внешнем уровне больше. Это объясняет их окислительную активность. Неметаллы присоединяют недостающие электроны, полностью заполняя энергетический уровень. Самые сильные окислительные свойства проявляют неметаллы второго и третьего периода VI-VII групп.
Заполненный энергетический уровень содержит 8 электронов. Самой большой окислительной способностью обладают галогены с валентностью I. Среди них лидирует фтор, так как у этого элемента нет свободных орбиталей.

Строение металлов и неметаллов: кристаллические решетки
Физические свойства веществ определяются порядком расположения элементарных частиц. Если условно соединить их воображаемыми линиями, то получится структура, которая называется кристаллической решеткой. В ее узлах могут находиться разные структуры: атомы, молекулы или заряженные частицы — ионы.
У некоторых неметаллов формируется атомная кристаллическая решетка, частицы которой соединены ковалентными связями. Вещества с таким строением твердые и нелетучие. К примеру, фосфор, кремний и графит.
В молекулярной кристаллической решетке связь между элементарными частицами слабее. Обычно подобные неметаллы находятся в жидком или газообразном агрегатном состоянии, но в некоторых случаях — это твердые легкоплавкие неметаллы.
В любом образце металла часть атомов теряет наружные электроны. При этом они превращаются в положительно заряженные частицы — катионы. Последние снова соединяются с электронами, образуя нейтрально заряженные частицы — в металлической решетке одновременно находятся катионы, электроны и атомы.

Физические свойства
Начнем с агрегатного состояния. Традиционно принято считать, что все металлы — твердые вещества. Исключением является только ртуть, тягучая жидкость серебристого цвета. Ее пары являются контаминантом — токсичным веществом, вызывающим отравление организма.
Еще одна характерная черта — металлический блеск, который объясняется тем, что поверхность металла отражает световые лучи. Еще одна важная особенность — электро- и теплопроводность. Это свойство обусловлено наличием в металлических решетках свободных электронов, которые в электрическом поле начинают двигаться направленно. Лучше всех проводит тепло и ток ртуть, наименьшими показателями обладает серебро.
Металлическая связь обусловливает ковкость и пластичность. По этим показателям лидирует золото, из которого можно раскатать лист толщиной в человеческий волос.
Чаще всего физические свойства металлов и неметаллов противоположны. Так, последние характеризуются невысокими показателями электро- и теплопроводности, отсутствием металлического блеска. При обычных условиях неметаллы находятся в газообразном или жидком состоянии, а твердые всегда хрупкие и легкоплавкие, что объясняется молекулярным строением неметаллов. Алмаз, красный фосфор и кремний — тугоплавкие и нелетучие, это вещества с немолекулярным строением.

Что такое полуметаллы
В периодической таблице между металлами и неметаллами находится ряд химических элементов, которые занимают промежуточное положение. Их называют полуметаллами. Атомы полуметаллов связаны ковалентной химической связью.
Эти вещества совмещают признаки металлов и неметаллов. К примеру, сурьма является кристаллическим веществом серебристо-белого цвета и вступает в реакцию с кислотами, образуя соли — типичные металлические свойства. С другой стороны, сурьма — очень хрупкое вещество, которое не поддается ковке, а измельчить его можно даже вручную.
Итак, типичные неметаллы и металлы обладают противоположными свойствами, но деление это достаточно условно, поскольку ряд веществ сочетает в себе и те и другие признаки.
