По каким свойствам отличаются энантиомеры
Проблема многих студентов химии, изучающих стереохимию, возникает в различие между энантиомерами и диастереомерами. Это обычные молекулярные соединения с различными характеристиками, несмотря на то, что они представляют собой стереоизомеры — соединения с той же молекулярной и структурной формулой, но с различной ориентацией атомов. В этой статье мы расскажем о различии между этими двумя общими соединениями, чтобы просветить вас.
Во-первых, что такое стереохимия? Это исследование пространственного расположения атомов в соединении. Энантиомеры и диастереомеры являются частью стереоизомеров — той же структурной и молекулярной формулы с различным расположением атомов в каждой. Следует отметить, что стереоизомеры могут включать множество соединений, кроме энантиомеров и диастереомеров. Они могут включать конформеры и атропизомеры. В частности, мы фокусируемся на диастереомерах и энантиомерах.
Что такое энантиомеры?
Это хиральные молекулы, которые являются зеркальными изображениями друг друга и не являются наложенными друг на друга. Хиральная молекула имеет изображение, которое не совпадает с его зеркальным отображением, и оно обычно характеризуется углеродным центром с 4-мя различными атомами, связанными с ним. Эти атомы должны быть химически различимы для того, чтобы молекула квалифицировалась как хиральный и, следовательно, энантиомер. Тетраэдрический углерод, к которому присоединены различные атомы, называется стереоцентром. См. Разницу ниже между углеродом, который считается хиральным, а другой — не квалифицированным.
Рисунок 1: Иллюстрация хиральной и нехиральной молекулы [1]
Поскольку существует незначительная разница в пространственном расположении атомов молекул энантиомера, Кан-Ингольд-Прелог была создана система именования. Две молекулы имеют одинаковую формулу и структурирование атомов, поэтому для их идентификации мы должны обозначить один S и другой R, в зависимости от конфигурации атомов по часовой стрелке от самой низкой атомной массы до самой высокой атомной массы. Например, стереоцентр Углерод с бромом, хлором, фтором и водородом, прикрепленный соответственно по часовой стрелке, молекуле будет назначаться R, а если против часовой стрелки, молекуле будет присвоено значение S, поскольку бром имеет самую высокую атомную массу и водород — самый низкий.
Расположение этих атомов фактически помогает определить свойства молекулы. Рассмотрим структуры бромхлорфторметана ниже:
Очевидно, что ориентация водорода и фтора отличается от ориентации того же молекулярного соединения. Независимо от того, сколько раз вы можете вращать правую молекулу, она никогда не будет иметь такую же ориентацию, как левая молекула. Если, например, вы попытаетесь обменять Фтор и Водород вокруг, Бром и Хлор также изменят свои позиции. Это ясно объясняет концепции неперемещаемых и зеркальных изображений энантиомеров.
Для обозначения молекул хиральному (стереоцентру) присваивается буква S или R. Составляющие, таким образом, фтор, хлор, бром, помечены от высокой до низкой атомной массы, назначая 1, 2, 3. Бром является самым высоким, поэтому 1, Хлор 2 и Фтор 3. Если вращение составляет 1 — 3 по часовой стрелке, тогда хиральный центр обозначается R, если против часовой стрелки, то S. Таким образом, система Cahn-Ingold-Prelog работает с тем, чтобы отличить энантиомеры от каждого Другой. Это становится простым, когда мы работаем с одним хиральным центром с 4 уникальными заместителями, прикрепленными к нему. Энантиомер может иметь более 2 хиральных центров.
Молекулы энантиомеров различаются по пространственному расположению атомов, но обладают одинаковыми химическими и физическими свойствами. Тем не менее, они имеют те же точки плавления, точки кипения и многие другие свойства. Их межмолекулярные силы идентичны — это объясняет те же свойства. Но их оптические свойства различны, поскольку они вращают поляризованный свет в противоположных направлениях, хотя в равных количествах. Это различие в оптических свойствах отличает молекулы энантиомера.
Что такое диастереомеры?
Это стереоизомерные соединения с молекулами, которые не являются зеркальными изображениями друг друга и которые не являются наложенными друг на друга. Прекрасным примером диастереомеров является то, когда вы смотрите на структуры цис и транс-изомер. См. Цис-2-бутен и транс-2-бутен структуры ниже:
Соединения идентичны, но расположение отличается, и они не являются зеркальными изображениями друг друга. Когда CH3 находятся на одной стороне, соединение представляет собой цис и когда другой заменяется атомом водорода, назовем соединение сделка Но цис а также транс структуры не являются единственными примерами диастереомеров. Есть много таких молекул, пока они демонстрируют пространственные расположения атомов, которые не являются зеркальными изображениями друг друга, и которые не являются суммируемыми.
В отличие от энантиомеров диастереомеры обладают различными физическими и химическими свойствами. Диастереомеры имеют два стереоцентра, в которых другая молекулярная структура может имитировать конфигурации энантиомера, в то время как другая имеет одинаковую конфигурацию. Это то, что отличает их от энантиомеров, потому что эти структуры не могут быть зеркальными образами друг друга.
В приведенной ниже таблице будут выделены основные различия между энантиомерами и диастереомерами в двух словах:
| Энантиомеры | Диастереомеры |
| Они являются зеркальными изображениями друг друга и не являются наложенными друг на друга | Они не являются зеркальными изображениями друг друга и не являются наложенными друг на друга |
| Их молекулярные структуры часто проектируются с R и S, чтобы отличить их. | Одна молекула имитирует энантиомерные структуры, тогда как другая имеет такую же конфигурацию. Поэтому нет необходимости использовать именование для их дифференциации. |
| Обладать теми же химическими и физическими свойствами, но различными оптическими свойствами | Обладать различными химическими и физическими свойствами |
| Имейте один или несколько стереоцентров | Имеют два стереоцентра |
| Все энантиомеры обладают оптической активностью, хотя они вращают свет в противоположных направлениях. Те, которые вращают свет против часовой стрелки, известны как левовращающие, а те, вращающиеся по часовой стрелке, называются правовращающими. Но когда у другого есть одинаковое правовращательное и левовращательное количество вращения, он считается раскатной смесью и, следовательно, оптически неактивным. | Не все диастереомеры обладают оптической активностью |
Заворачивать!
Энантиомеры и диастереомеры представляют собой стереоизомеры с той же молекулярной и структурной формулой, но отличаются расположением / конфигурацией атомов, которые образуют их структуры. Мы видели, что молекулы энантиомера являются зеркальными изображениями друг друга, а диастереомеры не являются зеркальными изображениями. Обе молекулы не являются суммируемыми.
Энантиомеры обладают теми же химическими и физическими свойствами, но отличаются оптическими свойствами, поскольку некоторые вращают поляризованный свет в противоположных направлениях. С другой стороны, не все диастереомеры обладают оптической активностью.
Мы также видели, как именование структур энантиомеров разворачивается с помощью системы именования R и S, назначаемой на основе атомной массы заместителей, прикрепленных к хиральному центру. В диастереомерах только одна структура имеет конфигурацию R и S, в то время как другая имеет одинаковые конфигурации. Именно это отличает их от энантиомерных зеркальных изображений.
Относительная и абсолютная конфигурация. Определение абсолютной конфигурации стало возможным только с появлением современных физико-химических методов (рентгеноструктурного анализа) в 50-х годах. Однако нет необходимости устанавливать ее для каждого соединения. Можно охарактеризовать их путем сравнения конфигураций с абсолютной конфигурацией эталонных (ключевых) соединений, т. е. определить их относительную конфигурацию.
За такой эталон условно принят глицериновый альдегид, предложенный в 1906 г. Н.А. Розановым:
D- глицериновый L-глицериновый
альдегид альдегид
Считается, что все вещества, родственные глицериновому альдегиду по конфигурации хирального центра, т.е. с расположением групп – ОН, -NH2 , — Hal справа, относятся к D–ряду, слева – к L– ряду.
Например:
D — аминокислота L – аминокислота
Запомним, что D и L указывают на относительную конфигурацию молекулы. Познакомимся с некоторыми свойствами подобных молекул.
Хиральным соединениям свойственна способность вращать плоскость поляризованного света вправо (+) или влево (-), что называется оптической активностью. Отсюда и другое название энантиомеров – оптические изомеры.
Условиями оптической активности являются:
- Отсутствие плоскости симметрии (хиральность молекулы)
- Наличие в молекуле центров хиральности.
Мерой оптической активности является [a]D — удельное вращения; характеризует угол и направление вращения плоскости поляризованного света. Знак вращения (+) или (-) не связан с конфигурацией D и L и определяется только инструментально на приборе – поляриметре или сахариметре (для сахаров). Например,
D(-) –молочная D(+)- глицериновый
кислота альдегид
Многие биологически важные вещества содержат в молекуле более одного центра хиральности. Подсчет числа стереоизомеров производится по формуле N= 2n, где n – число хиральных центров.
Представителем соединений с двумя центрами хиральности служит винная кислота. Рассмотрим этот пример подробнее.
У винной кислоты n=2, т.е. N= 22 = 4.
1 2 3 4
1. D–винная кислота; 2. L-винная кислота; 3 и 4 – мезовинная кислота
1 и 2 – это энантиомеры (D и L). Они отличаются не по физическим и химическим свойствам, а только знаком вращения плоскости поляризованного света. Формулы 3 и 4 являются идентичными. Формулы 1 и 3, 2 и 3 являются пространственными изомерами, но не зеркальными, это диастереомеры. Они отличаются по физическим и химическим свойствам.
При отнесении энантиомеров к D– или L-ряду пользуются «оксикислотным ключом», т.е. сравнивают со стандартом тот хиральный центр, который остался без изменения при переходе от него. В данном случае это верхний хиральный центр (приведите путь превращения глицеринового альдегида в винную кислоту).
D– и L- энантиомеры проявляют оптическую активность. Мезовинная кислота – типичный пример молекулы, содержащей центры хиральности, но в целом являющейся ахиральной из-за наличия плоскости симметрии и потому не проявляющей оптическую активность.
Рацемат– это смесь равных количеств энантиомеров. Оптической активностью не обладает, вследствие компенсации вращения. Таким образом, у винной кислоты существуют 4 формы: 2 энантиомера (D- и L-), 1 мезо-форма и 1 рацемическая смесь. Рацемические смеси получаются синтетическим путем.
Поскольку природные источники не могут удовлетворить потребности современной биоорганической и биологической химии в разнообразных оптически активных соединениях, то либо расщепляют рацематы, либо ведут асимметрический синтез.
Существует несколько способов расщепления рацематов:
а) механический отбор кристаллов по их форме – исторически первый метод, примененный Луи Пастером;
б) биохимический (ферментативный) метод;
в) химический – через диастереомеры;
г) хроматографический на оптически активных сорбентах.
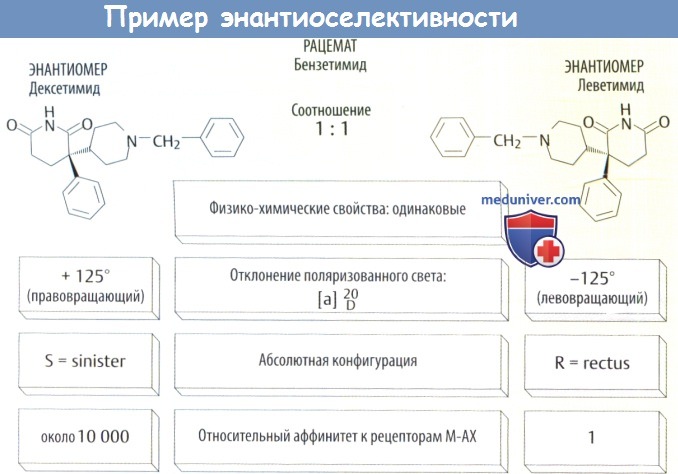
Энантиоселективность лекарства и энантиомеры
Многие лекарственные средства являются рацематами, в т. ч. бета-блокаторы, НПВС, а также холино-литик бензетимид. Рацемат состоит из молекулы и своего зеркального отражения, которые невозможно наложить друг на друга как правую и левую руки. Такие хиральные (соответствующие друг другу как правая и левая руки) пары молекул относятся к энантиомерам.
Как правило, хиральность придает 1 атом углерода, связанный с 4 разными заместителями (асимметричный атом углерода). Энантиомерность — отдельный случай стереоизомерности. Нехиральные стереоизомеры называются диастереомерами (хинидин/хинин).
Связи в энантиомерах, но необязательно в диастереомерах, одинаковой длины. Поэтому энантиомеры имеют одинаковые физико-химические свойства (растворимость, точка плавления), обе формы обычно получают в одинаковых количествах путем химического синтеза. Однако в результате ферментной активности в природе образуется лишь один из энантиомеров.
В растворе энантиомеры вращают плоскость колебания линейно плоскополяризованного света в противоположных направлениях, поэтому их называют правовращающими или левовращающими и обозначают d-, или (+), и /-, или (-) соответственно. Направление вращения ничего не говорит о структуре энантиомеров. Абсолютная конфигурация, согласно правилам, описывается префиксами (S) и (R). Некоторые вещества обозначаются как D- и L-формы с указанием структуры D- и L-глицеральдегида.
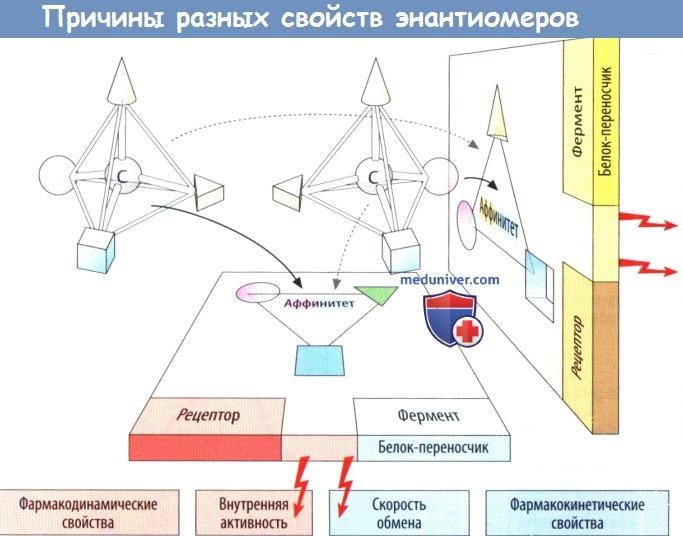
Биологические действия лекарственных средств развиваются при контакте со своими реагентами в организме. Реакция только с одним из энантиомеров свидетельствует об энантиоселективности.

а) Энантиоселективность аффинитета. Если у рецептора имеются участки для соединения с тремя заместителями (изображены на рис. В в виде конуса сферы и куба) на асимметричном атоме углерода, то для него оптимально подойдет лишь один из энантисмеров. Следовательно, у него будет более высокий аффинитет. Так, например, дексетимид обладает аффинитетом к мускариновым рецепторам ацетилхолина (АХ), который почти в 10 000 раз выше, чем у леветимида: а (S)(-)-пропранолол обладает аффинитетом к бета-адренорецепторам в 100 раз выше, чем (R)(+)-форма.
б) Энантиоселективность внутренней активности. Действие вещества также зависит от механизма связывания с рецептором и наличия внутренней активности, т. е. является ли оно агонистом или антагонистом. Например, (-)-добутамин — агонист бета-адренорецепторов, тогда как (+)-энантиомер относится к антагонистам.
Обратная энантиоселективность для другого рецептора. Энантиомер может иметь неблагоприятную конфигурацию на одном рецепторе, которая, тем не менее, может быть оптимальной для взаимодействия с другим рецептором. В случае с добутамином (+)-энантиомер обладает аффинитетом к бета-адренорецепторам в 10 раз выше, чем у (-)-энантиомера, но оба являются агонистами. Тем не менее стимулирующее действие на а-адренорецепторы связано с (-)-формой.
Как и при взаимодействиях с рецепторами, энантиоселективность лекарственных средств проявляется и при взаимодействиях с ферментами и белками-переносчиками. Энантиомеры могут отличаться по аффинитету и скорости реакции.
в) Вывод. Энантиомеры рацемата могут значительно отличаться по фармакодинамическим и фармакокинетическим свойствам, будучи двумя разными лекарственными веществами.
— Также рекомендуем «Виды рецепторов для воздействия лекарств»
Оглавление темы «Общая фармакология»:
- Лекарства агонисты и антагонисты рецепторов
- Энантиоселективность лекарства и энантиомеры
- Виды рецепторов для воздействия лекарств
- Механизм работы рецепторов сопряженных с G-белком
- Изменение концентрации лекарства в плазме и его эффект
- Причины нежелательных реакций и побочных эффектов лекарств
- Причины аллергии на лекарство и механизмы ее развития
- Причины покраснения кожи на лекарство и его механизмы
- Причины вреда лекарства при беременности и кормлении грудью
- Индивидуальная эффективность лекарств — фармакогенетика
В основе объяснения существования пространственных (конфигурационных) изомеров лежит теория Я. Вант-Гоффа и Ж. Ле Беля о тетраэдрическом строении атома углерода. При рассмотрении пространственной структуры органических соединений видно, что одна часть молекул обладает хиральностью, а другая ахиральна.
Ø Хиральность (от греч. cheir – рука) с точки зрения строения химических соединений – несовместимость пространственной структуры молекулы со своим зеркальным отображением.
Хиральные молекулы не имеют плоскости и центра симметрии, но могут иметь ось симметрии.
Ø Плоскость симметрии (s) проходит через молекулу так, что делит ее на две части, являющихся зеркальными отображениями друг друга.
Ø Ось симметрии n-порядка (Сn) – ось, проходящая через молекулу, при повороте вокруг которой на угол 360°/n структура совмещается в пространстве с исходным изображением.
плоскости и ось симметрии в молекуле дихлорметана
Ø Центр симметрии (i) – условная точка, равноудаленная от одинаковых атомов или групп атомов молекулы.
| центр симметрии в молекуле транс-1,3-дибром-транс-2,4-диметилциклобутана | плоскость симметрии в молекуле транс-1,3-дибром-цис-2,4-диметилциклобутана |
v Энантиомеры. Значительная часть хиральных молекул может существовать в виде двух неидентичных зеркальных отображений – энантиомеров. Энантиомеры также называют зеркальными изомерами.
Энантиомеры обладают одинаковым набором физико-химических констант, проявляют одинаковые химические свойства, но различаются по знаку оптического вращения. Поэтому в качестве синонима энантиомерам используют термин оптические изомеры. Другим существенным различием для многих энантиомеров является их разное поведение в биологических системах. Например, в начале главы мы упоминали об энантиомерных право- и левовращающих молочных кислотах, полученных в разных биохимических процессах. Структуры и константы этих соединений приведены ниже.
| D-молочная кислота т. пл. 53 °С, [a]D -2,6° (вода) | L-молочная кислота т. пл. 53 °С, [a]D +2,6° (вода) |
Рацемическая молочная кислота, являющаяся смесью равных количеств энантиомеров, оптически неактивна и имеет т. пл. 18 °С.
· Оптическая чистота. Исследователи не всегда имеют дело только с индивидуальными энантиомерами или рацематами. Часто вещество представляет собой смесь зеркальных изомеров с содержанием одного из компонентов меньше 100%, но больше 50%. В таких случаях говорят об оптической чистоте соединения. Определить оптическую чистоту (%) можно по формуле:
| оптическая чистота = | a смеси энантиомеров | × 100 |
| a чистого энантиомера |
При расчете оптической чистоты считают, что смесь состоит из чистого вещества и рацемата. Поэтому, если в смеси 10% энантиомера А и 90% энантиомера Б, то считают, что она состоит из 20% рацемата АБ и 80% чистого энантиомера Б, и, следовательно оптическая чистота смеси = 80%.
6.3.2. Основные причины хиральности молекул
Рассмотрим основные причины хиральности молекул органических соединений.
v Хиральный центр. Обычно хиральность связана с наличием хирального центра. Чаще всего в его качестве выступает асимметрический атом углерода. Однако хиральность проявляется и для имеющих тетраэдрическое строение четырезамещенных производных кремния, серы, азота, фосфора и ряда других элементов.
S-изомер S-изомер R-изомер
§ Хиральные свойства выявлены также и для ряда трехзамещенных производных серы и фосфора, которые в пространстве имеют структуру пирамиды. Конфигурацию этих соединений можно рассматривать и как тетраэдрическую, если в качестве четвертого заместителя учитывать р-орбиталь неподеленной электронной пары.
R-изомер S-изомер
§ Третичные амины также имеют пирамидальное строение, но они не обладают конфигурационной устойчивостью, так как происходит пирамидальная инверсия – быстрое обращение конфигурации. Специальными методами, например, введением заместителей с гетероатомами, содержащими пару неспаренных электронов, можно повысить устойчивость конфигурации и выделить индивидуальные энантиомеры.
пирамидальная инверсия аминов S-изомер
v Ось хиральности. Хиральными свойствами могут также обладать молекулы, не имеющие хирального центра, но которым присуща ось хиральности.
§ В качестве примеров соединений обладающих хиральной осью можно рассмотреть производные алленов – соединений, имеющих две двойные связи у одного атома углерода. Так как две p-связи в этих соединениях расположены во взаимно перпендикулярных плоскостях, то при наличии хотя бы по одному заместителю у концевых атомов углерода молекула может существовать в виде двух энантиомеров.
§ Такие же взаимно перпендикулярные плоскости существуют у замещенных циклоалканов с экзоциклической двойной связью и у спиросоединений – бициклических систем с одним общим углеродным атомом.
R-изомер S-изомер R -изомер
Так как у таких хиральных молекул существует четыре заместителя обеспечивающих несимметричность, то их конфигурацию можно обозначать с помощью R,S-номенклатуры. Для этого вначале определим старшинство ближних заместителей, а затем – дальних. Если старшинство 3 первых по старшинству заместителей уменьшается по часовой стрелке, то это R-изомер, если против – S-изомер.
§ Осью хиральности обладают также и ряд производных бифенила. Сама молекула этого углеводорода плоская. Взаимное отталкивание пространственно сближенных заместителей, введенных в положения 2,2’, приводит к повороту вокруг s-связи. Дополнительное введение функций в положения 6,6’ размещает циклы во взаимно перпендикулярных плоскостях. Если заместители в положениях 2,2’ и 6,6’ различны, то молекула может быть представлена в виде пары зеркальных изомеров. Такой тип стереоизомерии называют атропоизомерией. Аналогично алленовым производным конфигурация атропоизомеров обозначается в рамках R,S-номенклатуры.
S-изомер R -изомер
Ключевым моментом для реализации атропоизомерии является наличие стерических (пространственных) препятствий свободному вращению вокруг s-связи. Например, на отдельные стереоизомеры были разделены 2,2’-ди-трет-бутилбифенил и 1,1’-бинафтил, у которых объемные заместители в фенильных кольцах закрепляют конфигурацию молекул.
(R)-2,2’-ди-трет-бутилбифенил (S)-1,1’-бинафтил
v Плоскость хиральности. Для проявления этого варианта хиральности молекула должна иметь плоскостной фрагмент, обычно p-связь или ароматический цикл, и с одной стороны этой плоскости «заместитель». Типичными примерами таких соединений являются транс-циклоалкены, p-комплексы алкенов или аренов и циклические производные аренов.
§ В транс—циклоалкенах углеводородная цепь располагается над плоскостью двойной связи, что дает молекуле возможность существовать в виде двух энантиомеров.
R- и S-изомеры транс-циклооктена
§ Аналогично p-комплексы алкенов и аренов с производными металлов могут существовать в виде структур с неидентичными зеркальными отображениями.
R- и S-изомеры p-комплекса о-толуилового альдегида с трикарбонилом хрома
§ Циклические полиметиленовые эфиры гидрохинона называют анса-соединениями (от лат. ansa – ручка), так как из-за пространственных препятствий полиметиленовая цепь располагается перпендикулярно плоскости фенола. При наличии хотя бы одного заместителя в ароматическом цикле возможна реализация двух зеркальных конфигураций.
анса-соединение [2,2]-, [3,3]- и [4,4]-парациклофанкарбоновые кислоты
Существенную роль в устойчивости таких изомеров играет размер эфирного цикла. Так при n=8 соединение существует в виде двух энантиомеров, при n=9 нагрев выше 70 °С приводит к рацемизации вещества, а в случае n=10 можно вести речь только о конформационных изомерах, но не о конфигурации.
§ Подобное явление наблюдается и для парациклофанов – циклических систем, в которых два бензольных цикла сшиты двумя олигометиленовыми цепями. Для [2,2]- и [3,3]-парациклофанкарбоновых кислот с этиленовыми и триметиленовыми мостиками существуют зеркальные изомеры, а в случае [4,4]-парациклофанкарбоновой кислоты с тетраметиленовыми мостиками возможен оборот бензольного цикла вокруг оси и оптические антиподы не были выделены.
v Хиральная спираль. Структуры ряда соединений в пространстве образуют элементы спирали, которая может быть как левозакрученной, так и правозакрученной. Разберем несколько примеров структур с хиральной спиралью.
В конденсированном многоядерном ароматическом соединении гексагелицене концевые ароматические циклы из-за взаимного отталкивания не могут располагаться в одной плоскости, а размещаются друг над другом, закручивая структуру в спираль. Аналогично в 4,5-диметилфенантрене из-за стерических препятствий, создаваемых метильными группами, циклы выходят из одной плоскости, образуя фрагмент спирали. Данное соединение может быть разделено на индивидуальные энантиомеры, которые правда, легко рацемизируются.
гексагелицен 4,5-диметилфенантрен
Диастереомерия
Диастереомеры в отличие от энантиомеров имеют различные физические константы и часто отличаются по химическим свойствам. Они подразделяются на две основные группы:
§ p-диастереомеры, которые отличаются различным расположением заместителей относительно плоскости симметрии p-связи, и
§ s-диастереомеры, имеющие два или более асимметрических центра, или особого строения циклические производные.
v p-Диастереомерия (геометрическая изомерия). Алкены общей формулы RR1C=CR2R3 при условии R¹R1 и R2¹R3 могут существовать в виде диастереомеров (геометрических изомеров). Следует выделить два условия, необходимых для существования геометрических изомеров. Первое – наличие p-связи, препятствующей свободному вращению и, соответственно, переходу одного изомера в другой. Второе – нелинейность структуры, в результате чего заместители различным образом размещаются в пространстве.
Геометрические изомеры различаются по физико-химическим свойствам. Например, фумаровая и малеиновая кислоты имеют свой индивидуальный набор констант и, кроме того, малеиновая кислота способна образовывать циклические ангидриды, а фумаровая нет.
фумаровая кислота, т. пл. 296,4 °С малеиновая кислота, т. пл. 140 °С
Для обозначения конфигурации p-диастереомеров с достаточно простой структурой используют цис-,транс-номенклатуру, а для более сложных – E,Z-номенклатуру.
Этот тип изомерии также относится к другим соединениям, содержащим двойную связь, например, существуют геометрические изомеры относительно связи N=N у арилдиазотатов.
транс— и цис-фенилдиазотат калия
§ Син-,анти-изомерия. Связь С=N достаточно прочна и нелинейно связана с заместителями, что обеспечивает возможность существования p-диастереомеров для соединений с такой группировкой. Для обозначения конфигурации подобных соединений традиционно используют обозначения син— и анти-, которые аналогичны понятиям цис— и транс-.
| анти-конфигурация для азометина | син-конфигурация для оксима | анти -конфигурация для гидразона |
Следует учитывать, что для разных классов соединений обозначения син— и анти— относят к разным группировкам. Так, для азометинов оценивают взаимное расположение радикалов у связи С=N, а у оксимов и гидразонов сравнивают положение атома водорода у углерода и заместителя у атома азота.
v s-Диастереомерия. Типично проявление этого типа стереоизомерии для соединений, имеющих два и более асимметрических центра. Теоретическое количество стереоизомеров определяется по формуле N = 2n, где n – число асимметрических атомов. В число этих пространственных изомеров входят как энантиомеры, так и диастереомеры.
Традиционным являетсярассмотрение этого явления на примере молекулы винной кислоты НО2ССН(ОН)СН(ОН)СО2Н, содержащей два асимметрических атома углерода. Теоретическое количество стереоизомеров для этого соединения N = 22 = 4.
| (R,R)- или D-винная кислота, т. пл. 170 °С, [a]D +12 ° (Н2О) | (S,S)- или L-винная кислота, т. пл. 170 °С, [a]D -12 ° (Н2О) | (R,S)- или мезо-винная кислота, т. пл. 140 °С, [a]D 0 ° (Н2О) |
Рассмотрим возможные пространственные структуры для этого соединения. Левая пара представляет собой зеркальные изомеры. Первую из них обозначают как D-винную кислоту, так как оба асимметрических центра имеют D-конфигурацию*, или (R,R)-винную кислоту. Вторую, соответственно, как L- или (S,S)-винную кислоту. Как энантиомеры они отличаются только знаком вращения плоскополяризованного луча света.
Вторая пара проекций из-за наличия внутренней плоскости симметрии является идентичными изображениями и представляет собой мезо-форму винной кислоты. Мезо-винная кислота по отношению к D- или L-винной кислоте является s-диастереомером, со своим набором физико-химических констант. Так как верхняя и нижняя части молекулы являются зеркальными отображениями друг друга, то она оптически не активна.
Конфигурацию диастереомеров с двумя асимметрическими центрами также обозначают с помощью префиксов эритро— и трео-, для которых функциональные группы в проекции Фишера находятся, соответственно, по одну сторону или по разные. Эти конфигурационные обозначения вошли в состав ряда тривиальных названий, например, моносахариды треоза и эритроза, аминокислота треонин.
эритро— и трео-конфигурации D-эритроза D-треозаL-треонин
L-винная кислота, как продукт окисления соответствующего моносахарида, в этом случае называется D-треаровой, а мезо-винная кислота – эритраровой кислотой.
v Диастереомерия циклических производных. Дизамещенные циклоалканы с точки зрения стереохимии во многом подобны алкенам. Отсутствие свободного вращения вокруг s-связей и нелинейность молекулы приводит к возможности существования диастереомерных молекул. Для обозначения конфигурации таких молекул используют обозначения цис— и транс-.
1,4-цис— и 1,4-транс-дихлорциклогексаны
Следует особо отметить, что диастереомерными могут быть и ахиральные молекулы. Например, из двух диастереомеров: 1,4-транс-дихлорциклогексана и 1,4-цис-дихлорциклогексана, первая молекула имеет центр симметрии, а вторая – плоскость симметрии, следовательно, они ахиральны.
В свою очередь, 1,3-транс-дихлорциклогексан, который в отличие от 1,3-цис-дихлорциклогексана не имеет плоскости симметрии, – хирален и существует в виде двух энантиомеров.
1,3-цис— и 1,3-транс-дихлорциклогексаны
§ Еще одним примером цис-,транс-изомерии могут послужить конденсированные бициклоалканы.
цис— и транс-декалины
§ Более сложно обозначить конфигурацию трех- и более замещенных циклов. Вначале выбирается заместитель, относительно которого рассматривается расположение в пространстве других заместителей. В качестве точки отсчета берется или старшая по правилам ИЮПАК функциональная группа или заместитель с меньшим локантом. Обозначают такой центр буквой r.
| r-1,цис-2,транс-4-трихлорциклопентан | 2-транс-изопропил-5-цис-метилциклогексанол-1-r (l-ментол) |
§ Для описания конфигурации производных би- и полициклических систем используют префиксы экзо— (направление заместителей во внешнюю сферу молекулы) и эндо— (направление заместителей во внутреннюю сферу молекулы).
экзо— и эндо 1-хлорнорборнаны
§ В ряде случаев определения син— и анти— используют и для обозначения конфигурации соединений, не содержащих азота. Например, для производных норборнена конфигурация анти— показывает удаленное положение в пространстве функциональной группы относительно двойной связи, а син— – сближенное.
син— и анти 7-хлорнорборнены
§ Для обозначения конфигурации стероидных соединений – производных пергидроциклопетанофенантрена, имеющих тривиальные названия, используют a,b-систему. В этом случае полициклическую систему рассматривают как находящуюся в плоскости листа бумаги. Заместители, расположенные под плоскостью, обозначают символом a, а находящиеся над плоскостью – b.
| 5a-холестанол (дигидрохолестерин) | 5b-холестанол (копростерин) |
