Перечислите области применения важнейших альдегидов и кетонов на каких свойствах
Общая формула предельных альдегидов и кетонов CnH2nO. В названии альдегидов присутствует суффикс –аль.
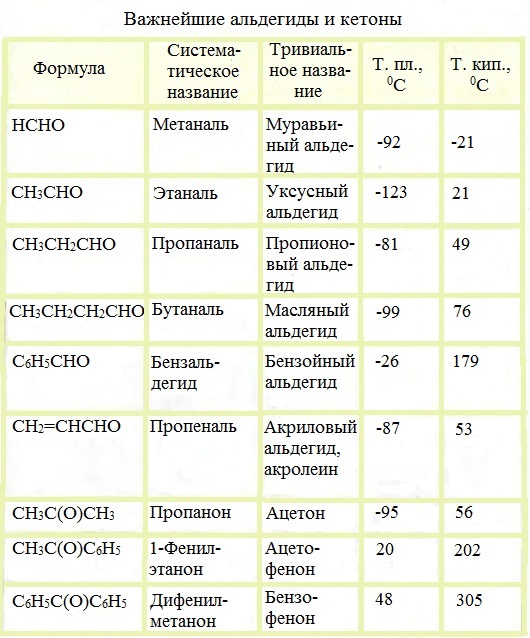
Простейшие представители альдегидов – формальдегид (муравьиный альдегид) –СН2 = О, ацетальдегид (уксусный альдегид) – СН3-СН = О. Существуют циклические альдегиды, например, циклогексан-карбальдегид; ароматические альдегиды имеют тривиальные названия – бензальдегид, ванилин.
Атом углерода в карбонильной группе находится в состоянии sp2-гибридизации и образует 3σ-связи (две связи С-Н и одну связь С-О). π-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием σ- и π-связей. Электронная плотность смещена в сторону атома кислорода.
Для альдегидов характерна изомерия углеродного скелета, а также межклассовая изомерия с кетонами:
СН3-СН2-СН2-СН = О (бутаналь);
СН3-СН(СН3)-СН = О (2-метилпентаналь);
СН3-С(СН2-СН3) = О (метилэтилкетон).
Химические свойства альдегидов
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; α-СН кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
1. Реакции присоединения:
— воды с образованием гем-диолов
R-CH = O + H2O ↔ R-CH(OH)-OH;
— спиртов с образованием полуацеталей
CH3-CH = O + C2H5OH ↔CH3-CH(OH)-O-C2H5;
— тиолов с образованием дитиоацеталей (в кислой среде)
CH3-CH = O + C2H5SH ↔ CH3-CH(SC2H5)-SC2H5 + H2O;
— гидросульфита натрия с образованием α-гидроксисульфонатов натрия
C2H5-CH = O + NaHSO3 ↔ C2H5-CH(OH)-SO3Na;
— аминов с образованием N-замещенных иминов (основания Шиффа)
C6H5CH = O + H2NC6H5 ↔ C6H5CH = NC6H5 + H2O;
— гидразинов с образованием гидразонов
CH3-CH = O +2HN-NH2 ↔ CH3-CH = N-NH2 + H2O;
— циановодородной кислоты с образованием нитрилов
CH3-CH = O + HCN ↔ CH3-CH(N)-OH;
— восстановление. При взаимодействии альдегидов с водородом получаются первичные спирты:
R-CH = O + H2 → R—CH2-OH;
2. Окисление
— реакция «серебряного зеркала» — окисление альдегидов аммиачным раствором оксида серебра
R-CH = O + Ag2O → R-CO-OH + 2Ag↓;
— окисление альдегидов гидроксидом меди (II), в результате которого выпадает осадок оксида меди (I) красного цвета
CH3-CH = O + 2Cu(OH)2 → CH3-COOH + Cu2O↓ + 2H2O;
Эти реакции являются качественными реакциями на альдегиды.
Физические свойства альдегидов
Первый представитель гомологического ряда альдегидов – формальдегид (муравьиный альдегид) – газообразное вещество (н.у.), альдегиды неразветвленного строения и состава С2-С12 – жидкости, С13 и длиннее – твердые вещества. Чем больше атомов углерода входит в состав неразветвленного альдегида, тем выше его температура кипения. С увеличением молекулярной массы альдегидов увеличиваются значения величин их вязкости, плотности и показателя преломления. Формальдегид и ацетальдегид способны смешиваться с водой в неограниченных количествах, однако, с ростом углеводородной цепи эта способность альдегидов снижается. Низшие альдегиды обладают резким запахом.
Получение альдегидов
Основные способы получения альдегидов:
— гидроформилирование алкенов. Эта реакция заключается в присоединении СО и водорода к алкену в присутствии карбонилов некоторых металлов VIII группы, например, октакарбонилдикобальта (Cо2(СО)8) Реакция проводится при нагревании до 130![]() С и давлении 300 атм
С и давлении 300 атм
СН3-СН = СН2 + СО +Н2 →СН3-СН2-СН2-СН = О + (СН3)2СНСН = О;
— гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей ртути (II) и в кислой среде:
НС≡СН + Н2О → СН3-СН = О;
— окисление первичных спиртов (реакция протекает при нагревании)
СН3-СН2-ОН + CuO → CH3-CH = O + Cu + H2O.
Применение альдегидов
Альдегиды нашли широкое применение в качестве сырья для синтеза различных продуктов. Так, из формальдегида (крупнотоннажное производство) получают различные смолы (фенол-формальдегидные и т.д.), лекарственные препараты (уротропин); ацетальдегид — сырье для синтеза уксусной кислоты, этанола, различных производных пиридина и т.д. Многие альдегиды (масляный, коричный и др.) используют в качестве ингредиентов в парфюмерии.
Примеры решения задач
Химические свойства альдегидов и кетонов
Альдегиды — химически активные соединения. Их высокая реакционная способность связана с наличием полярной связи С=О.
Запомни! Атом углерода несет частичный положительный заряд и может легко атаковаться нуклеофильными агентами. Атом кислорода, соответственно — отрицательный заряд, и будет подвергаться атаке электрофильными агентами.
Общие закономерности

Атом углерода карбонильной группы находится в состоянии $sp^2$-гибридизации, поэтому все $sigma$-связи при этом атоме углерода расположены в плоскости.
$pi$ -связь, образованная негибридными p-орбиталями атома углерода перпендикулярна этой плоскости и легко смещается в сторону более электроотрицательного атома кислорода. Карбонильная группа, представляющая собой реакционный центр в молекуле, влияет на реакционную способность соседних с ней атомов, особенно на $sigma$-связь $alpha$-звена (эффект сверхсопряжения). Для этой связи характерны реакции, протекающие с основаниями, приводящие к образованию карбаниона. Находясь в сопряженных системах карбонильная группа обладает значительным отрицательным мезомерным (-М) эффектом.
Исходя из электронного строения карбонильной группы в альдегидах и кетонах следует ожидать, что для этих соединений характерными будут реакции присоединения с атакой нуклеофила на атом углерода. Скорость взаимодействия карбонильного соединения с нуклеофильным реагентом должна быть тем больше, чем больше положительный заряд на атоме углерода карбонильной группы. Она зависит от многих факторов, таких как:
природа субстрата;
природа реагента;
природа катализатора и растворителя.
Альдегиды являются жёсткими основаниями Льюиса, поэтому атом кислорода в них может координироваться с сильными кислотами: $H^+, ZnCl_2, BF_3, AlCl_3$ и т. д. Химические свойства альдегидов аналогичны кетонам, однако альдегиды проявляют бо́льшую активность, что связано с большей поляризацией связи. Кроме того, для альдегидов характерны реакции, не характерные для кетонов, например гидратация в водном растворе. Наиболее важные свойства альдегидов и кетонов представлены на следующей схеме:

Реакции альдегидов по карбонильной группе
Для альдегидов характерны реакции нуклеофильного присоединения по атому углерода карбонильной группы. Это связано с особенностями ее строения и распределением зарядов (подробнее см. тему «Гомологические ряды альдегидов и кетонов«). С нуклеофильными реагентами альдегиды реагируют по следующей схеме:

При этом в общем механизм может быть представлен следующим образом:

Рассмотрим возможные типы реакций по карбонильной группе.
Реакции с кислородсодержащими нуклеофилами
1. Гидратация альдегидов. Альдегиды присоединяют воду по нуклеофильному механизму ($OH^-$ — нуклеофил), но образующиеся при гидратации 1,1-диолы неустойчивы, отщепляют молекулу воды и превращаются в исходные карбонильные соединения. Гидратация наблюдается в существенной степени лишь для низших альдегидов. Так, формальдегид образует устойчивый хлоральгдрат (гидрат формальдегида):

2. Подобным образом протекает и реакция присоединения спиртов по карбонильной группе, в результате которой образуются полуацетали. Под действием кислоты полуацеталь превращается в ацеталь:

Механизм превращения полуацеталя в ацеталь представлен на схеме и включает стадию образования карбкатиона (I), который стабилизируется за счет участия неподеленной пары электронов соседнего атома кислорода (+M-эффект группы $C_2H_5O$):

Реакции образования полуацеталей и ацеталей обратимы, так как в кислой среде происходит их гидролиз. В щелочной среде реакция становится необратимой.
Реакции с азотсодержащими нуклеофилами
1. Присоединение аминов и их производных. Амины и другие азотсодержащие соединения общей формулы $NH_2X$ (X = R, NHR) реагируют с альдегидами и кетонами в две стадии. На первой стадии образуются продукты нуклеофильного присоединения, которые затем вследствие неустойчивости отщепляют воду. В связи с этим данный процесс в целом классифицируют как реакцию присоединения-отщепления.

Реакции с углеродсодержащими нуклеофилами: полимеризация и конденсация
1. Реакция полимеризации. Образование полимеров можно рассматривать как результат нуклеофильной атаки атомом кислорода одной молекулы альдегида карбонильного атома углерода другой молекулы. Эти реакции свойственны в основном альдегидам. В присутствии каталитических количеств минеральных кислот альдегиды полимеризуются в линейные (формальдегид образует параформ) или циклические полимеры:


При нагревании с минеральными кислотами полимеры альдегидов распадаются на исходные продукты.
2. Реакция альдольной конденсации
Определение
Реакция конденсации — реакция, приводящая к возникновению новой углерод-углеродной связи, когда из двух или нескольких относительно простых молекул образуется новая, более сложная молекула.
Альдоль (от слов альдегид и алкоголь) — продукт реакции, содержащий одновременно гидроксильную и альдегидную группы,
Реакция образования альдоля — реакция альдольной конденсации, или альдольного присоединения.

Механизм альдольной конденсации заключается в отщеплении протона водорода из $alpha$-положения в карбонильном соединении под действием основания и образовании карбаниона с делокализованным отрицательным зарядом. Этот карбанион и является нуклеофильной частицей, которая атакует атом углерода карбонильной группы:

Окисление карбонильной группы
Окислению легко подвергается альдегидная группа. В зависимости от условий окисления альдегиды превращаются в соответствующие карбоновые кислоты или их соли. Окисление происходит под действием условного окислителя, чаще всего аммиачного раствора оксида серебра $Ag(NH_3)_2OH$, гидроксида меди (II) $Cu(OH)_2$ или перманганата калия $KMnO_4$.
Запомни! Реакции с оксидом серебра — реактивом Толленса (реакция «серебряного зеркала») и гидроксидом меди являются качественными реакциями на альдегидную группу.
При окислении альдегидной группы аммиачным раствором оксида серебра на поверхности сосуда выделяется металлическое серебро в виде тонкой пленки, отсюда название реакции — реакция «серебряного зеркала». Эта реакция используется в производстве зеркал.


При взаимодействии с гидроксидом меди альдегидная группа также окисляется до карбоксильной, а медь восстанавливается до Cu(I) и выпадает в виде закиси меди — осадка красно-бурого цвета, который при дальнейшем нагревании превращается в металлическую медь (реакция «медного зеркала»)


Кетоны к действию окислителей весьма устойчивы и окисляются лишь сильными окислителями при нагревании. Реакция имеет деструктивный характер: при окислении происходит разрыв С-С связи по обе стороны карбонильной группы:

Восстановление карбонильной группы
1. Альдегиды могут восстанавливаться до первичных спиртов, а кетоны — до вторичных спиртов.
В качестве восстановителей в реакциях восстановления используют молекулярный водород и гидридные комплексы алюминия и бора. В качестве катализаторов этих реакций используют $Ni, Pd, Pt, CuCrO$
2. При каталитическом восстановлении могут образовываться предельные УВ. Так, восстановление альдегидов амальгамированным цинком в соляной кислоте приводит к получению соответствующего алкана.
Замещение кислорода карбонильной группы на галогены
Атом кислорода карбонильной группы может быть замещен атомами галогенов при галогенировании соединениями фосфора, серы и др. — $PCl_5, SOCl_2$:
Реакции по углеводородному радикалу
1. Реакции галогенирования. Особенностью реакций галогенирования (в т.ч иодирования) галогенами — простыми веществами является замещение атомов водорода у $alpha$-углеродного атома при карбонильной группе:

В избытке галогена возможно замещение всех атомов водорода у $alpha$-углеродного атома. Скорость реакции не зависит от концентрации галогена, катализаторами реакции могут быть кислоты или основания.
особенности свойств кетонов
Напомним, что в кетонах карбонильная группа -С(О)- называется кетогруппой и соединена с двумя углеводородными радикалами (одинаковыми или разными). Подробнее см. тему «Гомологические ряды альдегидов и кетонов».
Физические свойства
Низшие кетоны – жидкости, высшие – твердые вещества. Низшие кетоны хорошо смешиваются с водой. Все кетоны хорошо растворимы в спирте и эфире. Плотность кетонов меньше 1. Подробно см. тему «Гомологические ряды альдегидов и кетонов»
Химические свойства
Запомни! Кетоны обладают некоторыми сходными с альдегидами свойствами, но менее активны.
1. Так кетоны с трудом, то есть в более жестких условиях, вступают в реакции нуклеофильного присоединения:

2. Галогенирование углеводородного радикала при карбонильной группе в $alpha$-положении у кетонов проходит так же как у альдегидов.
3. Замещение кислорода карбонила в ходе галогенирования соединениями фосфора и серы приводит к образованию геминальных дигалогеналканов:

4. Кетоны в отличие от альдегидов окисляются с большим трудом, то есть сильными окислителями при нагревании. При этом происходит окислительная деструкция с разрывом C-C-связей по обе стороны карбонильной группы и в общем случае получается смесь четырех карбоновых кислот:
5. Кетоны восстанавливаются до соответствующих вторичных спиртов:

или до соответствующих алканов (аналогично альдегидам).
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Температуры кипения кетонов несколько выше, чем у изомерных им альдегидов.
Метаналь (формальдегид) — газ, альдегиды С2–C5 и кетоны С3–С4 — жидкости, высшие карбонильные соединения — твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает. Ароматические карбонильные соединения в воде плохо растворимы.
Отличительной чертой многих альдегидов является их запах.
Низшие альдегиды имеют резкий запах (хотя при сильном разведении запах становится приятным и напоминает аромат плодов), у альдегидов, содержащих С4-С6 – неприятный запах, высшие альдегиды и кетоны обладают цветочными запахами. Альдегиды и кетоны хорошо растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные.
Альдегиды в природе
Альдегиды широко распространены в природе. Высшие альдегиды, особенно непредельные и ароматические входят в состав эфирных масел и содержатся в фруктах, плодах, цветах, душистых и пряных растениях. Их используют в пищевой промышленности и парфюмерии.
Человек давно использует лечебные свойства некоторых альдегидов. Пиродоксаль является одной из форм витамина В6.
В эфирных маслах аниса, акации, укропа, боярышника доминирует среди других «пахнущих» компонентов анисовый альдегид C8H8O2.
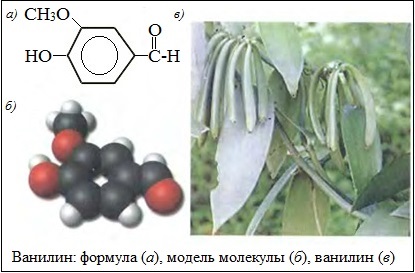
В плодах тропического растения ванили содержится ароматический альдегид ванилин (4-гидрокси-3-метоксибензальдегид) C8H8O3, который придает им характерный запах. Ванилин — кристаллическое вещество, хорошо растворяется в спирте, эфире, мало растворяется в воде.
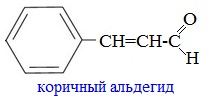 Коричный альдегид С6Н5СН=СНСНО содержится в масле корицы, его получают при обработке перегретым паром коры дерева корицы. Он обусловливает запах корицы, гвоздики.
Коричный альдегид С6Н5СН=СНСНО содержится в масле корицы, его получают при обработке перегретым паром коры дерева корицы. Он обусловливает запах корицы, гвоздики.
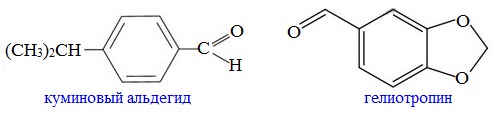
Куминовый альдегид С10Н12О содержится в масле тмина, гелиотропин (пиперональ) C8H6O3 – содержится в цветках гелиотропа и сирени.
 Пеларгоновый альдегид (нониловый альдегид, нонаналь) СН3(СН2)7СНО содержится в розовом и лимонном масле, в эфирных маслах цитрусовых растений. Пеларгоновый альдегид обладает запахом апельсина, его используют как пищевой ароматизатор.
Пеларгоновый альдегид (нониловый альдегид, нонаналь) СН3(СН2)7СНО содержится в розовом и лимонном масле, в эфирных маслах цитрусовых растений. Пеларгоновый альдегид обладает запахом апельсина, его используют как пищевой ароматизатор.
Альдегиды в природе

Физические свойства некоторых альдегидов
Формальдегид (муравьиный альдегид, метаналь) НСН=О – бесцветный газ с резким запахом, хорошо растворяется в воде, спиртах и полярных раствориелях. Иритант, токсичен!
Ирританты – группа веществ (слезоточивого или раздражающего действия), вызывающих раздражительные реакции при попадании на слизистые и кожу, и воздействии на дыхательные пути (респираторный эффект).
Формальдегид опасен для здоровья! 
Попадая в кровь, он уплотняет клеточную мембрану эритроцитов (красных кровяных клеток) настолько, что она теряет свои свойства, а ведь именно эритроциты снабжают клетки кислородом.
Водный 40%-ный раствор формальдегида называется формалином. Он обладает сильным дезинфицирующим действием и используется для хранения биологических препаратов.
Ацетальдегид (уксусный альдегид, этаналь) СН3СН=О – бесцветная легкокипящая жидкость, с резким запахом зеленой листвы. Хорошо растворяется в спирте, эфире, в воде растворяется неограниченно. Из-за очень низкой температуры кипения (210С) хранят и перевозят ацетальдегид в виде тримера – паральдегида.
Ирритант, очень токсичен! Он способен соединяться с белками и другими органическими соединениями в организме, подавляет дыхательные процессы в клетках.
Он является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Образуется при термической обработке полимеров и пластиков.
Акролеин (акриловый альдегид, пропеналь) СН2=CHCH=O – жидкость с резким неприятным запахом. Вследствие своей высокой реакционной способности акролеин является токсичным, сильно раздражающим слизистые оболочки глаз и дыхательных путей.
Он является одним из продуктов термического разложения глицерина и жиров-глицеридов, чем объясняется раздражающие слизистые оболочки свойства дыма горелых жиров. Подобный процесс наблюдается при пригорании жиров.
Он проявляет реакции, характерные для этиленовых углеводородов и альдегидов.
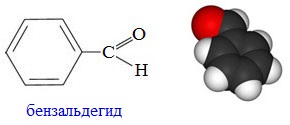
Бензальдегид(бензойный альдегид) C6H5CH=O – бесцветная маслянистая жидкость с запахом горького миндаля, плохо растворимая в воде, но хорошо растворимая в этаноле. Он содержится в миндале, листьях черемухи, косточках персиков, абрикосов, слив, в листьях лавровишен, в маслах нероли, цветов акации, апельсина, гиацинта, в эфирном масле эвкалипта. Бензальдегид легко окисляется на воздухе, образуя бензойную кислоту.

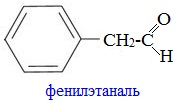
Фенилэтаналь (фенилуксусный альдегид) C6H5CH2CHO — бесцветная жидкость с сильным запахом гиацинта. По сравнению с бензальдегидом лучше соответствует рецептору цветочного запаха.
Кетоны в природе
Гептанон-2 С7Н14О представляет собой жидкость с гвоздичным запахом, обуславливает запах многих плодов и молочных продуктов.
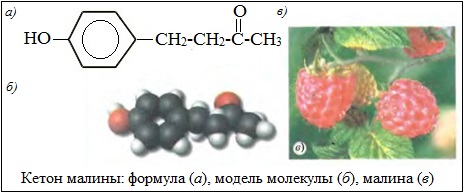
Гидроксифенилбутанон-2 (кетон малины) С10Н12О2 содержится в спелых ягодах малины. Его используют для придания вкуса и аромата в пищевой промышленности и включают в состав синтетических душистых композиций. Это один из самых дорогих компонентов, используемых в пищевой промышленности.
Физические свойства некоторых кетонов
Ацетофенон (метилфенилкетон) C6H5COCH3 — кристаллическое вещество, растворяется в спирте, эфире, бензоле, не растворяется в воде.
Бензофенон (дифенилкетон) (С6Н5)2С=О — кристаллическое вещество, растворимое в эфире, спирте, бензоле, нерастворимое в воде.
Физические характеристики альдегидов и кетонов
Альдегиды и кетоны
