Определите какое свойство молекул белка иллюстрирует рисунок
На данном уроке мы продолжим расширять и углублять знания о важнейших органических веществах клетки. На нем мы познакомимся с белками и аминокислотами. Рассмотрим уровни организации белковой молекулы, ее строение, сформируем знания о важной роли белков в органическом мире.
Белки
Среди органических соединений клетки белки являются наиболее важными. Содержание белков в клетке колеблется от 50 % до 80 %.
Белки – это высокомолекулярные органические соединения, которые состоят из углерода, водорода, кислорода, серы и азота. В состав некоторых белков входит фосфор, а также катионы металлов.
Белки являются биополимерами, которые состоят из мономеров аминокислот. Их молекулярная масса варьируется от нескольких тысяч до нескольких миллионов, в зависимости от количества аминокислотных остатков.
В состав белков входит всего 20 типов аминокислот из 170, найденных в живых организмах.
Аминокислоты
Аминокислоты (см. Рис. 1) – органические соединения, в молекулах которых одновременно присутствует аминогруппа () с основными свойствами и карбоксильная группа () с кислотными свойствами. Часть молекулы, называемая радикалом (R), у разных аминокислот имеет различное строение.
Рис. 1. Аминокислота
В зависимости от радикала аминокислоты делят на (см. Рис. 2):
1. кислые (в радикале карбоксильная группа);
2. основные (в радикале аминогруппа);
3. нейтральные (не имеют заряженных радикалов).
Рис. 2. Классификация аминокислот
Аминокислоты соединяются друг с другом посредством пептидной связи. Эта связь образуется путем выделения молекулы воды при взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой аминокислоты. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот-углеродная связь – пептидной связью.
Рис. 3. Дипептид
Соединения, образующиеся в результате конденсации двух аминокислот, представляют собой дипептид (см. Рис. 3). На одном конце его молекулы находится аминогруппа, а на другом – свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие молекулы. Если таким образом соединяется много аминокислот, то образуется полипептид (см. Рис. 4).
Рис. 4. Полипептид
Полипептидные цепи бывают очень длинными и могут состоять из различных аминокислот. В состав белковой молекулы может входить как одна полипептидная цепь, так и несколько таких цепей.
Многие животные, включая человека, в отличие от бактерий и растений не могут синтезировать все аминокислоты, которые составляют белковые молекулы. То есть существует ряд незаменимых аминокислот, которые должны поступать с пищей.
К незаменимым аминокислотам относятся: лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, тирозин, метионин.
Значение свободных аминокислот
Ежегодно в мире производится более двухсот тысяч тонн аминокислот, которые используются в практической деятельности человека. Они применяются в медицине, парфюмерии, косметике, сельском хозяйстве.
В большей степени производят глутаминовую кислоту и лизин, а также глицин и метионин.
Назначение аминокислот
1. Глутаминовая кислота
Используется в психиатрии (при эпилепсии, для лечения слабоумия и последствий родовых травм), в комплексной терапии язвенной болезни и при гипоксии. Также она улучшает вкус мясных продуктов.
2. Аспарагиновая кислота
Аспарагиновая кислота способствует повышению потребления кислорода сердечной мышцей. В кардиологии применяют панангин – препарат, содержащий аспартат калия и аспартат магния. Панангин применяют для лечения различного рода аритмий, а также ишемической болезни сердца.
3. Метионин
Защищает организм при отравлениях бактериальными эндотоксинами и некоторыми другими ядами, в связи с этим используется для защиты организма от токсикантов окружающей среды. Обладает радиопротекторными свойствами.
4. Глицин
Является медиатором торможения в центральной нервной системе. Используется как успокаивающее средство, применяется при лечении хронического алкоголизма.
5. Лизин
Основная пищевая и кормовая добавка. Используется в качестве антиоксидантов в пищевой промышленности (предотвращает порчу пищевых продуктов).
Пептиды
Отличие между белками и пептидами заключается в количестве аминокислотных остатков. В белках их более 50, а в пептидах менее 50.
В настоящее время выделено несколько сотен различных пептидов, которые выполняют в организме самостоятельную физиологическую роль.
К пептидам относятся:
1. Пептидные антибиотики (грамицидин S).
2. Регуляторные пептиды – вещества, регулирующие многие химические реакции в клетках и тканях организма. К ним относятся: пептидные гормоны (инсулин), окситоцин, стимулирующий сокращение гладкой мускулатуры.
3. Нейропептиды.
Классификация белков
В зависимости от строения различают простые и сложные белки.
1. Простые белки состоят только из белковой части.
2. Сложные имеют небелковую часть.
Если в качестве небелковой части используется углевод, то это гликопротеиды.
Если в качестве небелковой части используются липиды, то это липопротеиды.
Если в качестве небелковой части используются нуклеиновые кислоты, то это нуклеопротеиды.
Структуры белка
Белки имеют 4 основных структуры: первичную, вторичную, третичную, четвертичную (см. Рис. 5).
Рис. 5. Структура белка
1. Под первичной структурой понимают последовательность аминокислотных остатков в полипептидной цепи. Она уникальна для любого белка и определяет его форму, свойства и функции.
Значительное совпадение первичной структуры характерно для белков, выполняющих сходные функции. Замена всего лишь одной аминокислоты в одной из цепей может изменить функцию молекулы белка. Например, замена глутаминовой кислоты на валин приводит к образованию аномального гемоглобина и к заболеванию, которое называется серповидноклеточная анемия.
2. Вторичная структура – упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей.
3. Третичная структура – укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков.
4. Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами.
Утрата белковой молекулой своей природной структуры называется денатурацией. Она может возникнуть при воздействии температуры, химических веществ, при нагревании и облучении.
Если при денатурации не нарушены первичные структуры, то при восстановлении нормальных условий белок способен воссоздать свою структуру. Этот процесс носит название ренатурация (см. Рис. 6). Следовательно, все особенности строения белка определяются первичной структурой.
Рис. 6. Денатурация и ренатурация
Серповидноклеточная анемия
Серповидноклеточная анемия – это наследственная болезнь, при которой эритроциты, участвующие в переносе кислорода, выглядят не в виде диска, а принимают форму серпа (см. Рис. 7). Непосредственной причиной изменения формы является небольшое изменение химической структуры гемоглобина (основного компонента эритроцита).
Рис. 7. Внешний вид нормального и серповидного эритроцита
Симптомы: потеря трудоспособности, постоянная отдышка, учащенное сердцебиение, пониженный иммунитет.
Одним из признаков серповидноклеточной анемии является желтизна кожных покровов.
Заключение
Существуют различные формы заболевания. В самой тяжелой форме у человека происходит задержка развития, такие люди не доживают до подросткового возраста.
Список литературы
- Каменский А.А., Криксунов Е.А., Пасечник В.В. Общая биология 10-11 класс Дрофа, 2005.
- Биология. 10 класс. Общая биология. Базовый уровень / П.В. Ижевский, О.А. Корнилова, Т.Е. Лощилина и др. – 2-е изд., переработанное. – Вентана-Граф, 2010. – 224 стр.
- Беляев Д.К. Биология 10-11 класс. Общая биология. Базовый уровень. – 11-е изд., стереотип. – М.: Просвещение, 2012. – 304 с.
- Агафонова И.Б., Захарова Е.Т., Сивоглазов В.И. Биология 10-11 класс. Общая биология. Базовый уровень. – 6-е изд., доп. – Дрофа, 2010. – 384 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Vmede.org (Источник).
- Youtube.com (Источник).
- Bio-faq.ru (Источник).
Домашнее задание
- Вопросы 1-6 в конце параграфа 11 (стр. 46) – Каменский А.А., Криксунов Е.А., Пасечник В.В. «Общая биология», 10-11 класс (Источник)
- Какие функциональные группы входят в состав аминокислот?

Белки (протеины) составляют 50% от сухой массы живых организмов.
Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Структуры белка
Первичная – цепочка из аминокислот, связанных пептидной связью (сильной, ковалентной). Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке.
Вторичная – спираль. Удерживается водородными связями (слабыми).
Третичная – глобула (шарик). Четыре типа связей: дисульфидная (серный мостик) сильная, остальные три (ионные, гидрофобные, водородные) – слабые. Форма глобулы у каждого белка своя, от нее зависят функции. При денатурации форма глобулы меняется, и это сказывается на работе белка.
Четвертичная – имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.)
Денатурация
Это изменение формы глобулы белка, вызванное внешними воздействиями (температура, кислотность, соленость, присоединение других веществ и т.п.)
- Если воздействия на белок слабые (изменение температуры на 1°), то происходит обратимая денатурация.
- Если воздействие сильное (100°), то денатурация необратимая. При этом разрушаются все структуры, кроме первичной.
Функции белков
Их очень много, например:
- Ферментативная (каталитическая) – белки-ферменты ускоряют химические реакции за счет того, что активный центр фермента подходит к веществу по форме, как ключ к замку (комплементарность, специфичность).
- Строительная (структурная) – клетка, если не считать воду, состоит в основном из белков.
- Защитная – антитела борются с возбудителями болезней (иммунитет).
Еще можно почитать
ПОДРОБНЫЕ КОНСПЕКТЫ: Строение белков, Свойства белков + работа адренорецептора, Ферментативная (каталитическая) функция белков, Функции белков с примерами
ЗАДАНИЯ ЧАСТИ 2 ЕГЭ ПО ЭТОЙ ТЕМЕ
Задания части 1
Выберите один, наиболее правильный вариант. Вторичная структура молекулы белка имеет форму
1) спирали
2) двойной спирали
3) клубка
4) нити
Выберите один, наиболее правильный вариант. Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры
1) первичной
2) вторичной
3) третичной
4) четвертичной
Выберите один, наиболее правильный вариант. Процесс денатурации белковой молекулы обратим, если не разрушены связи
1) водородные
2) пептидные
3) гидрофобные
4) дисульфидные
Выберите один, наиболее правильный вариант. Четвертичная структура молекулы белка образуется в результате взаимодействия
1) участков одной белковой молекулы по типу связей S-S
2) нескольких полипептидных нитей, образующих клубок
3) участков одной белковой молекулы за счет водородных связей
4) белковой глобулы с мембраной клетки
Выберите один, наиболее правильный вариант. Последовательность и число аминокислот в полипептидной цепи – это
1) первичная структура ДНК
2) первичная структура белка
3) вторичная структура ДНК
4) вторичная структура белка
Выберите один, наиболее правильный вариант. Вторичная структура белка, имеющая форму спирали, удерживается связями
1) пептидными
2) ионными
3) водородными
4) ковалентными
Выберите один, наиболее правильный вариант. Какие связи определяют первичную структуру молекул белка
1) гидрофобные между радикалами аминокислот
2) водородные между полипептидными нитями
3) пептидные между аминокислотами
4) водородные между -NH- и -СО- группами
Выберите один, наиболее правильный вариант. Первичная структура белка образована связью
1) водородной
2) макроэргической
3) пептидной
4) ионной
Выберите один, наиболее правильный вариант. В основе образования пептидных связей между аминокислотами в молекуле белка лежит
1) принцип комплементарности
2) нерастворимость аминокислот в воде
3) растворимость аминокислот в воде
4) наличие в них карбоксильной и аминной групп
БЕЛКИ
1. Выберите три варианта. Белки в организме человека и животных
1) служат основным строительным материалом
2) расщепляются в кишечнике до глицерина и жирных кислот
3) образуются из аминокислот
4) в печени превращаются в гликоген
5) откладываются в запас
6) в качестве ферментов ускоряют химические реакции
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Выберите только особенности строения белковой молекулы.
1) содержит атомы фосфора
2) состоит из аминокислот
3) мономеры удерживаются пептидными связями
4) состоит из одинаковых по строению мономеров
5) изменяет форму под действием температуры
6) четвертичная структура состоит из нескольких молекул
БЕЛКИ КРОМЕ
Все перечисленные признаки, кроме двух, можно использовать при описании яичного белка альбумина. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из аминокислот
2) пищеварительный фермент
3) денатурирует обратимо при варке яйца вкрутую
4) мономеры связаны пептидными связями
5) молекула образует первичную, вторичную и третичную структуры

БЕЛКИ КРОМЕ РИС
1. Перечисленные ниже признаки, кроме двух, используются для описания строения, функций изображенного органического вещества. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) имеет структурные уровни организации молекулы
2) входит в состав клеточных стенок
3) является биополимером
4) служит матрицей при трансляции
5) состоит из аминокислот

2. Все перечисленные ниже признаки, кроме двух, используются для описания изображённой на рисунке структуры. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) вторичная структура молекулы белка
2) удерживается только пептидными связями
3) определяется методом рентгеноструктурного анализа
4) представляет собой глобулу
5) может выполнять ферментативные функции
СТРУКТУРЫ БЕЛКА
Установите соответствие между характеристикой и структурой белка: 1) первичная, 2) третичная. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) молекула в форме глобулы или фибриллы
Б) строгая последовательность аминокислотных остатков
В) аминокислотные остатки соединены только пептидными связями
Г) имеет дисульфидные мостики между радикалами аминокислот
Д) при ее разрушении наступает необратимая денатурация
Е) пространственная конфигурация полипептидной цепи
РЕГУЛЯТОРНАЯ — СТРУКТУРНАЯ
Установите соответствие между характеристикой и функцией белка, которую он выполняет: 1) регуляторная, 2) структурная
А) входит в состав центриолей
Б) образует рибосомы
В) представляет собой гормон
Г) формирует мембраны клеток
Д) изменяет активность генов
ФЕРМЕНТАТИВНАЯ
1. Все приведенные ниже признаки, кроме двух, можно использовать для описания ферментов. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) входят в состав клеточных мембран и органоидов клетки
2) играют роль биологических катализаторов
3) имеют активный центр
4) оказывают влияние на обмен веществ, регулируя различные процессы
5) специфические белки
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Ферменты – это вещества, которые
1) вырабатываются в железах внутренней секреции
2) являются белками
3) поступают в организм, как правило, вместе с пищей
4) являются в организме источником энергии
5) ускоряют протекание химических реакций
6) у человека выполняют свои функции при температуре около 36 градусов
ФУНКЦИИ БЕЛКОВ
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Функциями белков в организме человека являются
1) строительная
2) передача наследственных признаков
3) защитная
4) запасающая
5) ферментативно-каталитическая
6) хранение генетической информации
ФУНКЦИИ БЕЛКОВ КРОМЕ
Все перечисленные характеристики используют для описания функций белков. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) регуляторная
2) двигательная
3) рецепторная
4) образуют клеточные стенки
5) служат коферментами

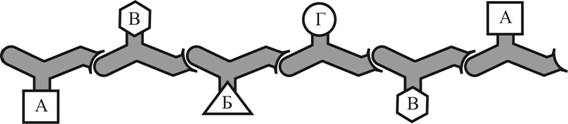
Рассмотрите рисунок с изображением полипептида и укажите (А) уровень его организации, (Б) форму молекулы и (В) вид взаимодействия, поддерживающий эту структуру. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) вторичная структура
3) третичная структура
4) взаимодействия между нуклеотидами
5) металлическая связь
6) гидрофобные взаимодействия
7) фибриллярная
8) глобулярная

Рассмотрите рисунок с изображением полипептида. Укажите (А) уровень его организации, (Б) мономеры, которые его образуют, и (В) вид химических связей между ними. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) водородные связи
3) двойная спираль
4) вторичная структура
5) аминокислота
6) альфа-спираль
7) нуклеотид
8) пептидные связи
Известно, что белки – нерегулярные полимеры, имеющие высокую молекулярную массу, строго специфичны для каждого вида организма. Выберите из приведенного ниже текста три утверждения, по смыслу относящиеся к описанию этих признаков, и запишите цифры, под которыми они указаны. (1) В состав белков входит 20 различных аминокислот, соединенных пептидными связями. (2) Белки имеют различное количество аминокислот и порядок их чередования в молекуле. (3) Низкомолекулярные органические вещества имеют молекулярную массу от 100 до 1000. (4) Они являются промежуточными соединениями или структурными звеньями – мономерами. (5) Многие белки характеризуются молекулярной массой от нескольких тысяч до миллиона и выше, в зависимости от количества отдельных полипептидных цепей в составе единой молекулярной структуры белка. (6) Каждый вид живых организмов имеет особый, только ему присущий набор белков, отличающий его от других организмов.
© Д.В.Поздняков, 2009-2020
