Определить к каким электронным семействам они относятся и какие свойства проявляют
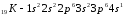
В зависимости от того, какой подуровень
последним заполняется электронами, все
элементы делятся на четыре типа –
электронные семейства:
s
– элементы;
заполняется электронами s
– подуровень внешнего уровня. К ним
относятся первые два элемента каждого
периода. Валентными1являютсяs-электроны
внешнего уровня.p
– элементы;
заполняется электронами р – подуровень
внешнего уровня. Это последние шесть
элементов каждого периода (кроме I
и VII).
Валентными
являются s—
и p—
электроны внешнего уровня.d
– элементы; заполняется
электронами d
– подуровень второго снаружи уровня,
а на внешнем уровне – один или два
электрона (y
46Pd
– нуль). К ним относятся элементы
вставных декад больших периодов,
расположенных между s
– и p
– элементами (их также называют
переходными элементами). Валентными
являются s
– электроны внешнего уровня и d
– электроны предвнешнего уровня
(второго
снаружи).f
– элементы;
заполняется электронами f
– подуровень третьего снаружи уровня,
а на внешнем уровне остается два
электрона. Они расположены в 6 – м (4f
– элементы) и 7 – м (5f
– элементы) периодах периодической
системы. 4f
– элементы объединяют в семейство
лантаноидов, а 5f
– элементы – семейство актиноидов.
В периодической системе s – элементов
14, p – элементов 30, d – элементов 38, f –
элементов 28.
2.9. Понятие об электронных аналогах
Атомы элементов с одинаковым заполнением
внешнего энергетического уровня носят
название электронных аналогов.Например:
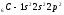 ;
;
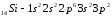 .
.
Элементы с одинаковым строением
внешнего и предвнешнего энергетических
уровней называют полными электронными
аналогами.Например:
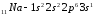 ;
;
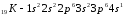 .
.
2.10. Периодический закон и периодическая система элементов д.И. Менделеева
Важнейшим событием химии в 19 веке было
открытие периодического закона, сделанное
в 1869 г. гениальным русским ученым Д.
И. Менделеевым. Периодический закон
в формулировке Д. И. Менделеева гласит:
“ свойства элементов, а потому и свойства
образуемых ими простых и сложных тел,
стоят в периодической зависимости от
их атомного веса”.
Графическим выражением этого закона
стала созданная им периодическая система
элементов.
В настоящее время известно несколько
сотен вариантов периодической системы
элементов, но все они в своей основе
содержат предложенные Менделеевым
принципы её построения. Наибольшее
распространение получили короткая
(восьмиклеточная) и длинная
(тридцатидвухклеточная) формы периодической
система элементов.
Развитие учения о строении атома вскрыло
глубокий физической смысл периодического
закона. Как было доказано, свойства
элементов зависят, прежде всего, от
заряда атомных ядер, который в свою
очередь определяет распределение
электронов на электронных оболочках
атомов. Основной характеристикой атома
является положительный заряд ядра,
численно равный порядковому номеру
элемента. В нейтральном атоме заряд
ядра и общее число электронов равны.
Распределением электронов на электронных
оболочках атомов определяются свойства
элементов и их соединений, положение
элемента в периодической системе.
Периодичность изменения свойств
химических элементов и их соединений
зависит от периодически повторяющейся
сходной структуры электронных оболочек
атомов.
В 1913 г. ученик Резерфорда английский
ученый Мозли, исследуя спектры лучей
Рентгена для различных элементов,
установил простое соотношение между
длиной волны рентгеновских лучей и
порядковым номером элемента (закон
Мозли):
Корень квадратный из величины, обратной
длине волны рентгеновских лучей,
испускаемых атомами различных элементов,
находится в линейной зависимости от
порядкового номера элемента, т. е.
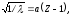
где
– длина волны; Z
– порядковый номер элемента;
– постоянная, одинаковая для всех
элементов.
Из
уравнения следует, что, зная
и измерив ,
можно вычислить порядковый номер
элемента. Это экспериментальный метод
проверки правильности распределения
элементов в периодической системе по
возрастанию заряда ядра. Закон Мозли
показал, что Д.И. Менделеев правильно
расположил элементы в периодической
системе, позволил установить общее
число элементов в каждом периоде, а
главное, направил усилия ученых на
открытие предсказанных им элементов.
Вскоре несколько элементов было открыто
с помощью анализа рентгеновских спектров
(гафний, Z=72;
рений, Z=75
и др.).
Вместе с тем из закона
Мозли следует, что порядковый номер –
это не простая нумерация элементов, а
выражение конкретного внутреннего
свойства атома – величины элементарных
положительных зарядов ядра. Именно
положительный заряд ядра (а не атомная
масса) является главной характеристикой
атома.
В
свете современных представлений о
строении атома изменилась и формулировка
периодического закона: свойства
химических элементов, а также формы и
свойства их соединений находятся в
периодической зависимости от величины
заряда атомных ядер.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства:
1. s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными1 являются электроны внешнего уровня.
2. p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). Валентными являются s- и p- электроны внешнего уровня.
3. d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона (y 46Pd – нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи).
4. f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы) и 7 – м (5f – элементы) периодах периодической системы. 4f – элементы объединяют в семейство лантаноидов, а 5f – элементы – семейство актиноидов.
В периодической системе s – элементов 14, p – элементов 30, d – элементов 38, f – элементов 28.
Атомы элементов с одинаковым заполнением внешнего энергетического уровня носят название электронных аналогов. Например:
;
.
Элементы с одинаковым строением внешнего и предвнешнего энергетических уровней называют полными электронными аналогами. Например:
;
.
116 Вертикальное, горизонтальное и диагональное сходство элементов в периодической системе.
Диагональная периодичность
Диагональная периодичность — повторяемость свойств простых веществ и соединений по диагоналям Периодической системы. Она связана с возрастание неметаллических свойств в периодах слева направо и в группах снизу вверх. Поэтому литий похож на магний, бериллий на алюминий, бор на кремний, углерод на фосфор. Так, литий и магний образуют много алкильных и арильных соединений, которые часто используют в органической химии. Бериллий и алюминий имеют сходные значения окислительно-восстановительных потенциалов. Бор и кремний образуют летучие, весьма реакционноспособные молекулярные гидриды.
Диагональную периодичность не следует понимать как абсолютное сходства атомных, молекулярных, термодинамических и других свойств. Та, в своих соединениях атом лития имеет степень окисления (+I), а атом магния — (+II). Однако свойства ионов Li+ и Mg2+ очень близки, проявляясь, в частности, в малой растворимости карбонатов и ортофосфатов.
В результате объединения вертикальной, горизонтальной и диагональной периодичности появляется так называемая звездная периодичность. Так, свойства германия напоминают свойства окружающих его галлия, кремния, мышьяка и олова. На основании таких «геохимических звезд» можно предсказать присутствие элемента в минералах и рудах.
Горизонтальная аналогия
Некоторые элементы, относящиеся к одному периоду, и, не являющиеся ни типовыми, ни электронными аналогами, тем не менее, обнаруживают значительное сходство друг с другом. Горизонтальная аналогия наблюдается у d- и f-элементов с более чем наполовину заполненными электронными подуровнями. Примером горизонтальных аналогов могут служить железо, кобальт и никель, которые при различных электронных конфигурациях ([Ar]183d64s2, [Ar]183d74s2 и [Ar]183d84s2) обладают определенным сходством.
Существование горизонтальной аналогии объясняется тем, что в рядах d- и f-элементов изменение свойств с увеличением заряда ядра замедляется (вспомним хотя бы то, что все d- и f-элементы являются металлами). Особенно медленно изменяются свойства во второй половине рядов, где в квантовых ячейках подуровней происходит образование электронных пар. С другой стороны, горизонтальными аналогами обычно являются элементы, не реализующие свою высшую степень окисления, отвечающую числу валентных электронов. Так, для железа число валентных электронов равно восьми, для кобальта — девяти, для никеля — десяти. Однако для всех этих элементов наиболее характерны степени окисления +2 и +3; железо может проявлять степень окисления +6, а кобальт и никель — +4: но подобные соединения относительно редки и обычно неустойчивы. В результате для железа, кобальта и никеля формулы основных классов соединений однотипны (например, МеО, Ме2О3, Ме(ОН)2, Ме(ОН)3 и т.д.), а свойства этих соединений, равно как и простых веществ, близки.
Аналогичное явление наблюдается и для платиновых металлов. Триады рутений, родий, палладий и осмий, иридий, платина являются горизонтальными аналогами. В то же время пары рутений-осмий, родий-иридий, палладий-платина относятся к шринк-аналогам. В результате все платиновые металлы близки по свойствам.
В ряду лантаноидов элементы подсемейства церия (Ce-Gd) сильнее отличаются друг от друга по свойствам, чем элементы подсемейства тербия (Tb-Lu); это явление также связано с горизонтальной аналогией.
Дата добавления: 2015-01-29; просмотров: 183; Нарушение авторских прав
Пример 3. Написать электронные формулы атомов хрома, меди и германия, К какому семейству элементов они относятся [c.44]
По способу заполнения электронных оболочек атомов различают,четыре электронных семейства элементов 5-элементы, р-элементы, -элементы и /-элементы. Каждое -семейство характеризуется общностью свойств, а также закономерным расположением ъ периодической системе Д. И. Менделеева. Эта система отражает все особенности в строении электронных оболочек атомов элементов. Свойства з-, р-, -элементов и их соединений рассмотрим в плане таблицы Менделеева. [c.65]
Распределение электронных семейств элементов по периодам [c.56]
Электронные семейства всех элементов (уже известных и еще не открытых) закономерно располагаются в таблице Менделеева, о чем подробнее речь пойдет в следующей главе. [c.42]
Период элемен- тов Слой К Лf 3 N 0 Р Q 7 0 78 Электронное семейство элемента [c.562]
Теперь перейдем к общей характеристике отдельных периодов таблицы Менделеева. Размещение элементов по электронным семействам представлено в таблице, данной на вклейке. [c.44]
По способу заполнения энергетических уровней в атомах электронами различают четыре электронных семейства элементов х, р, (1, /. Каждое семейство характеризуется общностью свойств. Периодическая система элементов Д. И. Менделеева отражает все особенности в заполнении энергетических уровней электронами. [c.11]
Указать недостроенные подуровни. К какому электронному семейству принадлежит соответствующий элемент. [c.49]
Периодическая система как естественная классификация элементов по электронным структурам атомов. Положение элемента в периодической си стеме и электронная конфигурация его атома.. >, р, d-, /-Элементы. Струк тура периодической системы. Группы, подгруппы и семейства элементов Периодичность свойств химических элементов. Зависимость энергии иониза ции и сродства к электрону атомов от. атомного номера элементов. Дополни тельные виды периодичности в периодической системе Д. И. Менделеева [c.25]
Основные классификационные категории в системе Менделеева период ц группа элементов (с подгруппами — главной п побочной). Теперь сюда же добавилась и новая основа классификации элементов подразделение пх по типам структур электронных оболочек атомов — это электронные типы (или электронные семейства) элементов. [c.61]
Существование в периодической системе особых семейств элементов также связано с особенностями строения электронных оболочек атомов. Так называемые переходные металлы — это элементы, у которых при практически неизменном внешнем слое заполняется электронами -подоболочка. Это элементы от 5с до гп в четвертом периоде, от V до Сбольшом периоде равно десяти, по числу электронов, заполняющих /-подоболочку. Семейства лантаноидов, и актиноидов — элементы, у которых заполняется /-подоболочка прй неизменном внешнем слое. В этих семействах по 14 элементов, что опре- [c.61]
Привести схемы строения электронных оболочек атомов молибдена (Мо, 2 = 42) и платины (Pt, 2 = 78). Обратить внимание на S— -переходы. Указать периоды, к которым относятся эти элементы, их электронные семейства. [c.53]
В процессе развития периодической системы по таблице 4-1 отчетливо видна закономерность, выражающаяся в том, что при переходе от нечетного периода к четному каждый раз возникает новое электронное семейство элементов при переходе от 1-го периода ко 2-му — р-семейство, от 3-го к 4-му — -семейство и от 5-го к 6-му — /-семейство. Эти семейства удерживаются в двух смежных периодах без дополнений. Отсюда и вытекает указанная выше парность в числе электронов по периодам. [c.57]
Период содержит четыре электронных семейства. Аналогично тому, как это было в предыдущих периодах, первое из них —6з-семей-ство (6s 2). Сюда относятся два элемента цезий ( s Z=55) и барий (Ва Z = 56), Электронная конфигурация их атомов [c.47]
По структуре второго снаружи электронного слоя элементы главной подгруппы IV группы могут быть разбиты на два семейства [c.431]
У элементов п-го периода сначала происходит заполнение -орбиталей, способных принять два электрона. Эти элементы образуют семейства щелочных металлов (группа 1А) и щелочноземельных металлов (группа ПА) и относятся к типическим (непереходным) элементам. [c.399]
Как видно нз этих данных, элементы главной подгруппы относят ся к р-электронному семейству, а элементы побочной подгруппы — к -семейству и являются переходными металлами. [c.430]
Таким образом, начнь ая с бора (Е —5) и заканчивая нсоном (2 = 10), происходит заполнение р-нодуровня внешнего электронного слоя элементы этой части второго периода относятся, следовательно, к семейству р — э л е м е и т о в. [c.91]
Элементы, следующие за актинием, с порядковыми номерами от 90 (ТЬ) до 103 (Ьг) образуют семейство элементов, объединяемых общим названием актиноидов. В электронной оболочке их атомов происходит заполнение 14 электронами 5/-подгруппы. Эти элементы во многом аналогичны лантаноидам. [c.75]
По электронным конфигурациям подуровней выявить, какие иэ них достраиваются. Указать, к какому электронному семейству принадлежит каждый из перечисленных выше элементов. [c.49]
Если в атоме того или иного элемента достроены все электронные оболочки, то этот элемент относят к тому электронному семейству, который отвечает внешней (также достроенной) оболочке. [c.42]
Лантаноиды и актиноиды обычно выделяются в особые семейства /-элементов и рассматриваются вне групп таблицы Менделеева. Максимальный коэффициент при внешних 5-электронах и в этом случае указывает на номер периода (л=5 или 6). [c.58]
Ярко выраженная поливалентность актиноидов отражает специфику электронного строения их атомов — близость энергетических состояний 5/-, 6d-, 7s- и 7р-подуровней, большую пространственную протяженность 5/-орбиталей по сравнению с 4/-и меньшую эф( )ективность экранирования внешних электронов. Только по мере заполнения 5/-орбиталей электронные конфигурации атомов несколько стабилизируются и элементы подсемейства берклия (Вк—Lr) проявляют более устойчивые низкие степени окисления +3 и +2. Для тория, протактиния и урана преобладают степени окисления -f4, -f5 и +6 соответственно, поэтому соединения этих элементов до некоторой степени напоминают соединения гафния, тантала и вольфрама. В настоящее время принадлежность их к семейству /-элементов (актиноидов) не вызывает сомнений. U, Np, Pu и Ат образуют группу уранидов, аналогично подгруппе церия в ряду лантаноидов, а элементы Ст—Lr образуют группу кюридов. [c.360]
Замыкает шестой период элемент радон (Кп 2 = 86), атом которого во внешнем слое содержит октет электронов . ..бз бр . Радон относится к числу, инертных элементов. Структура его атома лежит в основе з-семейства элементов седьмого периода. [c.48]
Нетрудно сообразить, что поскольку щелочноземельные металлы Ве, Mg, Са, 8г и Ва очень сходны по своим химическим свойствам, их следует расположить друг под другом, как это и сделано на рис. 7-3. Каждый период завершается элементами с неметаллическими свойствами, и О, 8, 8е и Те образуют семейство элементов с валентностью 2, у которых при переходе от О к Те постепенно нарастают металлические свойства О-типичный неметалл, а Те располагается в особой пограничной зоне таблицы между металлами и неметаллами, где находятся так называемые семиме-таллы ( полуметаллы ), или металлоиды. Элементы К, Р, Аз, 8Ь и В1 образуют семейство, отличительной особенностью элементов в котором является способность присоединять три электрона в некоторых соединениях, а также постепенный переход от неметаллических свойств у N и Р к семиметаллическим у Аз и металлическим у 8Ь и В1, Элементы С, 81, Се, 8п и РЬ также образуют семейство, характерным свойством элементов в котором является валентность 4. Для этих элементов пограничная линия между металлами и неметаллами располагается на один период выше С-типичный неметалл, 81 и Ое-семиметаллы, а 8п и РЬ металлы. Наконец, семейство элементов В, А1, Са, 1п и Т1 образует ионы с зарядами + 3 [c.314]
Положение в группах -элементов обусловливается общим числом 5-электронов внешнего и -электронов предвнешнего слоев. По этому признаку первые шесть элементов каждого семейства -элементов располагаются в одной из соответствующих групп скандий (3 48 ) в III, марганец (3 45 ) в VII, железо (3 4s ) в VIII и т. д. Цинк (3 [c.28]
Как видно, первый период (сверхмалый) содержит только одно электронное семейство элементов, второй и третий (малые периоды)— по два, четвертый и пятый (большие периоды) — по три, а шестой и седьмой (сверхбольшие периоды) — по четыре семейства. При этом седьмой период недостроен атом последнего недавно открытого элемента 104 (курчатовия) содержит только два -электрона (6с1 ) из десяти возможных, а 7р-семейство полностью отсутствует. [c.51]
Период злемен то Слой К 1 м /V 0 Р [c.561]
Период -лсмеитов Слой К L M V 0 Электронное семейство элемента [c.196]
На графике ясгю видны горизонтальные участки, которые отвечают парности в числе элементов в двух смежных периодах — четнонечетном. При этом характерно, что в каждом четном периоде начинается застройка нового очередного энергетического подуровня — появляется новое электронное семейство элементов. Так, во втором периоде возникает р-, в четверто.м — d-, в шестом — /-, в восьмом — g-, в десятом — /i-семейство и т. д. На рисунке под площадками на кривой даны количественные характеристики конфигураций. [c.76]
Бром. Бром и йод образуют семейство элементов, атомы которых во втором снаружи слое содержат по 18 электронов. Хотя в свойствах этих элементов и наблюдается значительное снижение металлоидности, однако и бром и йод остаются ярко выраженными, энергичными неметаллами. [c.526]
Мы уже отмечали, что в каждом последующем четном периоде возникает новое электронное семейство элементов в 8 периоде 5g- e-мейство из 18 элементов ( октадеканиды В. И. Гольданского), в 10-м периоде — пшотетическое 6/г-семейство из 22 элементов и т. д. Сколько же элементов из числа указанных но новым периодам в действитель- [c.78]
Электроноемкость седьмого энергетического уровня (уровень Q л = 7) не насыщена, слой содержит 21 электрон. Указать, какие энергетические подуровни достроены, какой подуровень достраивается. Представить электронные конфигурации по подуровням и указать, к какому электронному семейству принадлежит элемент. [c.48]
Периоды и семейства элементов. Как мы видели, период представляет собой последовательный ряд элементов, в атомах которых происходит заполнение одинакового числа электронных слоев. При атом номер периода совпадает со значением главного квантового числа п внешнего энергетического уровня. Различие в последовательности (аполнения электронных слоев (внешних и более близких к ядру) объясняет причину различной длины периодов. [c.28]
Третий снаружи уровень [предпредвнешний слой (л — 2)] содержит /-электроны в количествах, также указанных в таблице. Это — конфигурации (п — 2)/ » . Сюда относятся актиноиды и лантаноиды (семейства /-элементов). [c.56]
Таким образом, начиная с бора (2 = 5) и заканчивая неоном (2 = 10), происходит заполнение р-подуровня внешнего электронного слоя элементы этой части второго периода относятся, следовательно, к семейству р-элементпов. [c.66]
Подгруппы таблицы Менделеева разделены, вследствие чего получается 18 вертикальных столбцов, называемых семействами, отражающими, как будет видно, последовательное заполнение 5-, р- и -орбиталей с 2, 6 и 10 электронами соответственно. Элементы каждого столбца являются истинными аналогами. Группа VIII, содержащая триаду железа и платиновые металлы, помещена в центре таблицы и отделяет семь подгрупп А от семи подгрупп Б. Инертные газы помещены справа на конце таблицы, отражая за- [c.89]
Лекционные опыты и демонстрации по общей и неорганической химии (1976) — [
c.11
]
