Неметаллические свойства фосфора какие

В главной подгруппе пятой группы, наряду с азотом, находится еще и фосфор. Металлом или неметаллом можно считать этот элемент? По сравнению с азотом он имеет более низкую электроотрицательность, однако все же относится к активным неметаллам. В нашей статье мы рассмотрим важнейшие физические и химические свойства фосфора, а также определим области его применения в промышленности.
Положение элемента в периодической системе
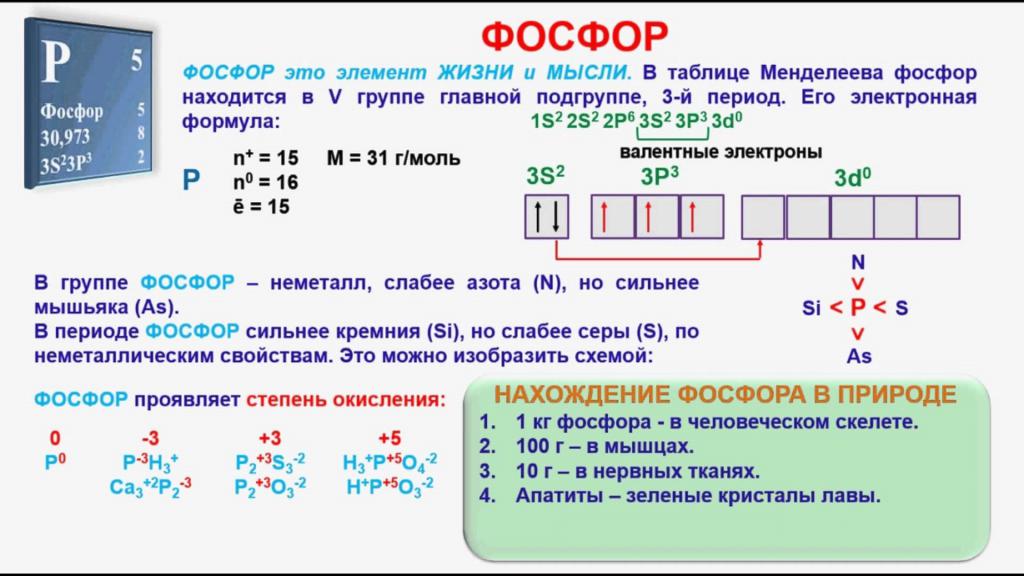
Фосфор относится к p-элементам, его атом имеет три энергетических уровня. На последнем из них расположено пять электронов, три из которых являются неспаренными. В возбужденном состоянии атом P содержит пять свободных электронов. Этот факт объясняет появление соединений фосфора, в которых он не трехвалентен, но имеет валентность, равную пяти, например, P2O5 – пятиокись фосфора. Неметалл, вследствие своей высокой активности, в природе отсутствует в свободном состоянии и встречается только в виде соединений. Природный элемент имеет единственный стабильный изотоп с относительной атомной массой, равной 31. Фосфор входит в состав многих горных пород и минералов, его содержание в составе земной коры составляет 0,08%.

Аллотропные модификации
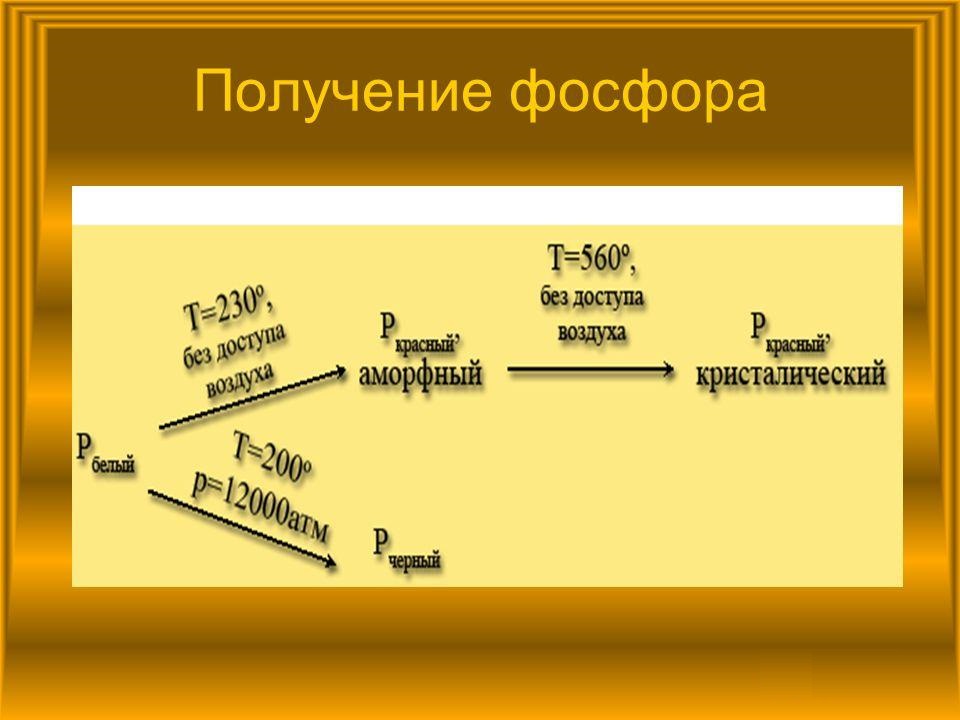
Различное расположение атомов в кристаллических решетках вещества приводит к появлению некоторых видоизменений. Например, черный фосфор очень напоминает графит. Он такой же жирный на ощупь и проявляет полупроводниковые свойства. В промышленности материал получают из белого фосфора, нагревая последний до 200°С и подвергая давлению в 12000 атм.
Красный фосфор – это порошковидное неядовитое вещество. При его детальном изучении было установлено, что соединение представляет собой смесь видоизменений фосфора, которые различаются между собой некоторыми признаками, например, цветом.
Еще одна аллотропная модификация – белый фосфор. Металлом или неметаллом он является? Это вещество проявляет типичные неметаллические свойства, кроме того, оно очень токсично. Получают его, концентрируя пары фосфора. В отличие от красного вида, он может растворяться в сероуглероде. Если белый фосфор длительно подвергать слабому нагреванию, он переходит в модификацию красного фосфора.
Химическая характеристика
В своих соединениях с другими элементами P может проявлять следующие степени окисления: +3, +5, -3. В парообразном состоянии при температуре ниже 800°, а также в жидкой фазе молекула вещества имеет формулу P4.
Различные модификации вещества имеют непохожие химические признаки. Как ответить на вопрос, чем является фосфор – металлом или нет? Нужно обратиться к строению его атома, который в возбужденном состоянии имеет пять валентных электронов. Наиболее активным в химическом плане неметаллом будет белый фосфор, который уже при обычной температуре легко окисляется, в процессе чего начинает светиться, а также может самовоспламеняться. По этим причинам его рекомендуется хранить покрытым водой. Красный фосфор по своим свойствам является менее активным веществом, чем его белая модификация.
Бинарные соединения
Как металл или неметалл, фосфор может реагировать с кислородом:
4P + 3O2 → 2P2O3
Продуктом реакции является газообразный фосфин – очень токсичное вещество, применяемое в качестве химического оружия. Его легко распознаеть по специфическому запаху чеснока. Гидрид фосфора способен присоединять галогеноводороды, например, такие, как йодоводород, образуя соединение – йодид фосфония PH4I. Взаимодействие с металлами приводит к появлению фосфидов:
2P + 3Ca = Ca3P2.
Как металл, фосфор реагирует и с неметаллами, например, с серой, углеродом, хлором:
2P + 3Cl2 = 2PCl3
Фосфиды легко вступают в реакцию с водой, разлагаясь до фосфина:
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3(фосфин)
Оксиды
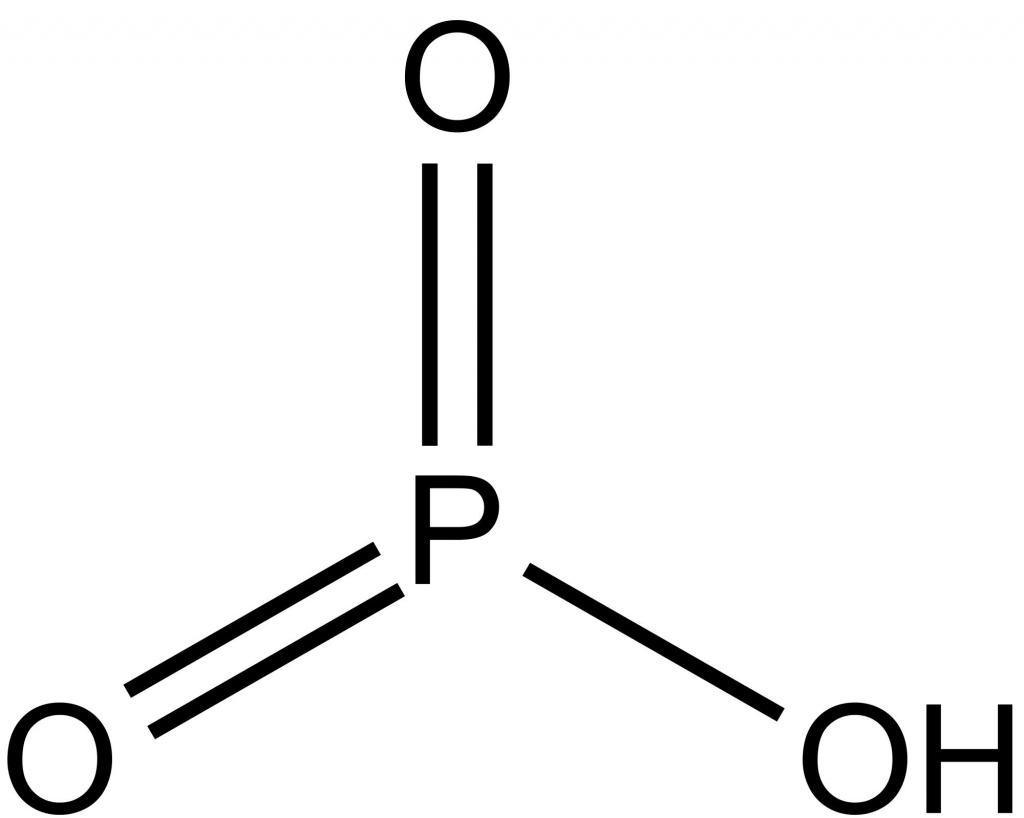
Среди бинарных соединений элемента с кислородом наиболее важными являются его оксиды: P2O5 и P2O3. Триокись фосфора, иначе называемая фосфорным ангидридом, представляет собой кристаллическое соединение, температура плавления которого – 22,5°. В обычных условиях оно имеет вид воскоподобной массы. В лаборатории его получают сжиганием фосфора в атмосфере, бедной кислородом. Хотя этот оксид и проявляет свойства сильного восстановителя, применяется он крайне редко из-за высокой токсичности. Какие же свойства, металла или неметалла, фосфор оксид проявляет в своих реакциях? Он может реагировать с водой, образуя ортофосфорную кислоту и фосфин. Вещество взаимодействует с хлороводородом, в результате получаются фосфатная кислота и хлорид фосфора.
Другое соединение – пятиокись фосфора, имеет признаки типичного кислотного оксида. Его можно получить в результате сжигания порции фосфора в атмосфере с избытком кислорода. В обычных условиях с водой соединение реагирует очень активно и образует метафосфорную, а при нагревании – ортофосфорную кислоту. Кроме того, пятиокись фосфора отнимает влагу, поэтому может применяться в качестве осушителя для жидких веществ и газов.
Фосфорные кислоты
Наиболее известные фосфорные кислоты – это метафосфорная, ортофосфорная и пирофосфорная, формула которой H4P2O7. Последняя из них образуется при нагревании H3PO4. Наибольшее практическое значение имеет ортофосфорная кислота, соли которой применяют в качестве сырья для получения минеральных удобрений. Она представляет собой твердое вещество белого цвета, очень хорошо растворимое в воде. Являясь кислотой средней силы, она не имеет ярко выраженных окислительных свойств. Как электролит, диссоциирует ступенчато, поэтому образует два ряда солей: средние – фосфаты, кислые – гидрофосфаты и дигидрофосфаты. В промышленности фосфатную кислоту получают термическим и экстракционным способом. Так как оксидам фосфора соответствуют кислоты, то на вопрос, чем является фосфор – металлом или неметаллом, ответ будет однозначным: это активный неметаллический элемент.

Распространение в природе
Наиболее важный минерал, содержащий высокую концентрацию фосфора – это апатит. Он имеет много разновидностей, самая распространенная из которых – фторапатит. Еще один вид минерала, состоящий из соединений фосфора – осадочная порода фосфорит.
Элемент входит в группу десяти важнейших для живых организмов химических элементов. Наибольшее его содержание обнаружено в форме фосфолипидов – органических соединений, которые входят в состав клеточных мембран, гормонов и других биологически активных веществ. Высокое содержание элемента (около 0,38%) регистрируется в нервной ткани, образующей центральный и периферический отделы нервной системы человека и других позвоночных животных. Кроме этого, соединения фосфора входят в мышечную и костную ткань. В последней присутствует фосфат кальция – соль, придающая дентину зубов и костям прочность и высокую твердость. В обмене веществ растительных организмов, наряду с магнием и железом, фосфор играет важную роль в качестве регулятора процессов формирования и созревания плодов и семян. Именно поэтому, вместе с азотом и калием, фосфор считается основным питательным элементом растений.

В нашей статье мы рассмотрели свойства фосфора и ответили на вопрос: чем является фосфор – металлом или неметаллом? Это типичный неметаллический элемент, обладающий высокой химической активностью.
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
«Химия. 9 класс». О.С. Габриелян
Вопрос 1.
а) Характеристика фосфора.
1. Фосфор — (лат. Phosphorus), Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, Z = 15, атомная масса 30,97376. Атом фосфора содержит в ядре 15 протонов, 16 нейтронов и 15 электронов.
Атомы фосфора проявляют как окислительные свойства (принимают недостающие для завершения внешнего уровня три электрона, проявляя при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами — металлами, водородом и тп.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.).
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2О5. Это кислотный оксид. Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота Н3РО4.
Р2О5 + 3Н2О = 2Н3РО4.
При взаимодействии Р2О5 с основными оксидами и основаниями он дает соли:
Р2О5 + 3CaO = Ca3(PO4)2;
Р2О5 + 6NaOH = 2Na3PO4 + 3Н2О.
6. Высший гидроксид фосфора — фосфорная кислота Н3РО4, проявляет все типичные свойства кислот:
взаимодействие с основаниями и основными оксидами:
Н3РО4 + 3KOH = 2K3PO4 + 3Н2О.
2Н3РО4 + 3CaO = Ca3(PO4)2 + 3Н2О.
7. Фосфор образует летучее соединение Н3Р — фосфин.
б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и Аr(К) = 39. Соответственно заряд ядра его атома +19 равен числу протонов. Следовательно, число нейтронов в ядре равно 20. Число электронов, содержащихся в атоме калия, равно 19.
Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
Исходя из строения атома, можно предсказать степень окисления калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1. Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий — простое вещество, для него характерна металлическая кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
З. Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона атома кальция.
5. Оксид калия К2О является основным оксидом и проявляет все типичные свойства основных оксидов, взаимодействие с кислотами и кислотными оксидами.
K2O + 2HJ = 2KJ + Н2О;
K2O + CO2 = K2CO3.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами. КОН + HJ = KJ + Н2О;
6КОН + P2O5 = 2K3PO4 + 3Н2О.
7. Летучего водородного соединения калий не образует, а образует гидрид калия KH.
Вопрос 2.
Вопрос 3.
Магний — простое вещество, для него характерна металлическая кристаллическая решетка; он обладает металлическим блеском, электропроводностью.
Вопрос 4.
Аллотропия — явление существования химического элемента в виде нескольких простых веществ, различных по строению и свойствам (так называемых аллотропных форм).
а) В молекулах состава S2 реализуется ковалентно-неполярный тип связи (т.е. не происходит смещения электронной пары, образующей связь).
б) В молекулах состава Н2S реализуется ковалентно-полярный тип связи, т.к. происходит смещение электронной пары к более электроотрицательному атому — сере (S).
Н → S ← Н
Физические свойства ромбической серы (S2):
Вещество лимонно-желтого цвета, устойчивое до t = 95,6°С, растворяется в сероуглероде (CS2), анилине, бензоле, феноле.
Уравнения реакций:
Вопрос 5.
Неметаллические свойства кремния выражены слабее, чем у фосфора, но сильнее, чем у алюминия.
Вопрос 6.
а) У азота кислотные свойства выражены сильнее, чем у фосфора, т.к. в группах сверху вниз происходит усиление основных и ослабление кислотных свойств.
б) У серы кислотные свойства выражены сильнее, чем у фосфора, т.к. в периодах слева направо происходит усиление кислотных и ослабление основных свойств.
Вопрос 7.
Вопрос 8.
Вопрос 9.
Нет, нельзя. Прежде всего, из-за различия в степенях окисления. В оксиде сера имеет степень окисления 6+. В сернистой кислоте — 4+. Высшему оксиду SO3 соответствует серная кислота H2SO4. Сернистой кислоте H2SO3 соответствует оксид SO2.
Данные соответствия можно показать гидролизом оксидов:
Вопрос 10.
А) Характеристика фосфора.
1. Фосфор — элемент пятой группы и третьего периода, Z = 15,
АГ(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов, 16
нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
+15Р 2ё; 8ё; 5ё.
Атомы фосфора проявляют как окислительные свойства (принимают недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами — металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и+5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами. 3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы (соседние элементы в периоде). 5. Высший оксид фосфора имеет формулу РгО5. Это кислотный оксид. Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2О5 + ЗН2О =>2Н3РО4.
При взаимодействии его с основными оксидами и основаниями он дает соли.
Р2О5 + 3MgO = Mg3(PO4)2; Р2О5 + 6КОН = 2К3РО4+ ЗН2О.
6. Высший гидроксид фосфора — фосфорная кислота Н3РО4, раствор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РО4 + 3NaOH = Na3PO4 + ЗН2О. 2Н3РО4 + ЗСаО = Ca3(PO4)2i + ЗН2О.
7. Фосфор образует летучее соединение Н3Р — фосфин. Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z — 19 и относительную атомную массу АГ(К) — 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19.
Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
+19К: 2ё; 8ё; 8ё; 1ё.
Исходя из строения атома, можно предсказать степень окисления калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий — простое вещество, для него характерна металлическая кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона атома кальция.
5. Оксид калия К2О является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2О + 2НС1 = 2КС1+Н2О; K2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
