На каких свойствах водорода основано его применение
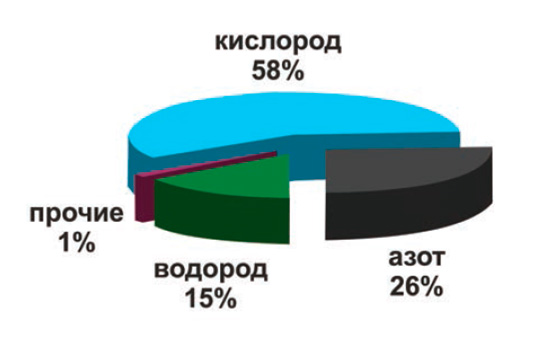
Современную промышленность сложно представить без применения технических газов на различных этапах производства. На сегодняшний день водород входит в тройку наиболее востребованных промышленностью газов, уступая лишь кислороду и азоту.
 |
| Структура производства промышленных газов в России, % |
Водород относится к числу важнейших видов сырья химической и нефтехимической промышленности. Свойства этого газа обуславливают его применение и в других отраслях промышленности: металлургической, пищевой, стекольной, электронной, электротехнической.
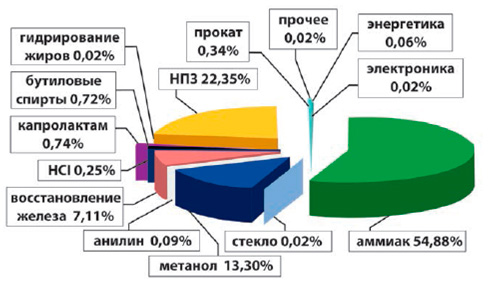
Структура потребления водорода в России в 2013 г.

| Аммиак | 54,88% |
| Нефтеперерабатывающие заводы | 22,35% |
| Метанол | 13,30% |
| Восстановление железа | 7,11% |
| Капролактам | 0,74% |
| Бутиловые спирты | 0,72% |
| Прокат | 0,34% |
| HCl | 0,25% |
| Анилин | 0,09% |
| Энергетика | 0,06% |
| Гидрогенизация жиров | 0,02% |
| Электроника | 0,02% |
| Стекло и керамика | 0,02% |
| Прочее | 0,02% |
Перейти в раздел «Водородные компрессоры»
Химическая промышленность
В России основная область потребления водорода – производство химических продуктов, прежде всего аммиака и метанола.
Лидерами по потреблению водорода являются предприятия, производящие аммиак NH
3
. Сейчас на 28 предприятиях в России используется 2,46 млн.т. водорода в год.
Потребление водорода при синтезе метанола CH
3
OH составило 0,6 млн.т. в 2013 г.
Потребление водорода в остальных сегментах химической промышленности не превышает 90 тыс.т. – 3% от объема потребления.
Нефтеперерабатывающая промышленность
Повышается потребность НПЗ в водороде, необходимом для получения топлив из тяжелого высокосернистого сырья. Огромное количество водорода требуется для установок гидрообессеривания, гидрокрекинга дистиллятов, гидроочистки, изомеризации, производств смазочных материалов. Кроме того, водород на НПЗ используется для активации катализаторов риформинга и регенерации катализаторов изомеризации.
Металлургия
Основной областью применения водорода в металлургии является производство металлизированного сырья методом прямого восстановления железа. Сейчас в этом процессе потребляется около 320 тыс.т. водорода.
Значительные объемы водорода расходуются в технологических процессах прокатного производства (при термической обработке холоднокатаного проката). Потребление водорода – около 15 тыс.т. в год.
Водород на металлургических предприятиях используется также для создания защитной азотно-водородной атмосферы при термообработке труб.
Стекольная промышленность
В стекольной промышленности водород применяется при производстве листового стекла float-методом, а также для получения кварцевого стекла, которое изготавливают плавлением чистого горного хрусталя, кварца или синтетического оксида кремния в водородно-кислородном пламени.
Энергетика
В энергетике водород используется для охлаждения мощных турбогенераторов, благодаря его высокой теплопроводности и коэффициенту диффузии, а также нетоксичности. По оценкам, в энергетике на ТЭЦ, АЭС потребляется около 4-5 тыс.т. водорода в год.
Пищевая промышленность
В пищевой промышленности водород используется в процессах гидрогенизации масел и жиров при получении твердых жиров (маргарина). Объем потребления водорода масложировыми комбинатами оценивается на уровне 1,5 тыс.т. в год.
Среди прочих потребителей водорода – обогатительные комбинаты, заводы, занимающиеся фабрикацией ядерного топлива, предприятия электронной и электротехнической промышленности, транспортные и газовые компании, фармацевтика.
Химические свойства
водорода
При обычных условиях молекулярный Водород сравнительно мало активен, непосредственно соединяясь лишь с наиболее активными из неметаллов (с фтором, а на свету и с хлором). Однако при нагревании он вступает в реакции со многими элементами.
Водород вступает в реакции с простыми и сложными веществами:

— Взаимодействие водорода с металлами приводит к образованию сложных веществ — гидридов, в химических формулах которых атом металла всегда стоит на первом месте:

При высокой температуре Водород непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и другими), образуя белые кристаллические вещества — гидриды металлов (LiН, NaН, КН, СаН2 и др.):
Н2 + 2Li = 2LiH
Гидриды металлов легко разлагаются водой с образованием соответствующей щелочи и водорода:
СаH2 + 2Н2О = Са(ОН)2 + 2Н2↑
— При взаимодействии водорода с неметаллами образуются летучие водородные соединения. В химической формуле летучего водородного соединения, атом водорода может стоять как на первом так и на втором месте, в зависимости от местонахождения в ПСХЭ (см. табличку в слайде):

1). С кислородом
Водород образует воду:
Видео «Горение водорода»
2Н2 + О2 = 2Н2О + Q
При обычных температурах реакция протекает крайне
медленно, выше 550°С — со взрывом (смесь
2 объемов Н2 и 1 объема О2 называется гремучим газом).
Видео «Взрыв гремучего газа»
Видео «Приготовление и взрыв гремучей смеси»
2). С галогенами
Водород образует галогеноводороды, например:
Н2 + Cl2 = 2НСl
При этом с фтором Водород взрывается (даже в темноте и
при — 252°С), с хлором и бромом реагирует лишь при освещении или нагревании, а
с йодом только при нагревании.
3). С азотом
Водород взаимодействует с образованием аммиака:
ЗН2 + N2 = 2NН3
лишь на катализаторе и при повышенных температуpax и
давлениях.
4). При нагревании Водород энергично реагирует с серой:
Н2 + S = H2S (сероводород),
значительно труднее с селеном и теллуром.
5). С чистым
углеродом Водород может реагировать без катализатора только при высоких
температуpax:
2Н2 + С (аморфный) = СН4 (метан)
— Водород вступает в реакцию замещения с оксидами металлов, при этом образуются в продуктах вода и восстанавливается металл. Водород — проявляет свойства восстановителя:

Водород используется для восстановления многих металлов, так как отнимает кислород у их
оксидов:
CuO + H2 = Cu + H2O,
Fe3O4 + 4H2 = 3Fe +
4Н2О, и т. д.
Применение
водорода
Видео «Применение водорода»
В настоящее время водород получают в огромных
количествах. Очень большую часть его используют при синтезе аммиака,
гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме
того, водород применяют для синтеза соляной кислоты, метилового спирта,
синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп
накаливания и драгоценных камней. В продажу водород поступает в баллонах под
давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной
надписью «Водород».
Водород используется для
превращения жидких жиров в твердые (гидрогенизация), производства жидкого
топлива гидрогенизацией углей и мазута. В металлургии водород используют как
восстановитель оксидов или хлоридов для получения металлов и неметаллов
(германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.).
Практическое применение водорода
многообразно: им обычно заполняют шары-зонды, в химической промышленности он
служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в
пищевой — для выработки из растительных масел твёрдых жиров и т. д. Высокая
температура (до 2600 °С), получающаяся при горении водорода в кислороде,
используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород
является одним из наиболее эффективных реактивных топлив. Ежегодное мировое
потребление водорода превышает 1 млн. т.
ТРЕНАЖЕРЫ
№1. Химические свойства водорода
№2. Водород
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Задание №1
Составьте уравнения реакций взаимодействия водорода со следующими веществами: F2, Ca, Al2O3, оксидом ртути (II), оксидом вольфрама (VI). Назовите продукты реакции, укажите типы реакций.
Задание №2
Осуществите превращения по схеме:
H2O -> H2 -> H2S -> SO2
Задание №3.
Вычислите массу воды, которую можно получить при сжигании 8 г водорода?
Гидроген Н – химический элемент, один из самых распространённых в нашей Вселенной. Масса водорода как элемента в составе веществ составляет 75 % от общего содержания атомов другого типа. Он входит в наиважнейшее и жизненно необходимое соединение на планете — воду. Отличительной особенностью водорода также является то, что он первый элемент в периодический системе химических элементов Д. И. Менделеева.

Открытие и исследование
Первые упоминания о водороде в трудах Парацельса датируются шестнадцатым веком. Но его выделение из газовой смеси воздуха и исследование горючих свойств были произведены уже в семнадцатом веке учёным Лемери. Досконально изучил гидроген английский химик, физик и естествоиспытатель Генри Кавендиш, который опытным путём доказал, что масса водорода наименьшая в сравнении с другими газами. В последующих этапах развития науки многие учёные работали с ним, в частности Лавуазье, назвавший его «рождающим воду».
Характеристика по положению в ПСХЭ
Элемент, открывающий периодическую таблицу Д. И. Менделеева, – это водород. Физические и химические свойства атома проявляют некую двойственность, так как гидроген одновременно относят к первой группе, главной подгруппе, если он ведёт себя как металл и отдаёт единственный электрон в процессе химической реакции, и к седьмой — в случае полного заполнения валентной оболочки, то есть приёме отрицательной частицы, что характеризует его как подобный галогенам.

Особенности электронного строения элемента
Свойства атома водорода, сложных веществ, в состав которых он входит, и самого простого вещества Н2 в первую очередь определяются электронной конфигурацией гидрогена. Частица имеет один электрон с Z= (-1), который вращается по своей орбите вокруг ядра, содержащего один протон с единичной массой и положительным зарядом (+1). Его электронная конфигурация записывается как 1s1, что означает наличие одной отрицательной частицы на самой первой и единственной для гидрогена s-орбитали.
При отрыве или отдаче электрона, а атом этого элемента имеет такое свойство, что роднит его с металлами, получается катион. По сути ион водорода – это положительная элементарная частица. Поэтому лишенный электрона гидроген называют попросту протоном.
Физические свойства
Если описывать физические свойства водорода кратко, то это бесцветный, малорастворимый газ с относительной атомной массой равной 2, в 14,5 раза легче, чем воздух, с температурой сжижения, составляющей -252,8 градуса Цельсия.
На опыте можно легко убедиться в том, что Н2 самый легкий. Для этого достаточно наполнить три шара различными веществами – водородом, углекислым газом, обычным воздухом — и одновременно выпустить их из руки. Быстрее всех достигнет земли тот, который наполнен СО2, после него опустится надутый воздушной смесью, а содержащий Н2 вовсе поднимется к потолку.
Маленькая масса и размер частиц водорода обосновывают его способность проникать через различные вещества. На примере того же шара в этом легко убедиться, через пару дней он сам сдуется, так как газ просто пройдёт через резину. Также водород может накапливаться в структуре некоторых металлов (палладий или платина), а при повышении температуры испаряться из неё.
Свойство малорастворимости водорода используют в лабораторной практике для его выделения способом вытеснения воды. Физические свойства водорода (таблица, изображенная ниже, содержит основные параметры) определяют сферы его применения и методы получения.
| Параметр атома или молекулы простого вещества | Значение |
| Атомная масса (молярная масса) | 1,008 г/моль |
| Электронная конфигурация | 1s1 |
| Кристаллическая решётка | Гексагональная |
| Теплопроводность | (300 K) 0,1815 Вт/(м·К) |
| Плотность при н. у. | 0,08987 г/л |
| Температура кипения | -252,76 °C |
| Удельная теплота сгорания | 120,9·106 Дж/кг |
| Температура плавления | -259,2 °C |
| Растворимость в воде | 18,8 мл/л |
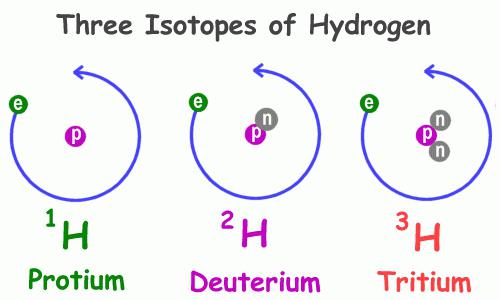
Изотопный состав
Как и многие другие представители периодической системы химических элементов, гидроген имеет несколько природных изотопов, то есть атомов с одинаковым числом протонов в ядре, но различным числом нейтронов – частиц с нулевым зарядом и единичной массой. Примеры атомов, обладающих подобным свойством — кислород, углерод, хлор, бром и прочие, в том числе радиоактивные.
Физические свойства водорода 1Н, самого распространённого из представителей данной группы, значительно отличаются от таких же характеристик его собратьев. В частности, разнятся особенности веществ, в состав которых они входят. Так, существует обычная и дейтерированная вода, содержащая в своём составе вместо атома водорода с одним-единственным протоном дейтерий 2Н – его изотоп с двумя элементарными частицами: положительной и незаряженной. Этот изотоп в два раза тяжелее обычного гидрогена, что и объясняет кардинальное различие в свойствах соединений, которые они составляют. В природе дейтерий встречается в 3200 раз реже, чем водород. Третий представитель – тритий 3Н, в ядре он имеет два нейтрона и один протон.
Способы получения и выделения
Лабораторные и промышленные методы получения водорода весьма отличаются. Так, в малых количествах газ получают в основном с помощью реакций, в которых участвуют минеральные вещества, а крупномасштабные производства в большей степени используют органический синтез.
В лаборатории применяют следующие химические взаимодействия:
- Реакция щелочных и щелочноземельных металлов с водой с образованием щёлочи и искомого газа.
- Электролиз водного раствора электролита, на аноде выделяется Н2↑, а на катоде — кислород.
- Разложение гидридов щелочных металлов водой, продуктами являются щёлочь и, соответственно, газ Н2↑.
- Взаимодействие разбавленных кислот с металлами с образованием солей и Н2↑.
- Действие щелочей на кремний, алюминий и цинк также способствует выделению водорода параллельно с образованием комплексных солей.
В промышленных интересах газ получают такими методами, как:
- Термическое разложение метана в присутствии катализатора до составляющих его простых веществ (350 градусов достигает значение такого показателя, как температура) – водорода Н2↑ и углерода С.
- Пропускание парообразной воды через кокс при 1000 градусов Цельсия с образованием углекислого газа СО2 и Н2↑ (самый распространённый метод).
- Конверсия газообразного метана на никелевом катализаторе при температуре, достигающей 800 градусов.
- Водород является побочным продуктом при электролизе водных растворов хлоридов калия или натрия.
Химические взаимодействия: общие положения
Физические свойства водорода во многом объясняют его поведение в процессах реагирования с тем или иным соединением. Валентность гидрогена равняется 1, так как он в таблице Менделеева расположен в первой группе, а степень окисления проявляет различную. Во всех соединениях, кроме гидридов, водород в с.о.= (1+), в молекулах типа ХН, ХН2, ХН3 – (1-).
Молекула газа водорода, образованная посредством создания обобщенной электронной пары, состоит из двух атомов и довольно устойчива энергетически, именно поэтому при нормальных условиях несколько инертна и в реакции вступает при изменении нормальных условий. В зависимости от степени окисления водорода в составе прочих веществ, он может выступать как в качестве окислителя, так и восстановителя.
Вещества, с которыми реагирует и которые образует водород
Элементные взаимодействия с образованием сложных веществ (часто при повышенных температурах):
- Щелочной и щелочноземельный металл + водород = гидрид.
- Галоген + Н2 = галогеноводород.
- Сера + водород = сероводород.
- Кислород + Н2 = вода.
- Углерод + водород = метан.
- Азот + Н2 = аммиак.
Взаимодействие со сложными веществами:
- Получение синтез-газа из монооксида углерода и водорода.
- Восстановление металлов из их оксидов с помощью Н2.
- Насыщение водородом непредельных алифатических углеводородов.
Водородная связь
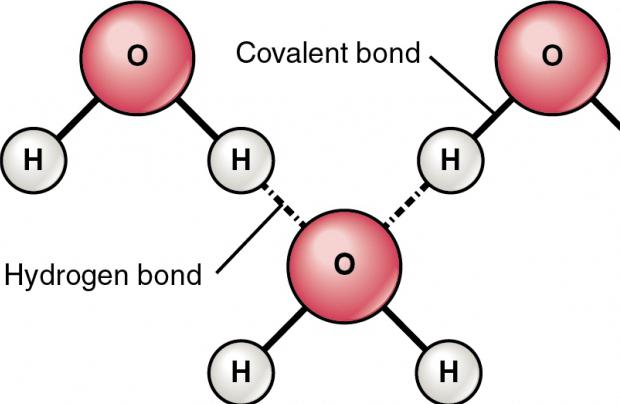
Физические свойства водорода таковы, что позволяют ему, находясь в соединении с электроотрицательным элементом, образовывать особый тип связи с таким же атомом из соседних молекул, имеющих неподелённые электронные пары (например, кислородом, азотом и фтором). Ярчайший пример, на котором лучше рассмотреть подобное явление, – это вода. Она, можно сказать, прошита водородными связями, которые слабее ковалентных или ионных, но за счёт того, что их много, оказывают значительное влияние на свойства вещества. По сути, водородная связь – это электростатическое взаимодействие, которое связывает молекулы воды в димеры и полимеры, обосновывая её высокую температуру кипения.
Гидроген в составе минеральных соединений
В состав всех неорганических кислот входит протон – катион такого атома, как водород. Вещество, кислотный остаток которого имеет степень окисления больше (-1), называется многоосновным соединением. В нём присутствует несколько атомов водорода, что делает диссоциацию в водных растворах многоступенчатой. Каждый последующий протон отрывается от остатка кислоты всё труднее. По количественному содержанию водородов в среде определяется его кислотность.

Водород содержат и гидроксильные группы оснований. В них водород соединён с атомом кислорода, в результате степень окисления этого остатка щёлочи всегда равна (-1). По содержанию гидроксилов в среде определяется её основность.
Применение в деятельности человека
Баллоны с веществом, так же как и емкости с другими сжиженными газами, например кислородом, имеют специфический внешний вид. Они выкрашены в темновато-зелёный цвет с ярко-красной надписью «Водород». Газ закачивают в баллон под давлением порядка 150 атмосфер. Физические свойства водорода, в частности легкость газообразного агрегатного состояния, используют для наполнения им в смеси с гелием аэростатов, шаров-зондов и т.д.
Водород, физические и химические свойства которого люди научились использовать много лет назад, на сегодняшний момент задействован во многих отраслях промышленности. Основная его масса идёт на производство аммиака. Также водород участвует в получении металлов (гафния, германия, галлия, кремния, молибдена, вольфрама, циркония и прочих) из окислов, выступая в реакции в качестве восстановителя, синильной и соляной кислот, метилового спирта, а также искусственного жидкого топлива. Пищевая промышленность использует его для превращения растительных масел в твёрдые жиры.
Определили химические свойства и применение водорода в различных процессах гидрогенизации и гидрирования жиров, углей, углеводородов, масел и мазута. С помощью него производят драгоценные камни, лампы накаливания, проводят ковку и сварку металлических изделий под воздействием кислородно-водородного пламени.
Элемент водород начинает Периодическую систему – он имеет порядковый номер 1. Это самый легкий из химических элементов. Обладая уникальными свойствами, частично напоминающими свойства галогенов, частично – щелочных металлов, он оказывается расположенным и в первой, и в VII группах Периодической системы.
Строение водорода
Атом водорода имеет очень простое строение – в нем содержится всего один протон и один электрон. Отдавая электрон, атом приобретает степень окисления +1, а принимая его – степень окисления –1. Относительная атомная масса атома водорода равна 1. Однако в природе существуют и более тяжелые атомы водорода – дейтерий (содержит один нейтрон, поэтому его масса равна 2) и тритий (содержит два нейтрона, атомная масса равна 3).

Водород – самый распространенный элемент во Вселенной. На Земле он уступает по распространенности кислороду, кремнию и некоторым другим элементам. Главное соединение водорода – вода. Также он содержится в природном газе, нефти, в некоторых минералах, в белках, жирах и углеводах.
Физические свойства
При обычных условиях водород – газ, состоящий из двухатомных молекул. Он не имеет ни цвета, ни запаха, мало растворим в воде (1,82 мл в 100 г воды при 20 $^circ C$). При сильном сжатии и охлаждении переходит в жидкое состояние. Жидкий водород кипит при –253°C, при этой температуре азот и кислород находятся в кристаллическом состоянии. Твердый водород образуется при охлаждении до –259°C.
Газообразный водород обладает рядом уникальных свойств. Благодаря маленькому радиусу атомы и молекулы водорода могут проникать через резину, стекло и даже через металлы. Некоторые металлы, например, платина и палладий, способны растворять значительные количества газообразного водорода. Водород в 14,5 раз легче воздуха, 100 л водорода при 0$^circ C$ весят всего 9 г. Это самый легкий из газов и самое легкое вещество.
Химические свойства
При комнатной температуре реагирует лишь с фтором, а на свету – с хлором, при нагревании – с кислородом, серой, азотом, углеродом:
H$_2$ + X$_2$ = 2HX (X = F, Cl)
2H$_2$ + O$_2$ = 2H$_2$O,
H$_2$ + S = H$_2$S,
3H$_2$ + N$_2$ = 2NH$_3$.
С кислородом и воздухом водород образует взрывчатые смеси. Особенно опасна смесь одного объема кислорода и двух объемов водорода. Ее называют гремучим газом.
При взаимодействии с щелочными и щелочноземельными металлами образует гидриды. Восстанавливает некоторые металлы из оксидов:
CuO + H$_2$ = Cu + H$_2$O
HgO + H$_2$ = Hg + H$_2$O
Получение водорода
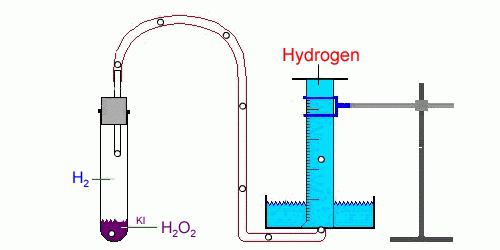
В лаборатории получают действием цинка на разбавленные кислоты – серную или соляную:
Zn + H$_2$SO$_4$ = ZnSO$_4$ + H$_2$
Реакцию обычно проводят в аппарате Киппа.
Также образуется при действии растворов щелочей на цинк, кремний и алюминий, при реакции щелочных и щелочноземельных металлов и их гидридов с водой.
В промышленности водород получают электролизом воды, термическим разложением (пиролизом) углеводородов, в смеси с угарным газом взаимодействием угля и природного газа с перегретым водяным паром (водяной газ, синтез-газ).
Применяется водород в синтезе аммиака, хлороводорода и соляной кислоты, метилового спирта, получении некоторых металлов из оксидов, при гидрировании растительных жиров. В смеси с угарным газом (синтез-газ) используется для получения разнообразным органических веществ. Является перспективным топливом.
