На каких химических свойствах кислорода основано его применение

Четыре элемента-«халькогена» (т.е. «рождающих медь») возглавляют главную подгруппу VI группы (по новой классификации – 16-ю группу) периодической системы. Кроме серы, теллура и селена к ним также относится кислород. Давайте подробно разберем свойства этого наиболее распространенного на Земле элемента, а также применение и получение кислорода.
Распространенность элемента
Содержание кислорода в земной коре составляет практически 50%. Он находится в различных минералах в виде оксидов и солей.
В связанном виде кислород входит в химический состав воды – его процентное соотношение составляет порядка 89%, а также в состав клеток всех живых существ – растений и животных.
В воздухе кислород находится в свободном состоянии в виде О2, занимая пятую часть его состава, и в виде озона – О3.
Физические свойства
Кислород О2 представляет собой газ, который не обладает цветом, вкусом и запахом. В воде растворяется слабо. Температура кипения – 183 градуса ниже нуля по Цельсию. В жидком виде кислород имеет голубой цвет, а в твердом виде образует синие кристаллы. Температура плавления кислородных кристаллов составляет 218,7 градуса ниже нуля по Цельсию.
Химические свойства
При нагревании этот элемент реагирует со многими простыми веществами, как металлами, так и неметаллами, образуя при этом так называемые оксиды – соединения элементов с кислородом. Химическая реакция, в которую элементы вступают с кислородом, называется окислением.
Например,
4Na + О2= 2Na2O
S + О2 = SO2
Некоторые из сложных веществ также вступают в реакцию с кислородом, тоже образуя при этом оксиды:
СН4 + 2О2= СО2 + 2Н2О
2СО + О2 = 2СО2
Если какое-либо вещество медленно реагирует с кислородом, то такое окисление называется медленным. Например, это процессы разложения пищевых продуктов, гниение.
Получение кислорода
Этот химический элемент можно получить как в лаборатории, так и на промышленном предприятии.
Получение кислорода в лаборатории проводится несколькими способами:
1. С помощью реакции разложения бертолетовой соли (хлората калия).
2. Через разложение перекиси водорода при нагревании ее в присутствии оксида марганца, выступающего в роли катализатора.
3. Через разложение перманганата калия.
Получение кислорода в промышленности проводится такими способами:
1. Для технических целей кислород получают из воздуха, в котором обычное его содержание составляет порядка 20%, т.е. пятую часть. Для этого воздух сначала сжигают, получая смесь с содержанием жидкого кислорода около 54%, жидкого азота – 44% и жидкого аргона – 2%. Затем эти газы разделяют с помощью процесса перегонки, используя сравнительно небольшой интервал между температурами кипения жидкого кислорода и жидкого азота – минус 183 и минус 198,5 градуса соответственно. Получается, что азот испаряется раньше, чем кислород.
Современная аппаратура обеспечивает получение кислорода любой степени чистоты. Азот, который получается при разделении жидкого воздуха, используется в качестве сырья при синтезе его производных.
2. Электролиз воды также дает кислород очень чистой степени. Этот способ получил распространение в странах с богатыми ресурсами и дешевой электроэнергией.
Применение кислорода
Кислород является основным по значению элементом в жизнедеятельности всей нашей планеты. Этот газ, который содержится в атмосфере, расходуется в процессе дыхания растениями, животными и людьми.
Получение кислорода очень важно для таких сфер деятельности человека, как медицина, сварка и резка металлов, взрывные работы, авиация (для дыхания людей и для работы двигателей), металлургия.
В процессе хозяйственной деятельности человека кислород расходуется в больших количествах – например, при сжигании различных видов топлива: природного газа, метана, угля, древесины. Во всех этих процессах образуется оксид углерода. При этом природа предусмотрела процесс естественного связывания данного соединения с помощью фотосинтеза, который проходит в зеленых растениях под действием солнечного света. В результате этого процесса образуется глюкоза, которую растение потом расходует для строительства своих тканей.
Кислород – химический элемент VI группы периодической системы Менделеева и самый распространенный элемент в земной коре (47% от ее массы). Кислород является жизненно важным элементом почти всех живых организмов. Более подробно о функциях и применении кислорода в этой статье.

Общие сведения
Кислород представляет собой бесцветный газ без вкуса и запаха, который плохо растворяется в воде. Он входит в состав воды, минералов, горных пород. Свободный кислород образуется благодаря процессам фотосинтеза. Кислород играет наиважнейшую роль в жизни человека. Прежде всего кислород необходим для дыхания живых организмов. Также он принимает участие в процессах разложения погибших животных и растений.
Воздух содержит около 20,95% по объему кислорода. В гидросфере содержится почти 86% по массе кислорода.
Кислород был получен одновременно двумя учеными, но сделали они это независимо друг от друга. Швед К. Шееле получил кислород при прокаливании селитры и других веществ, а англичанин Дж. Пристли – при нагревании оксида ртути.

Рис. 1. Получение кислорода из оксида ртути
Применение кислорода в промышленности
Области применения кислорода обширны.
В металлургии он необходим для производства стали, которую получают из металлолома и чугуна. Во многих металлургических агрегатах для лучшего сжигания топлива используют воздух, обогащенный кислородом.
В авиации кислород используется как окислитель топлива в ракетных двигателях. Также он необходим для полетов в космос и в условиях, где нет атмосферы.
В области машиностроения кислород очень важен для резки и сварки металлов. Чтобы расплавить металл нужна специальная горелка, состоящая из металлических труб. Эти две трубы вставляются друг в друга. Свободное пространство между ними заполняют ацетиленом и зажигают. Кислород же в это время пускают по внутренней трубке. И кислород и ацетилен подаются из баллона под давлением. Образуется пламя, температура в котором достигает 2000 градусов. При такой температуре плавится практически любой металл.

Рис. 2. Ацетиленовая горелка
Применение кислорода в целлюлозно-бумажной промышленности очень важно. Он используется для отбеливания бумаги, при спиртовании, при вымывании лишних компонентов из целлюлозы (делигнификация).
В химической промышленности кислород используется в качестве реагента.
Для создания взрывчатых веществ необходим жидкий кислород. Жидкий кислород производится путем сжижения воздуха и последующего отделения кислорода от азота.
Применение кислорода в природе и жизни человека
Кислород играет наиважнейшую роль в жизни человека и животных. Свободный кислород существует на нашей планете благодаря фотосинтезу. Фотосинтез – это процесс образования органического вещества на свету с помощью углекислого газа и воды. В результате этого процесса образуется кислород, который необходим для жизнедеятельности животных и человека. Животные и человек потребляют кислород постоянно, растения же расходуют кислород только ночью, а днем производят его.
Применение кислорода в медицине
Кислород находит применение и в медицине. Особенно актуально его использование при затрудненном дыхании во время некоторых заболеваний. Он применяется для обогащения дыхательных путей при туберкулезе легких, а также используется в наркозной аппаратуре. Кислород в медицине используется для лечения бронхиальной астмы, болезней желудочно-кишечного тракта. Для этих целей используют кислородные коктейли.
Также большое значение имеют кислородные подушки – прорезиненная емкость, заполненная кислородом. Она служит для индивидуального применения медицинского кислорода.
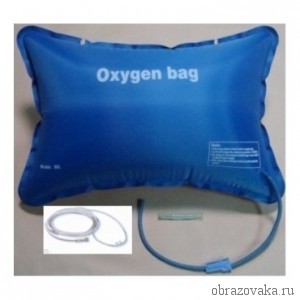
Рис. 3. Кислородная подушка
Что мы узнали?
В данном сообщении, которое охватывает тему «Кислород» по химии 9 класса кратко даны общие сведения о свойствах и применении этого газа. Кислород крайне важен для машиностроения, медицины, металлургической области и т.д.
Тест по теме
Оценка доклада
Средняя оценка: 4.6. Всего получено оценок: 387.
Можно легко убедиться в колоссальном значении, которое имеет этот атмосферный газ для живых существ, просто пронаблюдав, как они реагируют на его отсутствие. Если без воды человек способен прожить несколько суток, а без еды – ещё больше, то полное отсутствие кислорода для него – это верная смерть в течение считанных минут. Что с ним при этом происходит, стоит разобраться подробнее.
Кислород является незаменимым элементом в процессе обмена веществ, в ходе которого поступающие в живой организм питательные вещества превращаются в своеобразное «топливо», обеспечивающее работу всех его систем. Это происходит благодаря процессам окисления, при которых О2 вступает в реакцию с самыми разными элементами, образуя новые соединения. В целом количество кислорода в человеческом теле в составе подобных соединений может достигать 2/3 от его общего веса. Такие процессы идут во всех тканях организма, куда О2 доставляется посредством развитой системы кровообращения, охватывающей практически все органы человеческого тела. Кровь же постоянно обогащается им в лёгких, куда он поступает при дыхании. Процессы дыхания и кровообращения идут непрерывно на протяжении всей жизни живого существа. Если прервать любой из них, существо погибнет.
Особенно чувствителен к нехватке кислорода мозг, который при гипоксии гибнет, как правило, первым. Именно поэтому при клинической смерти так важно в кратчайшие сроки возобновить поставку кислорода к этому органу, так как даже при возобновлении работы сердца, мозг, лишенный дыхания дольше определённого срока, претерпевает необратимые изменения, и восстановить его невозможно. Кроме мозга наиболее подвержены патологическим изменениям при нехватке О2 сердце, печень, почки, центральная нервная система.
Последствия гипоксии
Кислородную недостаточность различают также по степени и характеру протекания. Последствия её в каждом случае будут разными. Все их также можно разделить на:
патологические (когда результатом недостаточности О2 становятся патологические изменения органов и нарушение их функций);
компенсаторные (когда организм пытается приспособиться к неблагоприятным условиям путём мобилизации защитных механизмов либо изменением режима функционирования различных органов, примером чего может служить тахикардия, изменение состава и объёма крови и т.д.).
Как уже упоминалось, мгновенная гипоксия приводит к необратимым изменениям и в итоге – к летальному исходу. Такая картина наблюдается при отравлении некоторыми веществами (например, после приёма цианидов). Острая и хроническая кислородная недостаточность может иметь множество самых разнообразных последствий практически для всех органов и систем:
Со стороны головного мозга и ЦНС могут наблюдаться снижение скорости реакций, ухудшение памяти, торможение мыслительных процессов, разнообразные психические расстройства.
В соединительных тканях при недостаточном их снабжении кислородом могут возникать дистрофические изменения.
Нарушаются детоксифицирующие функции печени, запускается процесс дегенеративных изменений её тканей.
Происходят негативные изменения в работе пищеварительных органов и нормальном ходе обменных процессов.
Со стороны опорно-двигательного аппарата также наблюдается ускорение дегенеративных процессов, развиваются артриты и артрозы, остеопороз, возникают проблемы с позвоночником.
Ухудшается выделительная функция почек.
Даже незначительная хроническая кислородная недостаточность крайне негативно влияет на здоровье человека в целом и с течением времени может привести к серьёзным проблемам. Так, здоровый изначально человек, помещённый в условия хронической нехватки кислорода (например, обитатель современного мегаполиса с сильно загрязненной выхлопными газами и промышленными выбросами атмосферой) сталкивается с её последствиями в виде:
существенного снижения иммунитета;
возникновения симптомов хронической усталости;
появления проблем со слухом и зрением;
преждевременного старения;
развития депрессивных состояний;
общего снижения работоспособности;
возникновение частых и беспричинных тошноты и рвоты;
появления одышки, бессонницы и хронических головных болей неясной этиологии;
развития онкологических заболеваний.
Список статей о кислороде, кислородной недостаточности по ссылке…
Лекция «Кислород –
химический элемент и простое вещество»
План
лекции:
1. Кислород – химический элемент:
а)
Характеристика химического элемента – кислорода по его положению в ПСХЭ
б)
Валентные возможности атома кислорода
в)
Распространённость химического элемента в природе
2. Кислород – простое вещество
а)
Получение кислорода
б)
Химические свойства кислорода
в)
Круговорот кислорода в природе
г)
Применение кислорода
«Dum spiro spero» (Пока дышу, надеюсь…), — гласит
латынь
Дыхание – это синоним
жизни, а источник жизни на Земле – кислород.

Подчёркивая важность кислорода для земных
процессов, Яков Берцелиус сказал: « Кислород – это вещество, вокруг которого
вращается земная химия»
Материал данной лекции обобщает
ранее полученные знания по теме «Кислород».
1.
Кислород – химический элемент
а)
Характеристика химического элемента – кислорода по его положению в ПСХЭ

Кислород — элемент главной подгруппы шестой группы,
второго периода периодической системы химических элементов
Д. И. Менделеева, с атомным порядковым номером 8. Обозначается
символом O (лат. Oxygenium). Относительная
атомная масса химического элемента кислорода равна 16, т.е. Ar(O)=16.
б)
Валентные возможности атома кислорода
В соединениях кислород
обычно двухвалентен (в оксидах), валентность VI
не существует. В свободном виде
встречается в виде двух простых веществ: О2 («обычный» кислород) и О3
(озон). О2 — газ без цвета и запаха, с относительной молекулярной
массой =32. О3 – газ без цвета с резким запахом, с относительной
молекулярной массой =48.
Внимание! H2O2 (перекись водорода) – O (валентность II)
СО
(угарный газ) – О (валентность III)
в)
Распространённость химического элемента кислорода в природе

Кислород — самый
распространенный на Земле элемент, на его долю (в составе различных соединений,
главным образом силикатов), приходится около 49% массы твердой земной коры.
Морские и пресные воды содержат огромное количество связанного кислорода —
85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по
объёму и 23% по массе. Более 1500 соединений земной коры в своем составе
содержат кислород.
Кислород входит в
состав многих органических веществ и присутствует во всех живых клетках. По
числу атомов в живых клетках он составляет около 20 %, по массовой
доле — около 65 %.
2.Кислород
– простое вещество
а) Получение кислорода
Получение в лаборатории
1) Разложение перманганата калия (марганцовка):
2KMnO4 t˚C=K2MnO4+MnO2+O2↑
2) Разложение перекиси водорода:
2H2O2 MnO2=2H2O + O2↑
3) Разложение бертолетовой соли:
2KClO3 t˚C , MnO2=2KCl + 3O2↑
Получение в промышленности
1) Электролиз воды
2H2O эл. ток=2H2 + O2↑
2) Из воздуха
ВОЗДУХ давление, -183˚C=O2 (голубая жидкость)
В
настоящее время в промышленности кислород получают из воздуха. В лабораториях
небольшие количества кислорода можно получать нагреванием перманганата калия
(марганцовка) KMnO4. Кислород мало растворим в воде и тяжелее
воздуха, поэтому его можно получать двумя способами:
·
вытеснением воды;
·
вытеснением воздуха (кислород будет собираться на
дне сосуда).
Существуют и другие способы получения
кислорода.
Посмотрите видео-сюжет
получение кислорода при разложении марганцовки (перманганата калия). Полученный
кислород можно обнаружить на дне сосуда тлеющей лучинкой – она вспыхнет.
б)
Химические свойства кислорода
Взаимодействие веществ с кислородом называется окислением.
В результате образуются оксиды –
сложные вещества, состоящие из двух элементов, одним из которых является
двухвалентный атом кислорода.
Реакции окисления, протекающие с выделением тепла и
света, называют реакциями горения. Кислород взаимодействует с простыми
веществами – металлами и неметаллами; а так же со сложными веществами.
Изучите алгоритм составления уравнений реакций
окисления на примере алюминия и метана CH4.

в)
Круговорот кислорода в природе
В природе кислород
образуется в процессе фотосинтеза, который происходит в зелёных растениях на
свету. В целях сохранения кислорода в воздухе вокруг городов и крупных
промышленных центров создаются зоны зелёных насаждений.

г)
Применение кислорода
Применение кислорода
основано на его свойствах: кислород поддерживает горение и дыхание.
В заключении ещё раз отметим важность
кислорода для всего живого на нашей планете такими поэтическими строками:
«
Он всюду и везде:
В
камне, в воздухе, в воде,
Он
и в утренней росе
И небес голубизне…»
Тема урока: Свойства и применение кислорода.
Цель урока: изучить физические и химические свойства кислорода, дать общее понятие об оксидах, реакциях горения; рассмотреть практическую значимость и применение; доказать, что кислород — один из важнейших элементов на Земле.
Задачи урока:
Образовательные:
Расширить представления обучающихся о кислороде.
Познакомить со свойствами и применением кислорода.
Совершенствовать умения составлять уравнения химических реакций.
Воспитательные:
Формировать умения работать в парах у каждого обучающегося, считаться с мнением соседа и отстаивать свою точку зрения корректно, выполняя упражнения.
Воспитывать бережное отношение к своему здоровью, окружающей природе, учить понимать прекрасное, ценить произведения искусства.
Развивающие:
Способствовать продолжению развития устойчивого интереса к химической науке и практике.
Совершенствовать навыки самостоятельной работы, развивать умения наблюдать, формулировать высказывания.
Способствовать развитию исследовательских навыков, соблюдая правила техники безопасности.
Совершенствовать умения обобщать и делать выводы.
Планируемые результаты:
личностные: готовность и способность учащихся к саморазвитию, самоопределению; ответственное отношение к учению; способность ставить цели и строить жизненные планы; формирование коммуникативной культуры, ценности здорового и безопасного образа жизни;
метапредметные: уметь ставить цель и планировать пути её достижения, выбирая более рациональные способы решения данной проблемы; учиться корректировать свои действия в связи с изменением создавшейся ситуации; уметь создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач; уметь осознанно использовать речевые средства в соответствии с задачей коммуникации для выражения своих мыслей и потребностей; уметь организовывать совместную работу со сверстниками в парах; уметь находить информацию в различных источниках; владеть навыками самоконтроля, самооценки;
предметные:
знать: основные химические понятия «катализаторы», «оксиды», «реакции горения», «реакции окисления»; физические и химические свойства кислорода; области применения кислорода.
уметь: отличить кислород от других газов; составлять уравнения реакций горения веществ в кислороде; записывать химические формулы оксидов и давать им названия; объяснять, как происходит круговорот кислорода в природе.
Тип урока: урок формирования умений и навыков.
Форма работы: фронтальная, групповая, работа в парах, игровая.
Методы обучения: словесный,частично-поисковый, наглядный, демонстрационный, интерактивный.
Приемы обучения: постановка проблемных вопросов.
Оборудование: компьютер, проектор, презентация «Свойства и применение кислорода. Круговорот кислорода в природе», колбы, пинцет, ложки для сжигания веществ, спиртовка.
Реактивы: уголь, сера, красный фосфор, железная пластина, вода, известковая вода.
ХОД УРОКА
І. Организационный момент. (1 мин.)
(Слайд № 1) Учитель: Добрый день! Прошу всех садиться. Тема сегодняшнего урока «Свойства и применение кислорода».
(Слайд № 2)Мы с вами рассмотрим физические и химические свойства кислорода, сформулируем общие понятия об оксидах, реакциях горения, окисления; ознакомимся с практической значимостью и применением кислорода; а также докажем, что кислород — один из важнейших элементов на Земле.
ІІ. Актуализация знаний. (7 мин.).
Работа с карточками. От 2 до 4 обучающихся получают задание на карточках и выполняют его у доски.
(Слайд № 3)Фронтальный опрос «А ну-ка, химики».
Учитель:Но перед тем как приступить к изучению новой темы, вам следует ответить на следующие вопросы:
Химический знак кислорода? Ответ: О
Относительная атомная масса кислорода? Ответ: 16.
Химическая формула кислорода? Ответ: О2.
Относительная молекулярная масса кислорода? Ответ: 32.
В соединениях кислород обычно какой валентности? Ответ: II.
Расскажите о нахождении кислорода в природе. Ответ: Кислород — самый распространенный химический элемент в земной коре. Кислород — самый распространенный на Земле элемент, на его долю приходится около 49% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по объёму и 23% по массе. Более 1500 соединений земной коры в своем составе содержат кислород. Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет 20,9%, по массовой доле — около 65 %.
Перечислите способы получения кислорода в лаборатории? Ответ: В лаборатории кислород получают следующими способами:
1) Разложение перманганата калия. 2KMnO4 = K2MnO4+MnO2+O2↑
2) Разложение перекиси водорода. 2H2O2 = 2H2O + O2↑
3) Разложение бертолетовой соли. 2KClO3 = 2KCl + 3O2↑
8. Перечислите способы получения кислорода в промышленности. Ответ: В промышленности кислород получают:
1) Электролиз воды. 2H2O = 2H2 + O2↑
2) Из воздуха. ВОЗДУХ давление, -183˚C=O2 (голубая жидкость).
В настоящее время в промышленности кислород получают из воздуха. В лабораториях небольшие количества кислорода можно получать нагреванием перманганата калия (марганцовка) KMnO4. Кислород мало растворим в воде и тяжелее воздуха, поэтому его можно получать двумя способами:
(Слайд № 4. Рисунок1). 9. Установите соответствие между способом получения кислорода и уравнением химической реакцией. Работа в парах.
Способы получения кислорода | Уравнения химических реакций |
А. Разложение перманганата калия. Б. Разложение перекиси водорода. В. Разложение бертолетовой соли. Г. Электролиз воды. Д. Из воздуха. | 1) 2KClO3 = 2KCl + 3O2↑ 2) 2H2O2 = 2H2O + O2↑ 3) ВОЗДУХ = O2 4) 2KMnO4 = K2MnO4 + MnO2 + O2↑ 5) 2H2O = 2H2 + O2↑ |
Ответ: А-4; Б-2; В-1; Г-5; Д-3.
10. Что называют катализаторами? Где эти вещества применяются? Ответ: Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называют катализаторами. Катализаторы широко применяют в химической промышленности. С их помощью удается повысить производительность химических процессов, снизить себестоимость выпускаемой продукции и более полно использовать сырье.
(Слайд № 5. Рисунок2). На какой диаграмме распределение массовых долей элементов отвечает количественному составу (NH4)3PO4? Ответ: 4.
ІІІ. Изучение нового материала. (12 мин.)
(Слайд № 6) Учитель: Физические свойства. Кислород — бесцветный газ, без вкуса и запаха, относительно малорастворим в воде (в 100 объемах воды при температуре 20ºС растворяется 3,1 объема кислорода). Кислород немного тяжелее воздуха: 1л кислорода при нормальных условиях весит 1,43 г, а 1л воздуха — 1,29г. (Нормальные условия — сокращенно: н.у. — температура 0ºС и давление 760 мм.рт.ст., или 1 атм. ≈ 0,1 МПа). При давлении 760 мм.рт.ст. и температуре -183ºС кислород сжижается, а при снижении температуры до -218,8ºС затвердевает.
(Слайд № 7) Химические свойства. Техника безопасности (провести инструктаж!)
Кислород при нагревании энергично реагирует со многими веществами, при этом выделяются теплота и свет. Такие реакции называют реакциями горения. Если опустить в сосуд с кислородом O2 тлеющий уголек, то он раскаляется добела и сгорает, образуя оксид углерода(IV) СO2. Чтобы определить, какое образовалось вещество, в сосуд наливают известковую воду — раствор гидроксида кальция Са(ОН)2. Она мутнеет, так как при этом образуется нерастворимый карбонат кальция СаСO3:
CO2 + Ca(OH)2 = CaCO3↓ + H2O
Видеодемонстрация №1 «Горение угля в кислороде» https://files.school-collection.edu.ru/dlrstore/695aa82a-e84a-fa4d-7b04-16d28ded2fbb/index.htm
(Слайд № 8)Сера горит в O2 ярким синим пламенем с образованием газа с резким запахом — оксида серы(IV)
S + O2 = SO2
Видеодемонтсрация №2 «Горение серы в кислороде» https://files.school-collection.edu.ru/dlrstore/600cd365-f9f2-ae10-56e4-98ee0af7e4c6/index.htm
(Слайд № 9)Горение фосфора в кислороде
Видеодемонстрация №3 «Горение фосфора в кислороде» https://files.school-collection.edu.ru/dlrstore/f83beda5-449d-d3dc-442c-a474a89eeca6/index.htm
Опыт следует проводить под тягой. Следует соблюдать правила обращения с нагревательными приборами. Не допускать попадания горящего фосфора на рабочую поверхность стола. Не вдыхать выделяющийся дым фосфорного ангидрида.
Фосфор Р сгорает в O2 ярким пламенем с образованием белого дыма, состоящего из твердых частиц оксида фосфора(V).
4P + 5O2 = 2P2O5
(Слайд № 10) Горение железа в кислороде
Видеодемонстрация №4 «Горение железа в кислороде» https://files.school-collection.edu.ru/dlrstore/deb6e939-f8c8-fea7-fe24-7b2c80013fd7/index.htm
В кислороде горят и такие вещества, которые обычно считают негорючими, например железо. Если к тонкой стальной проволоке прикрепить спичку, зажечь ее и опустить в сосуд с кислородом, то от спички загорится и железо. Горение железа происходит с треском и разбрасыванием ярких раскаленных искр — расплавленных капель железной окалины Fe3O4. В этом соединении два атома железа трехвалентны и один двухвалентен. Поэтому реакцию горения железа в кислороде можно выразить следующим уравнением:
3Fe + 2O2 = FeO * Fe2O3 или Fe3O4
(Слайд № 11)Взаимодействие вещества с кислородом относится к реакциям окисления.
(Слайд № 12)Горение — это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
(Слайд № 13)В большинстве случаев при взаимодействии веществ с кислородом образуются оксиды.Оксиды — это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
(Слайд № 14)Известны химические элементы, которые непосредственно с кислородом не соединяются. К ним относятся золото Au и некоторые другие. Оксиды этих элементов получают косвенным путем.
(Слайд № 15)Применение кислорода. Основано на его химических свойствах. В больших количествах кислород используют для ускорения химических реакций в разных отраслях химической промышленности и в металлургии. Например, при выплавке чугуна для повышения производительности доменных печей в них подают воздух, обогащенный кислородом.
(Слайд № 16)При сжигании смеси ацетилена или водорода с кислородом в специальных горелках температура пламени достигает 3000ºС. Такое пламя используется для сварки металлов. Если берут кислород в избытке, то пламенем можно резать металл.
(Слайд № 17)Жидкий кислород применяют в ракетных двигателях.
(Слайд № 18)В медицине кислород служит для облегчения затрудненного дыхания. В этом случае кислородом заполняют специальные подушки. Кислородные маски необходимы в высотных полетах, в космосе и при работе под водой.
Кислород расходуется в громадных количествах на многие химические реакции, например на сжигание топлива.
(Слайд № 19)Из сказанного видно, что очень много кислорода расходуется на разнообразную деятельность человека, тратится на процессы дыхания человека, животных, растений, а также на процессы гниения. Человек при дыхании в течение 1 мин в среднем употребляет 0,5 дм³ кислорода, в течении суток — 720 дм³, а в год — 262,8 м³ кислорода, что все жители земного шара (5 миллиардов) в течение года для дыхания используют 1578 миллиардов кубических метров кислорода. Если такой объем кислорода при нормальном давлении поместить в железнодорожные цистерны, то поезд был бы протяженностью более 300 млн км, что равняется расстоянию до Солнца и обратно.
(Слайд № 20)Но все же общая масса кислорода в воздухе заметно не изменяется. Это объясняется процессом фотосинтеза, происходящим в зеленых растениях на свету. В результате этого процесса выделяется кислород. Анимация «Фотосинтез» https://files.school-collection.edu.ru/dlrstore/00000487-1000-4ddd-d288-220046bc4321/098.swf.
С фотосинтезом вы уже знакомились в курсе ботаники. Упрощенно процесс фотосинтеза изображают так:
6CO2 + 6H2O = C6H12O6 + 6O2.
Так в природе происходит непрерывный круговорот кислорода.
В целях сохранения кислорода в воздухе вокруг городов и крупных промышленных центров создаются зоны зеленых насаждений. Специальная служба систематически контролирует содержание кислорода в воздухе. При необходимости применяют меры по устранению загрязнения воздуха.
Физкультминутка. (1 мин.)
IV. Закрепление знаний. (6 мин.)
(Слайд № 21)Задание №1. «Правда или ложь? Если знаешь — разберешь»
Для кислорода верны следующие утверждения:
а) Кислород – бесцветный газ, без вкуса и запаха.
б) Кислород немного легче воздуха.
в) В кислороде горят и такие вещества, которые обычно считают негорючими, например железо.
г) Известны химические элементы, которые непосредственно с кислородом соединяются. К ним относятся золото Au и некоторые другие.
д) Применение кислорода основано на его физических свойствах.
е) Непрерывный круговорот кислорода непосредственно связан с таким процессом, как фотосинтез.
Ответ: а; в; е.
(Слайд № 22)Задание №2. «Скорая помощь»
Вставьте пропущенные вещества в уравнениях реакций:
а) …….. + Ca(OH)2 = CaCO3↓ + H2O
б) S + ……. = SO2
в) ….. + 2O2 = FeO * Fe2O3 или Fe3O4
Ответ: а)CO2 б)O2 в) 3Fe
(Слайд № 23)Задание №3. «Мозговой штурм»
Расставьте коэффициенты в уравнениях реакций.
а) CO2 + H2O = C6H12O6 + O2
б) P + O2 = P2O5
(Слайды № 24-25)Задание №4. «Ассоциации»
С каким применением кислорода ассоциируется данное изображение?
1) в металлургии;
2) для резки металлов;
3) в авиации для дыхания;
4) в авиации для двигателей;
5) для сварки металлов;
6) на взрывных работах;
7) в медицине.
(Слайд № 26)V. Домашнее задание. (1 мин.)
§20,21; №6-9 (с.60). Решите задачи 1-2 (с.60).
Творческое задание: подготовить сообщение №10 с. 60 «Что делается в вашей местности для поддержания определенного содержания кислорода в воздухе? В чем может заключаться ваше участие в этой деятельности?»
(Слайд № 27)VI. Рефлексия. (1 мин.)
Учитель:
Сегодня я узнал…
было трудно…
я понял, что…
я научился…
я смог…
было интересно узнать, что…
меня удивило…
мне захотелось…
VII. Подведение итогов урока. (1 мин.)
(Слайд № 28)В чём горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без….
Обучающиеся: кислорода
(Слайд № 29) Учитель: Правильно. Спасибо за урок! До свидания!
Литература:
[1] Горковенко М. Ю. Поурочные разработки по химии 8 класс к учебникам О. С. Габриеляна, Л. С. Гузея, Г. Е. Рудзитиса. — М: «ВАКО», 2004;
[2] Радецкий А. М., Горшкова В. П. Дидактический материал: химия 8-9 классы — М: Просвещение, 1997.
[3] Химия: неорганическая химия: учебник для 8 класса общеобразовательных учреждений/ Г. Е. Рудзитис, Ф. Г. Фельдман. — М: «Просвещение», 2014 г.
Интернет-ресурсы:
https://files.school-collection.edu.ru/
https://www.e-osnova.ru/
https://www. alhimik.ru/
https://www.hemi.nsu.ru/ucheb165.htm
