На каких химических свойствах хлора основано его

В периодической системе химических элементов Д.И. Менделеева хлор находится в 3 периоде, VII группе, главной (А) подгруппе. Из уроков химии мы знаем, что в эту группу входят элементы с самой высокой окислительной активностью. В электронном облаке хлора находится 17 электронов и до завершения внешнего электронного уровня ему нахватает лишь одного электрона. Любыми способами он пытается отнять его у других элементов, чем и объясняется его высокая химическая активность. Вот что знают о хлоре большинство учеников среднестатистических школ. Однако, данный элемент куда интереснее.
Начнем с истории открытия хлора, но прежде чем перейти к ней позвольте напомнить, что одно из важнейших соединений хлора – хлороводород, было получено Джозефом Пристли в 1772 г. Спустя всего пару лет после этого события (в 1774 г) шведский химик Карл Вильгельм Шееле получил хлор при взаимодействие пиролюзита с вышеупомянутой хлороводородной кислотой:
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
При этом, Шееле отметил схожесть запаха хлора с запахом царской водки (смесью концентрированных азотной и соляной кислот, взятых в соотношение 1:3) и способность вещества взаимодействовать с золотом (Au) и киноварью (HgS). Так же он обратил внимание на его отбеливающие свойства. Однако, он не догадался отнести хлор к простым веществам.
Спустя время, элементарную природу хлора доказал Гемфри Дэви, путем электролиза поваренной соли:
2NaCl = 2Na + Cl2
В 1811 г. Дэви предложил назвать данный элемент «хлорином». Но спустя всего год Ж. Гей-Люссак «сократил» его название до хлора. Кстати, в том же 1811 г. физик Иоган Швейгер предлагал для хлора название «галоген» (рождающий соли), но в итоге это название закрепилось за всеми элементами VII А группы.
В 1826 г. атомная масса хлора была с высокой точностью определена шведским химиков Йенсом Якобом Берцелиусом. Она отличается от современных данных буквально на 0.1%. В настоящее время в школьных учебниках химии, под хлором указывается масса 35.453.
При нормальных условиях, хлор — токсичный удушливый газ, который при попадании в лёгкие вызывает ожог лёгочной ткани и удушье. Не удивительно, что он стал одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. Так, 22 апреля 1915 года немецкая армия распылила 168 тонн хлора около бельгийского города Ипр. Атака началась в 17:00, когда подул слабый восточный ветер. Газ стал двигаться в сторону французских позиций в виде облаков желтовато-зелёного цвета. Надо заметить, что немецкая пехота также пострадала от газов и, не имея достаточного подкрепления, не смогла использовать полученное преимущество до прихода британско-канадских сил. Антанта сразу заявила о том, что Германия нарушила принципы международного права, однако Берлин парировал это заявление тем, что Гаагская конвенция запрещала лишь применение химических снарядов, но не газов.
Отрывок, демонстрирующий разрушительный потенциал хлора во всех красках: «Вся зелень в крепости и в ближайшем районе по пути движения газов была уничтожена, листья на деревьях пожелтели, свернулись и опали, трава почернела и легла на землю, лепестки цветов облетели. Все медные предметы на плацдарме крепости — части орудий и снарядов, умывальники, баки и прочее — покрылись толстым зелёным слоем окиси хлора; предметы продовольствия, хранящиеся без герметической укупорки — мясо, масло, сало, овощи, оказались отравленными и непригодными для употребления.» С.А. Хмельков «Борьба за Осовец»
Интересно, что во Второй мировой войне, несмотря на то, что обе противоборствующие стороны обладали большими запасами отравляющих газов, в боевых действиях они не использовались.
Сейчас, во многих городах водоочистные системы применяют хлор для уничтожения бактерий, путем хлорирования воды. При этом в среднем на один миллион частей воды используют четыре-пять частей хлора. Это количество безвредно для человека, однако иногда после этого вода может иметь привкус хлора.
Для хлорирования воды на водопроводных очистных станциях используется жидкий хлор. При введении хлора в воду образуются хлорноватистая и соляная кислоты:
Cl2 + Н2О = НСlO + НСl
Далее происходит диссоциация образовавшейся хлорноватистой кислоты:
НСlO = Н(+) + СlO(-)
Получающиеся в результате диссоциации хлорноватистой кислоты гипохлоритные ионы СlO(-) обладают наряду с недиссоциированными молекулами хлорноватистой кислоты бактерицидным свойством.
Сумму Сl2, НСlO, СlO(-) называют свободным активным хлором.
Количество активного хлора, необходимого для обеззараживания воды, должно определяться не по количеству болезнетворных бактерий, а по всему количеству органических веществ и микроорганизмов (а также и неорганических веществ, способных к окислению), которые могут находиться в хлорируемой воде.
Еще несколько интересных фактов, о хлоре:
— На долю хлора приходится 0.025% от общего числа атомов земной коры.
— Минимальная потребность человека в хлоре составляет около 800 мг. В сутки.
— Очень много получаемого на производстве хлора уходит на изготовление отбеливающих средств. Особенно широко хлор применяется при отбеливание бумаги.
— Хлор входит в состав многих гербицидов (веществ, для уничтожения сорных растений) и дезинфицирующих средств, так как он хорошо уничтожает микробы.
— Жидкий хлор является одним из самых сильных изоляторов электричества. Он проводит ток почти в миллиард раз хуже, чем дистиллированная вода.
Превратить хлор в жидкость можно с помощью охлаждения и высокого давления.
Если вам понравилась данная статья ставьте лайки и не забывайте подписываться на мой канал. А если вы знаете дополнительные интересные факты о хлоре, обязательно напишите об этом в комментариях.
До новых встреч!
Таблица
^
=>>
v
Хлор в сферической ампуле
(фото сайта periodictable.ru)

При добавлении капли серной кислоты к смеси бертоллетовой соли с сахаром происходит яркая вспышка |
| Поделиться в |
История открытия:
Впервые хлор был получен в 1772 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
4HCl + MnO2 = Cl2 + MnCl2 + 2H2O
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты.
Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Название элемента происходит от греческого clwroz — «зелёный».
Нахождение в природе, получение:
Природный хлор представляет собой смесь двух изотопов 35Cl и 37Cl. В земной коре хлор — самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только в виде соединений в составе минералов: галита NaCl, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2·6H2O, карналлита KCl·MgCl2·6Н2O, каинита KCl·MgSO4·3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В промышленных масштабах хлор получают вместе с гидроксидом натрия и водородом при электролизе раствора поваренной соли:
2NaCl + 2H2О => H2 + Cl2 + 2NaOH
Для рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений используется процесс Дикона (каталитическое окисление хлороводорода кислородом воздуха):
4HCl + O2 = 2H2O + 2Cl2
В лабораториях обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl +8H2O
K2Cr2O7 + 14HCl = 3Cl2 + 2CrCl3 + 2KCl + 7H2O
Физические свойства:
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Хлор заметно растворяется в воде («хлорная вода»). При 20°C в одном объеме воды растворяется 2,3 объема хлора.
Температура кипения = -34°C;
температура плавления = -101°C,
плотность (газ, н.у.) = 3,214 г/л.
Химические свойства:
Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы, металлами и неметаллами (кроме углерода, азота, кислорода и инертных газов). Хлор очень сильный окислитель, вытесняет менее активные неметаллы (бром, иод) из их соединений с водородом и металлами:
Cl2 + 2HBr = Br2 + 2HCl; Cl2 + 2NaI = I2 + 2NaCl
При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли.
Cl2 + H2O HClO + HCl;
Хлор взаимодействует со многими органическими соединениями, вступая в реакции замещения или присоединения:
CH3-CH3 + xCl2 => C2H6-xClx + xHCl
CH2=CH2 + Cl2 => Cl-CH2-CH2-Cl
C6H6 + Cl2 => C6H6Cl + HCl
Хлор имеет семь степеней окисления: -1, 0, +1, +3, +4, +5, +7.
Важнейшие соединения:
Хлороводород HCl — бесцветный газ, на воздухе дымит вследствие образования с парами воды капелек тумана. Обладает резким запахом, сильно раздражает дыхательные пути. Содержится в вулканических газах и водах, в желудочном соке. Химические свойства зависят от того, в каком состоянии он находится (может быть в газообразном, жидком состоянии или в растворе). Раствор HCl называется соляной (хлороводородной) кислотой. Это сильная кислота, вытесняет более слабые кислоты из их солей. Соли — хлориды — твёрдые кристаллические вещества с высокими температурами плавления.
Ковалентные хлориды — соединения хлора с неметаллами, газы, жидкости или легкоплавкие твёрдые вещества, имеющие характерные кислотные свойства, как правило легко гидролизующиеся водой с образованием соляной кислоты:
PCl5 + 4H2O = H3PO4 + 5HCl;
Оксид хлора(I) Cl2O., газ буровато-желтого цвета с резким запахом. Поражает дыхательные органы. Легко растворяется в воде, образуя хлорноватистую кислоту.
Хлорноватистая кислота HClO. Существует только в растворах. Это слабая и неустойчивая кислота. Легко разлагается на соляную кислоту и кислород. Сильный окислитель. Образуется при растворении хлора в воде. Соли — гипохлориты, малоустойчивы (NaClO*H2O при 70 °C разлагается со взрывом), сильные окислители. Широко используется для отбеливания и дезинфекции хлорная известь, смешанная соль Ca(Cl)OCl
Хлористая кислота HClO2, в свободном виде неустойчива, даже в разбавленном водном растворе она быстро разлагается. Кислота средней силы, соли — хлориты, как правило, бесцветны и хорошо растворимы в воде. В отличие от гипохлоритов, хлориты проявляют выраженные окислительные свойства только в кислой среде. Наибольшее применение (для отбелки тканей и бумажной массы) имеет хлорит натрия NaClO2.
Оксид хлора(IV) ClO2, — зеленовато-желтый газ с неприятным (резким) запахом, …
Хлорноватая кислота , HClO3 — в свободном виде нестабильна: диспропорционирует на ClO2 и HClO4. Соли — хлораты; из них наибольшее значение имеют хлораты натрия, калия, кальция и магния. Это сильные окислители, в смеси с восстановителями взрывоопасны. Хлорат калия (бертолетова соль) — KClO3, использовалась для получения кислорода в лаборатории, но из-за высокой опасности её перестали применять. Растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Хлорная кислота HClO4, в водных растворах хлорная кислота — самая устойчивая из всех кислородсодержащих кислот хлора. Безводная хлорная кислота, которую получают при помощи концентрированной серной кислоты из 72%-ной HСlO4 мало устойчива. Это самая сильная одноосновная кислота (в водном растворе). Соли — перхлораты, применяются как окислители (твердотопливные ракетные двигатели).
Применение:
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
— В производстве поливинилхлорида, пластикатов, синтетического каучука;
— Для отбеливания ткани и бумаги;
— Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений;
— Для обеззараживания воды — «хлорирования»;
— В пищевой промышленности зарегистрирован в качестве пищевой добавки E925;
— В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений;
— В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
Биологическая роль и токсичность:
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов. У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Ионы хлора жизненно необходимы растениям, участвуя в энергетическом обмене у растений, активируя окислительное фосфорилирование.
Хлор в виде простого вещества ядовит, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую Мировую войну.
Короткова Ю., Швецова И.
ХФ ТюмГУ, 571 группа.
Источники: Википедия: https://ru.wikipedia.org/wiki/Cl и др.,
Сайт РХТУ им. Д.И.Менделеева: https://www.onx.distant.ru/elements/17-Cl_soed.html
Основаны на процессе окисления анионов Cl-
2Cl— 2e- = Cl20
Электролиз водных растворов хлоридов, чаще — NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ
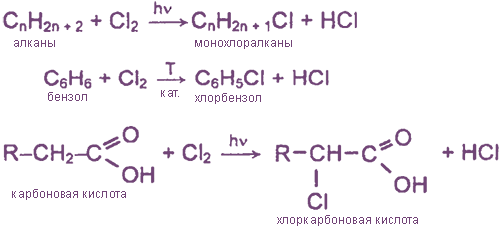
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl— 2e- = Cl20
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:
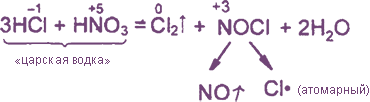
Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.


гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:

Хлорная известь
Хлорная (белильная) известь — смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
Хлор потребляется прежде всего химической промышленностью для производства различных органических хлорпроизводных, идущих для получения пластических масс, синтетических каучуков, химических волокон, растворителей, инсектицидов и т.п. В настоящее время более 60% мирового производства хлора используется для органического синтеза. Помимо этого хлор используют для производства соляной кислоты, хлорной извести, хлоратов и других продуктов. Значительные количества хлора идут в металлургию для хлорирования при переработке полиметаллических руд, извлечения золота из руд, а также его используют в нефтеперерабатывающей промышленности, в сельском хозяйстве, в медицине и санитарии, для обезвреживания питьевой и сточных вод, в пиротехнике и ряде других областей народного хозяйства. В результате развития сфер использования хлора, главным образом благодаря успехам органического синтеза, мировое производство хлора составляет более 20 млн. т/год.
Основные примеры применения и использования хлора во всевозможных отраслях науки, промышленности и бытовых нужд:
1. в производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1,2-дихлорэтан [8].
CH2=CH2+Cl2=>CH2Cl-CH2Cl
CH2Cl-CH2Cl=> CH2=CHCl+HCl

1) в качестве отбеливающего средства (хотя не сам хлор «отбеливает», а атомарный кислород, который образуется при распаде хлорноватистой кислоты по реакции: Cl2 + H2O > HCl + HClO > 2HCl + O*).
2) в производстве хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений (альдрин, ДДТ, гексахлоран). Один из самых важных инсектицидов — гексахлорциклогексан (C6H6Cl6).
3) используется как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт (C4H8Cl2S), фосген (CCl2O).
4) для обеззараживания воды — «хлорирования». Наиболее распространённый способ обеззараживания питьевой воды основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительно-восстановительные процессы [8]. Для обеззараживания питьевой воды применяют: хлор (Cl2), двуокись хлора (ClO2), хлорамин (NH2Cl) и хлорную известь (Ca(Cl)OCl).
5) в пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
6) в химическом производстве каустической соды (NaOH) (применяется в производстве искусственного шелка, в мыловаренной промышленности), соляной кислоты (HCl), хлорной извести, бертолетовой соли (KClO3), хлоридов металлов, ядов, лекарств, удобрений.
7) в металлургии для производства чистых металлов: титана, олова, тантала, ниобия [8].
TiO2 + 2C + 2Cl2 => TiCl4 + 2CO;
TiCl4 + 2Mg => 2MgCl2 + Ti (при Т=850°С)
8) в качестве индикатора солнечных нейтрино в хлор-аргонных детекторах (Идея «хлорного детектора» для регистрации солнечных нейтрино была предложена известным советским физиком академиком Б. Понтекорво и осуществлена американским физиком Р. Девисом и его сотрудникми. Уловив нейтрино ядро изотопа хлора с атомным весом 37, превращается в ядро изотопа аргона-37, при этом образуется один электрон, который можно зарегистрировать.).
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов (глобальные экотоксиканты, обладающие мощным мутагенным, иммунодепрессантным, канцерогенным, тератогенным и эмбриотоксическим действием. Они слабо расщепляются и накапливаются как в организме человека, так и в биосфере планеты, включая воздух, воду, пищу).

