На какие типы делят реакции по признаку состав и число реагентов и продуктов реакции

Химическая реакция — это превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при этом ядра атомов не меняются, происходит только перераспределение электронов и ядер, и образуются новые химические вещества. При химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов (в отличие от ядерных реакций).
Классификация химических реакций схема
Химические реакции классифицируются по тепловому эффекту, по изменению степени окисления атомов в реагирующих веществах, по числу и составу исходных и образующихся веществ, и по признаку обратимости.

Классификация химических реакций по числу и составу исходных и образующихся веществ
Химическая реакция | Определение | Примеры |
Разложения А → В + С + D | Реакция, в которой из одного исходного вещества образуется несколько новых веществ | 2HgO →t→ 2Hg + O2 CaCO3 → CaO + CO2 4HNO3 → 2H2O + 4NO2 + O2 |
Замещения А + ВС → АВ + С | Реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества | Fe + CuSO4 → FeSO4 + Сu CuSO4 + Fe → FeSO4 + Cu 2KBr + Cl2 → 2KCl + Br2 |
Обмена АВ + CD → АС + BD | Реакция, в результате которой два вещества обмениваются своими составными частями, образуя два новых вещества | 2AgNO3 + H2SO4 → Ag2SO4 + 2HNO3 NaOH + HCl → NaCl + H2O CH3COONa + H2O → CH3COOH + NaOH |
Соединения А + В + С → D | Реакция, в результате которой из двух или нескольких веществ образуется одно новое | HCl + NH3 → NH4Cl↓ CaO + H2O → Ca(OH)2 4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 |
Классификация химических реакций по тепловому эффекту
Тепловой эффект химической реакции — это количество теплоты (Q), которое выделяется или поглощается в химической реакции.
Реакция | Определение | Пример |
Эндотермическая | Реакция, проходящая с поглощением теплоты | N2 + O2 → 2NO — 90,4 кДж |
Экзотермическая | Реакция, проходящая с выделением теплоты | Н2 + Сl2 → 2НСl + 92,3 кДж |
Термохимическое уравнение — уравнение химической реакции, в котором указан тепловой эффект реакции:
2Н2 + 0 = 2Н2O + 484 кДж
2NH3 → N2 + ЗН2 — 46,36 кДж.
Термохимические расчеты основаны на законе Гесса:
— тепловой эффект химической реакции зависит от состояний исходных веществ и продуктов реакций, но не зависит от промежуточных стадий процесса
— тепловой эффект химической реакции равен сумме теплот образования продуктов реакции эа вычетом суммы теплот образования исходных веществ
Классификация химических реакций по признаку обратимости
Реакция | Определение | Примеры |
Обратимая | Такая реакция, которая в данных условиях протекает одновременно в двух взаимно противоположных направлениях | ЗН2 + N2 ↔ 2NH3 Вг2 + Н2O ↔ НВrО + НВr |
Необратимая | Такая реакция, которая в данных условиях протекает до конца, т. е. до полного превращения исходных реагирующих веществ в конечные продукты реакции | 2Н2(г) + O2(г) → 2Н2O(ж) СН4 + 2O2 → СO2 + 2Н2O |
Таблица признаки необратимости реакций
Признак | Примеры |
Реакция идет с выделением большого количества теплоты | 2Mg + O2 → 2MgO + Q |
Хотя бы один продукт реакции покидает сферу реакции (выпадает в осадок или выделяется в виде газа) | СаСl2 + Na2SO3 → CaSO3↓ + 2NaCl CaCO3 →t→ CaO + CO2↑ |
В результате реакции образуются малодиссоциируе-мые вещества | (CH3COO)NH4 + H2O → CH3COOH + NH4OH HCl + NaOH → NaCl + H2O |
Классификация химических реакций по изменению степени окисления
Химическая реакция | Определение | Примеры |
Проходящая с изменением степени окисления атомов (окислительно-восстановительная) | реакция, при которой происходит переход электронов от одних атомов, молекул или ионов к другим | H2S-2 + 020 → S0 + Н2O-2 -2KI-1 + Сl20 → 2КСl-1 + I20 |
Проходящая без изменения степени окисления | Реакция, в которой степень окисления каждого атома после реакции остается неизменной | 2АlСl3 + 3Na2S + 6Н2O → 2Аl(ОН)3↓ + 3H2S↑ + 6NaCl H2SO4 + NaOH → NaHSO4 + H2O |
Влияние изменения условий на положение химического равновесия
Изменение условий, при которых система находится в состоянии химического равновесия | Изменение скоростей прямой и обратной реакции в начальный момент | Направление смешения положения равновесия | |
Температура | повышается | В большей степени возрастает скорость эндотермической реакции | В сторону эндотермической реакции |
понижается | В большей степени понижается скорость эндотермической реакции | В сторону экзотермической реакции | |
Давление | повышается | В большей степени возрастает скорость реакции, протекающей с уменьшением числа молей газообразных веществ | В сторону уменьшения числа молей газообразных веществ в системе |
понижается | В большей степени понижается скорость реакции протекающей с уменьшением числа молей газообразных веществ | В сторону увеличения числа молей газообразных веществ в системе | |
Концентрация | повышается | Возрастает скорость реакции, по которой вводимое вещество расходуется | В сторону реакции, по которой вводимое вещество расходуется |
понижается | Уменьшается скорость реакции, где реагентом является вещество, концентрация которого уменьшается | В сторону реакции, по которой образуется вещество, концентрация которого уменьшается | |
Введение катализатора | Скорости прямой и обратной реакции изменяются одинаково | — | |
Поделитесь ссылкой с друзьями:
При протекании химических реакций происходит разрыв одних и возникновение других связей. Химические реакции условно делят на органические и неорганические. Органическими реакциям принято считать реакции, в которых, по крайней мере, одно из реагирующих веществ является органическим соединением, изменяющим свою молекулярную структуру в процессе реакции. Отличием органических реакций от неорганических является то, что, как правило, в них участвуют молекулы. Скорость таких реакции низка, а выход продукта обычно составляет всего лишь 50-80 %. Для повышения скорости реакции применяют катализаторы, повышают температуру или давление. Далее рассмотрим типы химических реакций в органической химии.
Классификация по характеру химических превращений
- Реакции замещения
- Реакции присоединения
- Реакция элиминирования (отщепления)
- Реакция изомеризации и перегруппировка
- Реакции окисления
- Реакции конденсации и поликонденсации
- Реакции разложения
Реакции замещения
В ходе реакций замещения один атом или группа атомов в начальной молекуле замещается на иные атомы или группы атомов, образуя новую молекулу. Как правило, такие реакции характерны для насыщенных и ароматических углеводородов, например:

Реакции присоединения
При протекании реакций присоединения из двух или более молекул веществ образуется одна молекула нового соединения. Такие реакции характерны для ненасыщенных соединений. Различают реакции гидрирования (восстановления), галогенирования, гидрогалогенирования, гидратации, полимеризации и т.п:
- Гидрирование – присоединение молекулы водорода:

- Галогенирование — присоединение молекулы галогена:

- Гидрогалогенирование — присоединение молекулы галогенводорода:

- Гидратация — присоединение молекулы воды:

- Полимеризация – образование высокомолекулярного соединения посредством многократного присоединения низкомолекулярного соединения, например:

Реакция элиминирования (отщепления)
В результате реакций отщепления органические молекулы теряют атомы или группы атомов, и образуется новое вещество, содержащее одну или несколько кратных связей. К реакциям элиминирования относятся реакции дегидрирования, дегидратации, дегидрогалогенирования и т.п.:
- Дегидрирование – отщепления молекулы водорода:

- Дегидратация – отщепление молекулы воды:

- Дегидрогалогенирования – отщепления молекулы галогеноводородов:

Реакции изомеризации и перегруппировка
В ходе таких реакций происходит внутримолекулярная перестройка, т.е. переход атомов или групп атомов с одного участка молекулы в другое без изменения молекулярной формулы вещества, участвующего в реакции, например: 

Реакции окисления
В результате воздействия окисляющего реагента происходит повышение степени окисления углерода в органическом атоме, молекуле или ионе процесс за счет отдачи электронов, вследствие чего образуется новое соединение: 
Реакции конденсации и поликонденсации
Заключаются во взаимодействии нескольких (двух и более) органических соединений с образованием новых С-С связей и низкомолекулярного соединения:

Поликонденсация – образование молекулы полимера из мономеров, содержащих функциональные группы с выделением низкомолекулярного соединения. В отличие от реакции полимеризации, в результате которых образуется полимер, имеющий состав, аналогичный мономеру, в результате реакций поликонденсации состав образованного полимера отличается от его мономера:

Реакции разложения
Это процесс расщепления сложного органического соединения на менее сложные или простые вещества:

С18H38 → С9H18 + С9H20
Классификация химических реакций по механизмам
Протекание реакций с разрывом ковалентных связей в органических соединениях возможно по двум механизмам (т.е. пути, приводящему к разрыву старой связи и образованию новой) – гетеролитическому (ионному) и гомолитическому (радикальному).
Гетеролитический (ионный) механизм
В реакциях, протекающих по гетеролитическому механизму образуются промежуточные частицы ионного типа с заряженным атомом углерода. Частицы, несущие положительный заряд называются карбкатионы, отрицательный – карбанионы. При этом происходит не разрыв общей электронной пары, а ее переход к одному из атомов, с образованием иона: 
Склонность к гетеролитическому разрыву проявляют сильно полярные, например Н–O, С–О и легко поляризуемые, например С–Вr, С–I связи.
Реакции, протекающие по гетеролитическому механизму делят на нуклеофильные и электрофильные реакции. Реагент, располагающий электронной парой для образования связи называют нуклеофильным или электронодонорным. Например, HO—,RO—, Cl—, RCOO—, CN—, R—, NH2, H2O, NH3, C2H5OH, алкены, арены.
Реагент, имеющий незаполненную электронную оболочку и способные присоединить пару электронов в процессе образования новой связи.называют электрофильным реагентам относятся следующие катионы: Н+, R3C+, AlCl3, ZnCl2, SO3, BF3, R-Cl, R2C=O
Реакции нуклеофильного замещения
Характерны для алкил- и арилгалогенидов: 
Реакции нуклеофильного присоединения 
Реакции электрофильного замещения

Реакции электрофильного присоединения 
Гомолитический (радикальный механизм)
В реакциях, протекающих по гомолитическому (радикальному) механизму на первой стадии происходит разрыв ковалентной связи с образованием радикалов. Далее образовавшийся свободный радикал выступает в качестве атакующего реагента. Разрыв связи по радикальному механизму свойственен для неполярных или малополярных ковалентных связей (С–С, N–N, С–Н).
Различают реакции радикального замещения и радикального присоединения
Реакции радикального замещения
Характерны для алканов 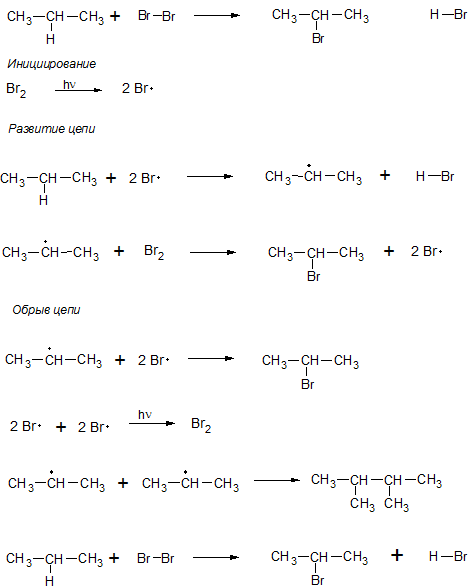
Реакции радикального присоединения
Характерны для алкенов и алкинов 
Таким образом, мы рассмотрели основные типы химических реакций в органической химии
Химические свойства веществ выявляются в разнообразных химических реакциях.
Превращения веществ, сопровождающиеся изменением их состава и (или) строения, называются химическими реакциями. Часто встречается и такое определение: химической реакцией называется процесс превращения исходных веществ (реагентов) в конечные вещества (продукты).
Химические реакции записываются посредством химических уравнений и схем, содержащих формулы исходных веществ и продуктов реакции. В химических уравнениях, в отличие от схем, число атомов каждого элемента одинаково в левой и правой частях, что отражает закон сохранения массы.
В левой части уравнения пишутся формулы исходных веществ (реагентов), в правой части — веществ, получаемых в результате протекания химической реакции (продуктов реакции, конечных веществ). Знак равенства, связывающий левую и правую часть, указывает, что общее количество атомов веществ, участвующих в реакции, остается постоянным. Это достигается расстановкой перед формулами целочисленных стехиометрических коэффициентов, показывающих количественные соотношения между реагентами и продуктами реакции.
Химические уравнения могут содержать дополнительные сведения об особенностях протекания реакции. Если химическая реакция протекает под влиянием внешних воздействий (температура, давление, излучение и т. д.), это указывается соответствующим символом, как правило, над (или «под») знаком равенства.
Огромное число химических реакций может быть сгруппировано в несколько типов реакций, которым присущи вполне определенные признаки.
В качестве классификационных признаков могут быть выбраны следующие:
1. Число и состав исходных веществ и продуктов реакции.
2. Агрегатное состояние реагентов и продуктов реакции.
3. Число фаз, в которых находятся участники реакции.
4. Природа переносимых частиц.
5. Возможность протекания реакции в прямом и обратном направлении.
6. Знак теплового эффекта разделяет все реакции на: экзотермические реакции, протекающие с экзо-эффектом — выделение энергии в форме теплоты (Q>0, ∆H <0):
С +О2 = СО2 + Q
и эндотермические реакции, протекающие с эндо-эффектом — поглощением энергии в форме теплоты (Q<0, ∆H >0):
N2 +О2 = 2NО — Q.
Такие реакции относят к термохимическим.
Рассмотрим более подробно каждый из типов реакций.
Классификация по числу и составу реагентов и конечных веществ
1. Реакции соединения
При реакциях соединения из нескольких реагирующих веществ относительно простого состава получается одно вещество более сложного состава:
A + B + C = D
Как правило, эти реакции сопровождаются выделением тепла, т. е. приводят к образованию более устойчивых и менее богатых энергией соединений.
Реакции соединения простых веществ всегда носят окислительно-восстановительный характер. Реакции соединения, протекающие между сложными веществами, могут происходить как без изменения валентности:
СаСО3 + СО2 + Н2О = Са (НСО3)2,
так и относиться к числу окислительно-восстановительных:
2FеСl2 + Сl2 = 2FеСl3.
2. Реакции разложения
Реакции разложения приводят к образованию нескольких соединений из одного сложного вещества:
А = В + С + D.
Продуктами разложения сложного вещества могут быть как простые, так и сложные вещества.
Из реакций разложения, протекающих без изменения валентных состояний, следует отметить разложение кристаллогидратов, оснований, кислот и солей кислородсодержащих кислот:
to
CuSO4 5H2O=CuSO4 + 5H2O
to
Cu(OH)2=CuO + H2O
to
H2SiO3=SiO2 + H2O.
К реакциям разложения окислительно-восстановительного характера относится разложение оксидов, кислот и солей, образованных элементами в высших степенях окисления:
to
2SO3=2SO2 + O2.
to
4HNO3=2H2O + 4NO2O + O2O.
2AgNO3 = 2Ag + 2NO2 + O2,
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
1
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ Классификационный признак – число и состав исходных веществ и продуктов реакции
2
РЕАКЦИИ РАЗЛОЖЕНИЯ Хим.реакции когда из одного исходного вещества образуется несколько более простых веществ. 2НgO 2Hg + O 2 2H 2 O 2H 2 + O 2 2H 2 O 2 2H 2 O + O 2 2KMnO 4 K 2 MnO 4 + MnO 2 + O 2
3
КАТАЛИЗАТОРЫ Вещества, изменяющие скорость химической реакции, но по окончании их остающиеся качественно и количественно неизменёнными ФЕРМЕНТЫ – биологические катализаторы белковой природы
4
Классификация химических реакций по признаку наличие или отсутствие катализатора Реакции, протекающие с участием катализатора, называются каталитическими. Реакции, протекающие без участия катализатора, называются некаталитическими Реакции, протекающие с участием ферментов, называются ферментативными
5
РЕАКЦИИ СОЕДИНЕНИЯ Хим.реакции, в результате которых из нескольких исходных веществ образуется одно сложное (продукт реакции) Р P 2 O 5 H 3 PO 4 1). 4P + 5O 2 2P 2 O 5 2). P 2 O 5 + 3H 2 O 2H 3 PO 4 Реакции протекающие только в одном направлении называются необратимыми
6
РЕАКЦИИ СОЕДИНЕНИЯ 2SO 2 + O 2 2SO 3 Химические реакции, которые протекают одновременно в двух противоположных направлениях – прямом и обратном, называются обратимыми.
7
Реакции замещения Zn + 2HCl ZnCl 2 + H 2 2Al + 6HCl 2AlCl 3 + 3H 2 2Al + 3H 2 SO 4 Al 2 (SO 4 ) 2 + 3H 2 Реакции, в результате которых атомы простого вещества замещают атомы из химических элементов в сложном веществе, называются реакциями замещения
8
Вытеснительный ряд Бекетова ( ряд активности (напряжений) металлов Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Sn, Pb (H2) Cu, Hg, Ag, Au, Pt. По своей способности вытеснять водород из растворов кислот русский химик Н.Н.Бекетов расположил все металлы в порядке убывания их химической активности (слева направо)
9
РЕАКЦИИ ОБМЕНА 2NaOH + CuSO 4 Cu(OH) 2 + Na 2 SO 4 2NaI + Pb(NO 3 ) 2 PbI 2 + 2NaNO 3 Реакции, в результате которых два сложных вещества обмениваются своими составными частями
10
РЕАКЦИИ ОБМЕНА Протекают в растворах до конца, если в продуктах реакции образуется: А).вещество выпадающее в осадок; Б). газообразное вещество; В). Вода. Na 2 CO 3 + 2HNO 3 2NaNO 3 + H 2 O +CO 2 NaOH + HNO 3 NaNO 3 + H 2 O
11
РЕАКЦИИ ОБМЕНА H + — среда кислая ОН — — среда щелочная H + + ОН — H 2 O – среда нейтральная NaOH + HNO 3 NaNO 3 + H 2 O Реакция обмена между кислотой и основанием называют реакцией нейтрализации
