Киназа mtor какие продукты
Áåëêè æèâîòíîãî ïðîèñõîæäåíèÿ, êèíàçà mTOR è àóòîôàãèÿ
Ïðîâåäåííûå íà ïðîòÿæåíèè 32 ëåò íàáëþäåíèÿ ïîêàçàëè, ÷òî óïîòðåáëåíèå æèâîòíûõ áåëêîâ óâåëè÷èâàåò îáùóþ ñìåðòíîñòü, îñîáåííî ýòî êàñàåòñÿ ïåðåðàáîòàííîãî êðàñíîãî ìÿñà è ÿèö. Êðàñíîå ìÿñî íàèáîëåå çíà÷èìî óâåëè÷èâàëî ñìåðòíîñòü ëþäåé îò ñåðäå÷íî-ñîñóäèñòûõ çàáîëåâàíèé. Ðàñòèòåëüíûé áåëîê, íàîáîðîò, ñíèæàë ñìåðòíîñòü â ñðåäíåì íà 10 % íà êàæäûå 3 % ïîâûøåíèÿ äîëè â ðàöèîíå.
Äàâíî áûëî èçâåñòíî, ÷òî îãðàíè÷åíèå äî íåîáõîäèìîãî ìèíèìóìà óïîòðåáëåíèÿ ìåòèîíèíà íåçàìåíèìîé àìèíîêèñëîòû, êîòîðîé áîëüøå âñåãî â ïðîäóêòàõ æèâîòíîãî ïðîèñõîæäåíèÿ, óâåëè÷èâàåò ìàêñèìàëüíóþ ïðîäîëæèòåëüíîñòü æèçíè ýêñïåðèìåíòàëüíûõ ìûøåé è êðûñ äî 40 % è âûøå. Èçáûòîê ìåòèîíèíà â íàøåì òåëå ïåðåõîäèò â ãîìîöèñòåèí, êîòîðûé óâåëè÷èâàåò ðèñê àòåðîñêëåðîçà è ñåðäå÷íî-ñîñóäèñòûõ çàáîëåâàíèé. Êðîìå òîãî, ìåòèîíèí ñíèæàåò óðîâíè «ãîðìîíîâ äîëãîëåòèÿ» àäèïîíåêòèíà, FGF21 è óâåëè÷èâàåò «ãîðìîíû ñòàðåíèÿ» ëåïòèíà, IGF-1.
Íåêîòîðûå àìèíîêèñëîòû, êîòîðûìè íàèáîëåå áîãàòû æèâîòíûå ïèùåâûå áåëêè (ëåéöèí, àðãèíèí, ëèçèí), âûçûâàþò àêòèâàöèþ êèíàçû mTOR. Ýòîò áåëîê ñ÷èòàåòñÿ âàæíåéøèì ïåðåêëþ÷àòåëåì êëåòî÷íûõ ïðîãðàìì. Êîãäà ïèùè äîñòàòî÷íî, mTOR àêòèâèðóåò ïðîöåññû áèîñèíòåçà íóæíûõ äëÿ ðîñòà êëåòêè áåëêîâ è ñîçäàíèå íîâûõ «ôàáðèê ïî ñáîðêå áåëêîâ» ðèáîñîì. Êîãäà ïèùè î÷åíü ìíîãî, âíîâü îáðàçóåìûõ áåëêîâ ñòàíîâèòñÿ ñòîëüêî, ÷òî êëåòêà íå óñïåâàåò èõ ðàññîðòèðîâûâàòü â îñîáûõ «òðóáîïðîâîäàõ», êîòîðûå íàçûâàþòñÿ ýíäîïëàçìàòè÷åñêîé ñåòüþ. Íåêîòîðûå âíîâü ñèíòåçèðîâàííûå áåëêè íå ìîãóò ïðèíÿòü ðàáî÷óþ ôîðìó, ñáèâàþòñÿ â àãðåãàòû. Âîçíèêàåò ñòðåññ ýíäîïëàçìàòè÷åñêîé ñåòè, ïðèâîäÿùèé ê ñòàðåíèþ èëè ãèáåëè êëåòêè. Ñ äðóãîé ñòîðîíû, mTOR îòêëþ÷àåò çà íåíàäîáíîñòüþ î÷åíü âàæíûé ïðîöåññ, êîòîðûé íàçûâàåòñÿ àóòîôàãèåé.  ðåçóëüòàòå ýòîãî ïðîöåññà êëåòêà îñâîáîæäàåòñÿ îò ñêîïèâøåãîñÿ ìóñîðà àãðåãàòîâ áåëêîâ, îêèñëåííûõ æèðîâ, ïîâðåæäåííûõ ñòðóêòóð, íàïðèìåð îòðàáîòàâøèõ ñâîé âåê êëåòî÷íûõ «ýëåêòðîñòàíöèé» ìèòîõîíäðèé. Îòêëþ÷åíèå àóòîôàãèè îñòàíàâëèâàåò ñàìîî÷èùåíèå êëåòîê è ðåãåíåðàöèþ òêàíåé. Íàïðèìåð, óñòàíîâëåíî, ÷òî áåç àêòèâàöèè àóòîôàãèè íåâîçìîæíî îáðàçîâàíèå íîâûõ ìûøå÷íûõ âîëîêîí. Ñ îäíîé ñòîðîíû, ñòðåññ ýíäîïëàçìàòè÷åñêîé ñåòè, ñ äðóãîé âûêëþ÷åíèå àóòîôàãèè. Âîò òà ïëàòà, êîòîðóþ ìû ïëàòèì çà ïåðååäàíèå æèâîòíûõ áåëêîâ.
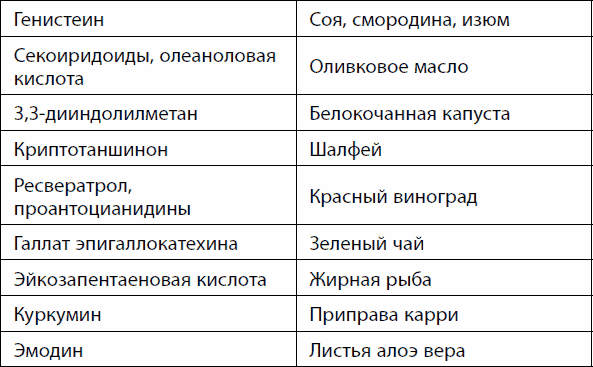
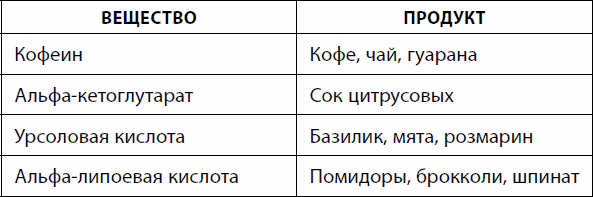
À ÷òî áóäåò, åñëè ïðèãëóøèòü àêòèâíîñòü êèíàçû mTOR? Ãåíåòè÷åñêèå èññëåäîâàíèÿ, ïðîâåäåííûå íà æèâîòíûõ, ïîêàçàëè, ÷òî ýòî ýôôåêòèâíûé ñïîñîá çàìåäëèòü ñòàðåíèå è ïðîäëèòü æèçíü, íî ïðè ýòîì ñòðàäàåò êà÷åñòâî æèçíè, òàê êàê êîíòðîëèðóåìûå mTOR ïðîöåññû âàæíû äëÿ êëåòîê. Áûëè íàéäåíû âåùåñòâà-èíãèáèòîðû, ïîäàâëÿþùèå àêòèâíîñòü mTOR. Ïðèåì îäíîãî èç òàêèõ ïðåïàðàòîâ â ýêñïåðèìåíòàõ íà ñðåäíåâîçðàñòíûõ ìûøàõ ïîçâîëèë ïðîäëèòü æèçíü íà 20 %. Îäíàêî íå îáîøëîñü áåç ïîáî÷íûõ ýôôåêòîâ, ñâÿçàííûõ ñ íåîáõîäèìîñòüþ íåêîòîðîãî óðîâíÿ àêòèâíîñòè mTOR äëÿ êëåòêè.  ýòèõ ýêñïåðèìåíòàõ èñïîëüçîâàëèñü âåùåñòâà, î÷åíü ñèëüíî ïîäàâëÿþùèå àêòèâíîñòü mTOR. Îäíàêî âî ìíîãèõ ïðîäóêòàõ ïèòàíèÿ åñòü ìåíåå ñåëåêòèâíûå èíãèáèòîðû, ñ ìåíüøåé ýôôåêòèâíîñòüþ ïîäàâëÿþùèå mTOR (òàáë. 22). È ýòî çàëîã ìåíüøèõ ïîáî÷íûõ ýôôåêòîâ äëÿ ðîñòà êëåòîê è ðåãåíåðàöèè òêàíåé.
Òàáëèöà 22. Âåùåñòâà èíãèáèòîðû mTOR è ñîäåðæàùèå èõ ïðîäóêòû

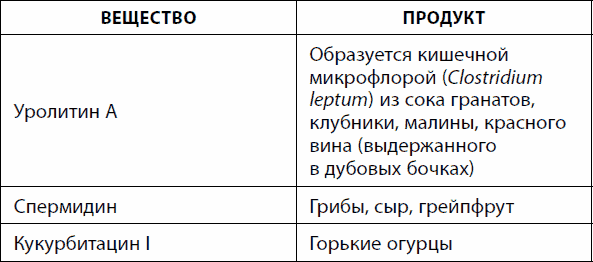
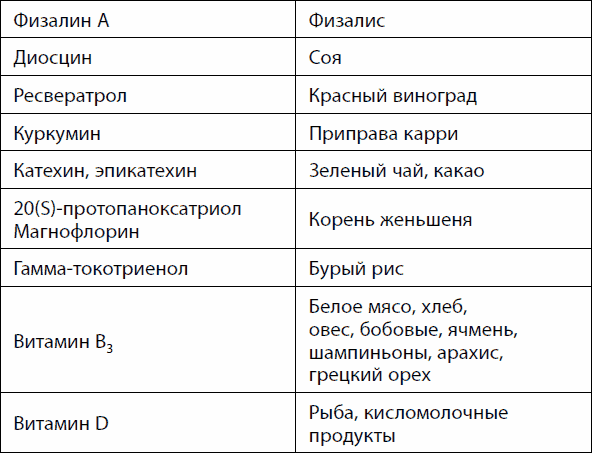
Êàê óæå óïîìèíàëîñü, mTOR ïîäàâëÿåò ïðîöåññ àóòîôàãèè. Åãî ìîæíî ïðîñòèìóëèðîâàòü, óïîòðåáëÿÿ ìåíüøå áåëêîâ æèâîòíîãî ïðîèñõîæäåíèÿ ëèáî ïðîäóêòû, ñîäåðæàùèå îïðåäåëåííûå âåùåñòâà (òàáë. 23). Àóòîôàãèÿ íå òîëüêî ñïîñîáñòâóåò îìîëîæåíèþ íà êëåòî÷íîì óðîâíå, íî è àêòèâèçèðóåò ðåãåíåðàöèþ òêàíåé, íàïðèìåð ìûøå÷íîé.
Òàáëèöà 23. Âåùåñòâà èíäóêòîðû àóòîôàãèè
- mTOR
- Лекарство от диабета может помочь при раке груди
- Активация p7OS6K в клетках нейробластомы
- mTOR подавляет p73
- mTOR и TSC
- mTOR и ограничение калорийности питания (CR)
- В заключение
- Похожие компасы
TOR-киназы
Обзор посвящен протеинкиназам TOR (mTOR), выполняющим в клетке множество функций и связанным с процессом старения.
mTOR

mTOR (mammalian target of rapamycin, мишень для рапамицина у млекопитающих, FK506 binding protein 12-rapamycin associated protein 1 (FRAP1))- белок, кодируемый у млекопитающих геном, серин/треониновая протеинкиназа, регулирующая
— рост клеток
— пролиферацию клеток
— подвижность клеток
— выживание клеток
— синтез белков
— транскрипцию
mTOR интегрирует различные сигнальные пути, в том числе пути инсулина, ростовых факторов и митогенов. mTOR функционирует как сенсор уровня питательных веществ и энергии в клетке, а также окислительно- восстановительного статуса. Нарушение регуляции mTOR приводит к развитию различных заболеваний, в том числе и различных типов рака. Рапамицин ингибирует mTOR через связывание с внутриклеточным рецептором FKBP12. Комплекс FKBP12-рапамицин связывается с FKBP12-рапамицин связывающим доменом (FRB) mTOR. Блокада mTOR приводит к подавлению пролиферативного сигнала и остановке клеточного цикла в фазе G1.
mTOR функционирует в клетке как каталитическая субъединица в двух разных молекулярных комплексах.
Сигнальный путь, в котором задействована протеинкиназа mTOR:
mTORC1 комплекс состоит из mTOR, белка, регулирующего mTOR (Raptor), LST8/G-protein -subunit like protein (mLST8/G L) и недавно идентифицированного PRAS40. Этот комплекс выполняет все вышеописанные функции mTOR. Этот комплекс активируется инсулином, ростовыми факторами, сывороткой, фосфорной кислотой, аминокислотами (в основном лейцином) и оксидативным стрессом.
mTORC1 ингибируется низким уровнем питательных веществ и ростовых факторов, кофеином, рапамицином, FTS и куркумином. Наиболее изученные мишени mTOR- p70-S6 Kinase 1 (S6K1) и 4E-BP1.
mTORC2 комплекс состоит из mTOR, рапамицин- нечувствительного спутника mTOR (Rictor), G L и белка, взаимодействующего со стресс-активируемой протеинкиназой, 1 млекопитающих (mammalian stress-activated protein kinase interacting protein 1 (mSIN1)). mTORC2 регулирует функционирование цитоскелета через активацию F- актиновых микрофиламентов, паксилина, RhoA, Rac1, Cdc42 и протеинкиназы C. mTORC2 фосфорилирует серин/треониновую протеинкиназу Akt/PKB по сериновому остатку.
mTORC2 регулируется инсулином, ростовыми факторами, сывороткой и уровнем питательных веществ.
Выключение функции компонентов mTOR-каскада фосфорилирования продлевает жизнь модельным животным — нематодам и дрозофилам, что может быть связано с переключением программы развития и роста на программу поддержания жизнеспособности в условиях стресса. Однако
в случае мутации стресс-ответ запускается даже в отсутствие внешнего
стресса (голода, перегрева), что позволяет лучше справляться со
спонтанным внутриклеточным стрессом (от свободных радикалов или поврежденной ДНК) и жить дольше.
Лекарство от диабета может помочь при раке груди

Популяционные исследования показали, что использование антидиабетического средства метформина значительно снижает риск рака груди. Исследования на животных показали, что метформин подавляет развитие карциномы молочной железы у трансгенных мышей женского пола, влияя на онкоген HER2 (рецептор эпидермального фактора роста), что не наблюдается при спонтанных опухолях. Испанские ученые из Catalan Institute of Oncology (ICO), Girona Biomedical Research Institute (IdIBGi), Dr. Josep Trueta University Hospital of Girona выяснили, что онкоген HER2 может представлять собой мишень для метформина в отношении его противоопухолевого действия (статья). Во-первых, гиперэкспрессия HER2 значительно усиливает метформин-индуцированное ингибирование роста клеток рака груди. Во-вторых, применение метформина радикально снижает уровень белка HER2 (на 85%). Метформин-индуцированное ингибирование HER2 происходит независимо от молекулярного механизма, приводящего к гиперэкспрессии HER2 (т.е. человеческая HER2 кДНК запускается вирусным промотором, что приводит к амплификации (увеличению числа копий) гена HER2). Метформин- индуцированное подавление гиперэкспрессии HER2 происходит через AMPK-независимое ингибирование активности p70S6K1, которая является эффектором mTOR. Сочетание кРНК (cRNA, РНК, полученная от кДНК)- и миРНК (siRNA)-индуцированной блокады активности/экспрессии AMPK не предотвращает анти-HER2 эффект, в то время как гиперактивация AMPK после действия аналога АМФ AICAR является недостаточной для подавления гиперэкспрессии HER2. HER2-положительные клетки рака груди, подвергнутые трасфецированию siRNA p70S6K1, становятся невосприимчивыми к метформин-индуцированной супрессии. К тому же, инкубирование с веществами, подавляющими продукцию активных форм кислорода (АФК) (например, N-ацетилцистеином) значительно усиливает способность метформина снижать экспрессию HER2. Эти данные позволяют предполагать, что метформин можно использовать в качестве профилактического средства для HER2-положительного рака груди. Кроме того, присутствие или отсутствие таких молекулярных маркеров, как гиперэкспрессия HER2 и/или гиперактивация p70S6K1, может определять отличия в ответе на терапию метформином на ранних стадиях рака груди. Усиление ингибирования mTOR/p70S6K1 в сочетании с подавлением продукции АФК представляет собой ранее неизвестную связь антивозрастного и антиопухолевого действия метформина.
Активация p7OS6K в клетках нейробластомы

Стимуляция холинергических мускариновых рецепторов защищает от повреждения ДНК, оксидативного стресса и митохондриальных нарушений, инсультов, которые могут происходить в ходе развития, старения и нейродегенеративных заболеваний. Недавние исследования показали, что активация мускариновых рецепторов в клетках астроцитомы изменяет экспрессию киназы p70S6K (эффектора mTOR), участвующую в контроле трансляции. Контроль трансляции частично осуществляется каскадом фосфорилирования эффекторных белков анти-апоптотического пути, контролируемого mTOR, и про-апоптотического пути, контролируемого PKR. Французские ученые из University of Poitiers провели работу по исследованию эффектов стимуляции холинергических рецепторов агонистом оксотреморином на анти-апоптотический путь контроля трансляции в клетках человеческой нейробластомы и мозга мыши (статья). Было выяснено, что стимуляция мускариновых рецепторов значительно увеличивает экспрессию фосфорилированных p70S6K, eIF4E и ERK без модификации активности mTOR в клетках нейробластомы, в коре и гиппокампе мыши, через активацию синтеза белка. Эти результаты свидетельствуют о том, что синаптическая активность, активация рецепторов обеспечивают выживание клеток, потеря синаптического сигнала повышает уязвимость для клеточной гибели, запускаемой при инсульте.
mTOR подавляет p73

Семейство p53 содержит три транскрипционных фактора p53, p63 и p73 со схожей доменной структурой и аминокислотной последовательностью. Это семейство регулирует клеточный цикл, индуцирует апоптоз. Как мы уже говорили выше, mTOR регулирует рост клеток и аутофагию в зависимости от ростовых факторов и уровня питательных веществ. Jennifer Rosenbluth и Jennifer Pietenpol из Department of Biochemistry, Center in Molecular Toxicology, Vanderbilt University School of Medicine обнаружили, что, в то время как, mTOR подавляет или усиливает действие p53, p73 ингибируется mTOR (статья). Это имеет важное значение, т.к. в отличие от p53, p73 не мутирует в опухолях. Ученые выяснили, что mTOR является положительным регулятором для p53 и отрицательным для p73. Кроме того, в клетках человечекого эпителия, обработанных рапамицином, обнаруживалось увеличение уровня p73 и снижение уровня p53 и p63. Возможно это необходимо, чтобы полностью активировать p73 в ответ на метаболический стресс.
p53 активирует или подавляет аутофагию в зависимости от контекста клетки (набора ферментов, сигнальных молекул и т.д., присутствующих в конкретной клетке). Показано, что p73 активирует аутофагию и различные ассоциированные с ней гены, подавляющие mTOR. Анализ хроматина показал, что эндогенный p73 связывается с регуляторными регионами таких генов, как ATG5, ATG7 и UVRAG. Остается неизвестным каким образом p73 регулирует уровень экспрессии этих генов в ответ на стресс. Т.к. члены семейства p53 играют ключевую роль в подавлении опухолевых процессов, развитии, старении и нейродегенерации, понимание механизма, согласно которому эти транскрипционные факторы регулируют процесс аутофагии, имеет значение при многих заболеваниях.
mTOR и TSC

Изучением роли TSC-mTOR сигнального пути в развитии диабета, рака и старении занимается лаборатория Ken Inoki из Университета Мичигана. В недавней статье Inoki говорится о роли этого пути в развитии диабетической нефропатии. Комплекс TSC формируется при мутациях в генах опухолевых супрессоров TSC1 и TSC2, что приводит к развитию туберозного склероза, который проявляется формированием опухолей в мозге, почках, сердце, коже, легких. AMPK фосфорилирует и активирует TSC2, что приводит к ингибированию mTOR. LKB1 киназа ингибирует mTORC1 через активацию TSC2. Кроме того, белки Wnt, играющие важную роль в эмбриогенезе и формировании опухолей, активирует
mTORC1 через инактивацию TSC2. GSK3, мишень для ингибирования белками Wnt, функционирует совместно с AMPK, фосфорилируя и активируя TSC2. Важно, что Wnt-индуцируемое развитие опухоли у мышей подавляется рапамицином.
Все эти данные помогают понять как mTOR выполняет свои функции в ответ на действие ростовых факторов и уровень энергии в клетке. Кроме того, это раскрывает молекулярные основы и роль mTOR-сигнального пути в развитии опухолевых заболеваниях.
mTOR и ограничение калорийности питания (CR)

Длительное ограничение калорийности питания (CR) увеличивает продолжительность жизни у модельных животных, но механизм этого явления не вполне ясен. Исследованием этого вопроса занимается лаборатория Peter S. Rabinovitch из Department of Pathology, University of Washington, Seattle (статья). Ученые исследовали экспрессию генов (18 генов) в процессе старения и при CR в сердце и белой жировой ткани у крыс. Как и ожидалось, старение оказывает значительный эффект на процесс транскрипции в обеих тканях, хотя только 21% возраст-ассоциированных генов в сердце изменен в жировой ткани. анализ показал небольшие изменения рибосомальных, протеосомальных и митохондриальных генов при общей схожести старения в сердце и жировой ткани. Эффекты CR на эти ткани отличаются на уровне транскрипции. В сердце CR вызывает незначительные изменения, в то время как в жировой ткани оно значительно подавляет возрастные изменения. В жировой ткани, в отличие от сердца, обнаруживаются гены, экспрессия которых не изменяется в процессе старения и изменяется при CR. Ученые обнаружили экспрессию генов, связанную с mTOR, подавляемой в процессе старения и активируемой при CR и в жировой ткани, и в сердце. Кроме того, экспрессия генов липидного метаболизма, в особенности связанных с PPARgamma-зависимым адипогенезом, с возрастом снижается, но восстанавливается в жировой ткани при CR. Эти данные свидетельствуют о тканеспецифичности различий экспрессии генов в ответ на CR, о том, что CR поддерживает активность mTOR и адипогенез в стареющей жировой ткани.
В заключение
Действие mTOR пока еще мало изучено. Известно, что она является ключевым звеном системы внутриклеточной передачи сигнала, а также играет определенную роль в развитии заболеваний и процессе старения.
1) Как именно mTOR и ее эффекторы участвуют в развитии опухолей и процессе старения?
2) При каких заболеваниях изменяется активность mTOR?
3) Как можно воздействовать на mTOR в целях терапевтического воздействия?
4) Как можно регулировать активность mTOR?
На эти и многие другие вопросы предстоит ответить ученым.
8 января 2009 года
mTOR

mTOR (mammalian target of rapamycin,
мишень для рапамицина у млекопитающих
, FK506 binding protein 12-rapamycin associated protein 1 (FRAP1))- белок, кодируемый у млекопитающих геном FRAP1.
Это серин/треониновая протеинкиназа, регулирующая
—
рост клеток
—
пролиферацию клеток
—
подвижность клеток
—
выживание клеток
—
синтез белков
—
транскрипцию
Основной функцией mTOR является участие в регуляции синтеза белка.
mTOR интегрирует различные сигнальные пути, в том числе пути инсулина, ростовых факторов и митогенов. mTOR функционирует как сенсор уровня питательных веществ и энергии в клетке, а также окислительно- восстановительного статуса. Нарушение регуляции mTOR приводит к развитию различных заболеваний, в том числе и различных типов рака. Рапамицин ингибирует mTOR через связывание с внутриклеточным рецептором FKBP12. Блокада mTOR приводит к подавлению пролиферативного сигнала и остановке клеточного цикла в фазе G1.
Как mTOR действует в клетке?
Сигнальный путь, в котором задействована протеинкиназа mTOR:
Как мы видим на схеме, MTOR функционирует в клетке в составе 2 разных молекулярных комплексов в качестве каталитической субъединицы:
mTORC1
комплекс состоит из mTOR, белка, регулирующего mTOR (Raptor), LST8/G-protein β-subunit like protein (mLST8/GβL) и PRAS40. Этот комплекс выполняет все вышеописанные функции mTOR. Этот комплекс активируется инсулином, ростовыми факторами, сывороткой, фосфорной кислотой, аминокислотами (в основном лейцином) и оксидативным стрессом.
mTORC1 ингибируется низким уровнем питательных веществ и ростовых факторов, кофеином, рапамицином, FTS и куркумином. Наиболее изученные мишени mTOR- p70-S6 Kinase 1 (S6K1) и 4E-BP1.
mTORC2 комплекс состоит из mTOR, рапамицин- нечувствительного спутника mTOR (Rictor), GβL и белка, взаимодействующего со стресс-активируемой протеинкиназой, 1 млекопитающих (mammalian stress-activated protein kinase interacting protein 1 (mSIN1)). mTORC2 регулирует функционирование цитоскелета через активацию F- актиновых микрофиламентов, паксилина, RhoA, Rac1, Cdc42 и протеинкиназы C. mTORC2 фосфорилирует серин/треониновую протеинкиназу Akt/PKB по сериновому остатку.
mTORC2 регулируется инсулином, ростовыми факторами, сывороткой и уровнем питательных веществ.
Выключение функции компонентов mTOR-каскада фосфорилирования продлевает жизнь модельным животным — нематодам и дрозофилам, что может быть связано с переключением программы развития и роста на программу поддержания жизнеспособности в условиях стресса. Однако в случае мутации стресс-ответ запускается даже в отсутствие внешнего
стресса (голода, перегрева), что позволяет лучше справляться со
спонтанным внутриклеточным стрессом (от свободных радикалов или поврежденной ДНК) и жить дольше.
Как мы видим, участвуя в регуляции различных клеточных процессов (транскрипции, синтезе белка, пролиферации) и выживании клеток, а также в реакции на стресс, mTOR принимает активное участие в регуляции процесса старения.
Лекарство от диабета может помочь при раке груди
 Как же mTOR регулирует синтез белка? Он активирует серин/треониновую протеинкиназу p70S6K, которая в свою очередь фосфорилирует и, таким образом, активирует рибосомальный белок S6. Он и индуцирует синтез белка на рибосомах.
Как же mTOR регулирует синтез белка? Он активирует серин/треониновую протеинкиназу p70S6K, которая в свою очередь фосфорилирует и, таким образом, активирует рибосомальный белок S6. Он и индуцирует синтез белка на рибосомах.
Популяционные исследования показали, что использование антидиабетического средства метформина значительно снижает риск рака груди. Исследования на животных показали, что метформин подавляет развитие карциномы молочной железы у трансгенных мышей женского пола, влияя на онкоген HER2 (рецептор эпидермального фактора роста), что не наблюдается при спонтанных опухолях. Испанские ученые из Catalan Institute of Oncology (ICO), Girona Biomedical Research Institute (IdIBGi), Dr. Josep Trueta University Hospital of Girona выяснили, что онкоген HER2 может представлять собой мишень для метформина в отношении его противоопухолевого действия (статья). Во-первых, гиперэкспрессия HER2 значительно усиливает метформин-индуцированное ингибирование роста клеток рака груди. Во-вторых, применение метформина радикально снижает уровень белка HER2 (на 85%). Метформин-индуцированное ингибирование HER2 происходит независимо от молекулярного механизма, приводящего к гиперэкспрессии HER2 (т.е. человеческая HER2 кДНК запускается вирусным промотором, что приводит к амплификации (увеличению числа копий) гена HER2). Метформин- индуцированное подавление гиперэкспрессии HER2 происходит через AMPK-независимое ингибирование активности p70S6K1, которая является эффектором mTOR. Сочетание кРНК (cRNA, РНК, полученная от кДНК)- и миРНК (siRNA)-индуцированной блокады активности/экспрессии AMPK не предотвращает анти-HER2 эффект, в то время как гиперактивация AMPK после действия аналога АМФ AICAR является недостаточной для подавления гиперэкспрессии HER2. HER2-положительные клетки рака груди, подвергнутые трасфецированию siRNA p70S6K1, становятся невосприимчивыми к метформин-индуцированной супрессии. К тому же, инкубирование с веществами, подавляющими продукцию активных форм кислорода (АФК) (например, N-ацетилцистеином) значительно усиливает способность метформина снижать экспрессию HER2. Эти данные позволяют предполагать, что метформин можно использовать в качестве профилактического средства для HER2-положительного рака груди. Кроме того, присутствие или отсутствие таких молекулярных маркеров, как гиперэкспрессия HER2 и/или гиперактивация p70S6K1, может определять отличия в ответе на терапию метформином на ранних стадиях рака груди. Усиление ингибирования mTOR/p70S6K1 в сочетании с подавлением продукции АФК представляет собой ранее неизвестную связь антивозрастного и антиопухолевого действия метформина.
Активация p7OS6K в клетках нейробластомы

Стимуляция холинергических мускариновых рецепторов защищает от повреждения ДНК, оксидативного стресса и митохондриальных нарушений, инсультов, которые могут происходить в ходе развития, старения и нейродегенеративных заболеваний. Недавние исследования показали, что активация мускариновых рецепторов в клетках астроцитомы изменяет экспрессию киназы p70S6K (эффектора mTOR), участвующую в контроле трансляции (о ней мы говорили выше). Контроль трансляции частично осуществляется каскадом фосфорилирования эффекторных белков анти-апоптотического пути, контролируемого mTOR, и про-апоптотического пути, контролируемого PKR. Французские ученые из University of Poitiers провели работу по исследованию эффектов стимуляции холинергических рецепторов агонистом оксотреморином на анти-апоптотический путь контроля трансляции в клетках человеческой нейробластомы и мозга мыши (статья). Было выяснено, что стимуляция мускариновых рецепторов значительно увеличивает экспрессию фосфорилированных p70S6K, eIF4E и ERK без модификации активности mTOR в клетках нейробластомы, в коре и гиппокампе мыши, через активацию синтеза белка. Эти результаты свидетельствуют о том, что синаптическая активность, активация рецепторов обеспечивают выживание клеток, потеря синаптического сигнала повышает уязвимость для индукции клеточной гибели, запускаемой при инсульте.
mTOR подавляет p73
 mTOR- один из многочисленных факторов, регулирующих важнейшие клеточные процессы, связанные в том числе и с процессом старения. В связи с этим необходимо изучить его взаимодействия с другими ключевыми регуляторными факторами, например, с белками семейства p53.
mTOR- один из многочисленных факторов, регулирующих важнейшие клеточные процессы, связанные в том числе и с процессом старения. В связи с этим необходимо изучить его взаимодействия с другими ключевыми регуляторными факторами, например, с белками семейства p53.
Семейство p53 содержит три транскрипционных фактора p53, p63 и p73 со схожей доменной структурой и аминокислотной последовательностью. Это семейство регулирует клеточный цикл, индуцирует апоптоз. Как мы уже говорили выше, mTOR регулирует рост клеток и аутофагию в зависимости от ростовых факторов и уровня питательных веществ. Jennifer Rosenbluth и Jennifer Pietenpol из Department of Biochemistry, Center in Molecular Toxicology, Vanderbilt University School of Medicine обнаружили, что, в то время как, mTOR подавляет или усиливает действие p53, p73 ингибируется mTOR (статья). Это имеет важное значение, т.к. в отличие от p53, p73 не мутирует в опухолях. Ученые выяснили, что mTOR является положительным регулятором для p53 и отрицательным для p73. Кроме того, в клетках человечекого эпителия, обработанных рапамицином, обнаруживалось увеличение уровня p73 и снижение уровня p53 и p63. Возможно это необходимо, чтобы полностью активировать p73 в ответ на метаболический стресс.
p53 активирует или подавляет аутофагию в зависимости от контекста клетки (набора ферментов, сигнальных молекул и т.д., присутствующих в конкретной клетке). Показано, что p73 активирует аутофагию и различные ассоциированные с ней гены, подавляющие mTOR. Анализ хроматина показал, что эндогенный p73 связывается с регуляторными регионами таких генов, как ATG5, ATG7 и UVRAG. Остается неизвестным каким образом p73 регулирует уровень экспрессии этих генов в ответ на стресс. Т.к. члены семейства p53 играют ключевую роль в подавлении опухолевых процессов, развитии, старении и нейродегенерации, понимание механизма, согласно которому эти транскрипционные факторы регулируют процесс аутофагии, имеет значение при многих заболеваниях.
mTOR и TSC

Как в клетках осуществляется регуляция активности MTOR? Она осуществляется в том числе и через ингибитора mTOR- белок TSC.
Изучением роли TSC-mTOR сигнального пути в развитии диабета, рака и старении занимается лаборатория Ken Inoki из Университета Мичигана. В недавней статье Inoki говорится о роли этого пути в развитии диабетической нефропатии. Комплекс TSC формируется при мутациях в генах опухолевых супрессоров TSC1 и TSC2, что приводит к развитию туберозного склероза, который проявляется формированием опухолей в мозге, почках, сердце, коже, легких. AMPK фосфорилирует и активирует TSC2, что приводит к ингибированию mTOR. LKB1 киназа ингибирует mTORC1 через активацию TSC2. Кроме того, белки Wnt, играющие важную роль в эмбриогенезе и формировании опухолей, активирует
mTORC1 через инактивацию TSC2. GSK3, мишень для ингибирования белками Wnt, функционирует совместно с AMPK, фосфорилируя и активируя TSC2. Важно, что Wnt-индуцируемое развитие опухоли у мышей подавляется рапамицином.
Все эти данные помогают понять как mTOR выполняет свои функции в ответ на действие ростовых факторов и уровень энергии в клетке. Кроме того, это раскрывает молекулярные основы и роль mTOR-сигнального пути в развитии опухолевых заболеваниях.
mTOR и ограничение калорийности питания (CR)

Длительное ограничение калорийности питания (CR) увеличивает продолжительность жизни у модельных животных, но механизм этого явления не вполне ясен. Исследованием этого вопроса занимается лаборатория Peter S. Rabinovitch из Department of Pathology, University of Washington, Seattle (статья). Ученые исследовали экспрессию генов (18 генов) в процессе старения и при CR в сердце и белой жировой ткани у крыс. Как и ожидалось, старение оказывает значительный эффект на процесс транскрипции в обеих тканях, хотя только 21% возраст-ассоциированных генов в сердце изменен в жировой ткани. анализ показал небольшие изменения рибосомальных, протеосомальных и митохондриальных генов при общей схожести старения в сердце и жировой ткани. Эффекты CR на эти ткани отличаются на уровне транскрипции. В сердце CR вызывает незначительные изменения, в то время как в жировой ткани оно значительно подавляет возрастные изменения. В жировой ткани, в отличие от сердца, обнаруживаются гены, экспрессия которых не изменяется в процессе старения и изменяется при CR. Ученые обнаружили экспрессию генов, связанную с mTOR, подавляемой в процессе старения и активируемой при CR и в жировой ткани, и в сердце. Кроме того, экспрессия генов липидного метаболизма, в особенности связанных с PPARgamma-зависимым адипогенезом, с возрастом снижается, но восстанавливается в жировой ткани при CR. Эти данные свидетельствуют о тканеспецифичности различий экспрессии генов в ответ на CR, о том, что CR поддерживает активность mTOR и адипогенез в стареющей жировой ткани.
В заключение
Действие mTOR пока еще мало изучено. Известно, что она является ключевым звеном системы внутриклеточной передачи сигнала, а также играет определенную роль в развитии заболеваний и процессе старения.
1) Как именно mTOR и ее эффекторы участвуют в развитии опухолей и процессе старения?
2) При каких заболеваниях изменяется активность mTOR?
3) Как можно воздействовать на mTOR в целях терапевтического воздействия?
4) Как можно регулировать активность mTOR?
На эти и многие другие вопросы предстоит ответить ученым.
8 января 2009 года
