Kclo4 проявляет какие свойства

Галогены образуют ряд соединений с кислородом, которые неустойчивы и могут быть получены только косвенным путем, так как кислород
не взаимодействует с галогенами. Наиболее устойчивы из их соединений соли, наименее — оксиды и кислоты.
Максимальна возможная степень окисления +7. Для фтора возможно только -1, так как фтор является самым электроотрицательным
элементом.
Названия кислородсодержащих кислот и их кислотных остатков вы можете найти в таблице ниже. Заметьте, все они применимы и к
брому, и к йоду. Так например HBrO — бромноватистая кислота (соли гипобромиты), HIO — иодноватистая кислота (соли гипоиодиты).
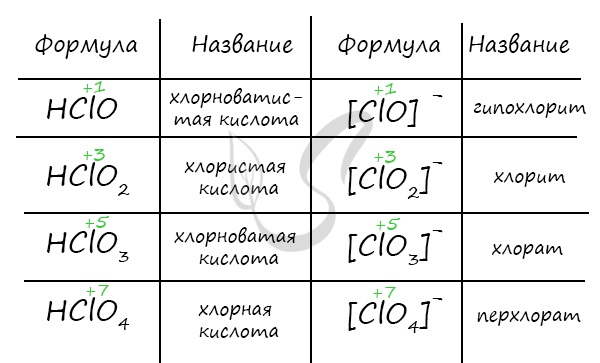
HIO3 — иодноватая кислота (соли иодаты), HBrO3 — бромноватая кислота (соли броматы). По аналогии несложно
составлять подобные названия. Мы будем изучать данную тему на примере соединений хлора.
Получение кислот
- Хлорноватистая кислота
- Хлористая кислота
- Хлорноватая кислота
- Хлорная кислота
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
Cl2 + H2O ⇄ HCl + HClO

KClO + H2O + CO2 → KHCO3 + HClO
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Ca(OCl)2 + CO2 + H2O → CaCl2 + CaCO3 + HClO

Хлористая кислота может быть получена из собственных солей — хлоритов, а также в реакции с оксидом хлора IV.
Ba(ClO2)2 + H2SO4 → BaSO4 + HClO2
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
H2SO4 + Ba(ClO3)2 → BaSO4↓ + HClO3
Самая сильная кислота в природе — хлорная кислота — может быть получение реакцией перхлората калия или натрия с концентрированной серной
кислотой.
KClO4 + H2SO4 → K2SO4 + HClO4

Химические свойства
- Кислотные свойства
- Разложение кислот и солей
- Окислительные свойства
Хлорноватистая и хлористая кислоты относятся к слабым, хлорноватая и хлорная — к сильным. Кислоты образуют соли в
реакциях c основными оксидами и основаниями.
HClO + LiOH → LiClO + H2O
HClO3 + NaOH → NaClO3 + H2O
HClO4 + KOH → KClO4 + H2O
И кислоты, и их соли разлагаются схожим образом.
HClO → HCl + O2
HClO2 → ClO2 + HClO3 + HCl + O2
KClO2 → (t) KClO3 + KCl
KClO2 → KCl + O2
KClO3 → KCl + O2

NaClO3 → (t) NaCl + NaClO4
NaClO3 → (кат.) NaCl + O2↑
KI + HClO → KIO3 + HCl
P + HClO3 → P2O5 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и
галогеном.
KOH + Cl2 → KCl + KClO + H2O
KOH + Cl2 → (t) KCl + KClO3 + H2O

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Основные правила составления окислительно-восстановительных реакций
(скачать pdf файл)
Существует несколько основных правил, которые сильно упрощают составление окислительно-восстановительных реакций. Более подробно эти и другие правила рассматривается на других страницах этого раздела, но для ЕГЭ достаточно знать правила из этого списка.
Правило 1. Реакции простых веществ: металлов и неметаллов с щелочами, кислотами и солями:
1.1) Из металлов только Al, Zn и Be взаимодействуют со щелочами с выделением водорода:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
1.2) Из неметаллов только S, P, Si и галогены реагируют с щелочами:
3S + 6NaOH → Na2SO3 + 2Na2S + 3H2O
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2 (t°, гипофосфит натрия)
Si + 2NaOH + H2O → Na2SiO3 + 2H2
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2.1) Металлы (стоящие в ряду активности металлов до H2) реагируют с кислотами-неокислителями с выделением водорода:
2HCl + Fe → FeCl2 + H2
H2SO4(р) + Fe → FeSO4 + H2
2.2) Все металлы, кроме Pt и Au, реагируют с кислотами-окислителями без выделения водорода:
2H2SO4(к) + 2Ag → Ag2SO4 + SO2 + 2H2O
+ 2H2O
6H2SO4(к) + 2Fe  → Fe2(SO4)3 + 3SO2 + 6H2O
+ 6H2O
2.3) Более сильные металлы вытесняют более слабые из растворов их солей:
Fe + CuSO4 → FeSO4 + Cu
3) Неметаллы не реагируют с кислотами-неокислителями:
C + HCl → реакция не идет
4) Такие неметаллы, как S, C, P могут реагировать с солями, проявляющими окислительные свойства (KClO3, KNO3 в расплавленном состоянии):
6P + 5KClO3 → 3P2O5 + 5KCl
C + 2KNO3 (расплав) → CO2 + 2KNO2
+ 2KNO2
S + 2KNO3 (расплав) → SO2 + 2KNO2
+ 2KNO2
Важная реакция получения фосфора:
5C + 3SiO2 + Ca3(PO4)2 → 5CO + 2P + 3CaSiO3
5) Из неметаллов только S, C, и P реагируют с кислотами-окислителями (в рамках ЕГЭ), а также I2 с HNO3(к):
C + H2SO4(конц.) → CO2 + 2SO2
+ 2SO2 + 2H2O (t)
+ 2H2O (t)
S + 2H2SO4(конц.) → 3SO2 + 2H2O (t)
+ 2H2O (t)
2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)
+ 2H2O (t)
C + 4HNO3(конц.) → CO2 + 4NO2 + 2H2O
+ 2H2O
P + 5HNO3(конц.)  → H3PO4 + 5NO2 + H2O
+ H2O
S + 6HNO3(конц.) → H2SO4 + 6NO2 + 2H2O
+ 2H2O
I2 + 10HNO3(к) → 2HIO3 + 10NO2 + 4H2O (t, другие галогены с кислотами не реагируют)
+ 4H2O (t, другие галогены с кислотами не реагируют)
Правило 2. Фосфор
1) Наиболее устойчивая степень окисления фосфора +5, следовательно, любые другие соединения фосфора окисляются сильными окислителями до этой степени окисления (с образованием P2O5 или фосфат-иона):
PH3 + 8KMnO4 + 11KOH → K3PO4 + 8K2MnO4 + 7H2O
6P + 5KClO3 → 5KCl + 3P2O5
3P2O3 + 4HNO3 + 7H2O → 6H3PO4 + 4NO
Правило 3. Азот
1) Аммиак, как правило, окисляется до азота N2:
8NH3 + 3KBrO4 → 3KBr + 4N2 + 12H2O
+ 12H2O
2NH3 + 3CuO → 3Cu + N2 + 6H2O
+ 6H2O
Исключением является каталитическое окисление аммиака:
4NH3 + 5O2 → 4NO + 6H2O (катализатор)
Обычное горение аммиака протекает с образованием N2 (как и горение любых органических азотсодержащих соединений):
4NH3 + 3O2 → 2N2 + 6H2O
2) Нитрит-ионы окисляются до нитрат-ионов:
3KNO2 + K2Cr2O7 + 4H2SO4 → 3KNO3 + Cr2(SO4)3 + K2SO4 + 4H2O
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2 + 2KOH
+ 2KOH
3) Нитрит-ионы восстанавливаются до азота в реакциях с солями аммония:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O (по сути, идет разложение нитрита аммония: NH4NO2 → N2 + 2H2O)
+ NaCl + 2H2O (по сути, идет разложение нитрита аммония: NH4NO2 → N2 + 2H2O)
Ca(NO2)2 + (NH4)2SO4 → 2N2 + CaSO4 + 4H2O
+ CaSO4 + 4H2O
4) Нитрит-ионы восстанавливаются до оксида азота (II) в реакциях с типичными восстановителями: HI, йодидами, солями Fe+2 и др.:
2KNO2 + 2KI + 2H2SO4 → 2NO + I2 + 2K2SO4 + 2H2O
+ I2 + 2K2SO4 + 2H2O
HNO2 + 2HI → 2NO + I2 + 2H2O
+ I2 + 2H2O
Следующий тип реакций встречается в вариантах Ю.Н. Медведева.
5) Нитрат-ионы могут восстанавливаться до нитрит-ионов (соединениями Cr, Mn, Fe, сплавление в щелочной среде):
3NaNO3 + Cr2O3 + 4KOH → 3NaNO2 + 2K2CrO4 + 2H2O
KNO3 + MnO2 + K2CO3 → KNO2 + K2MnO4 + CO2
2NaNO3 + FeSO4 + 4NaOH → 2NaNO2 + Na2FeO4 + Na2SO4 + 2H2O
6) Восстановление нитратов до аммиака в реакциях с такими металлами, как Al, Zn, Mg (встречается очень редко):
3NaNO3 + 8Al + 5NaOH +18H2O → 3NH3 + 8Na[Al(OH)4]
+ 8Na[Al(OH)4]
NaNO3 + 4Zn + 7NaOH + 6H2O → NH3 + 4Na2[Zn(OH)4]
+ 4Na2[Zn(OH)4]
KNO3 + 4Mg + 6H2O → NH3 + 4Mg(OH)2
+ 4Mg(OH)2 + KOH
+ KOH
7) Взаимодействие азотной кислоты с простыми и сложными веществами
Правило 4. Кислород
1) Перекись водорода окисляется до кислорода O2 типичными окислителями:
KMnO4, K2Cr2O7, галогены, соли кислородсодержащих кислот хлора (например, KClO3) и некоторыми другими.
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
+ 8H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2
+ 3O2 + 4H2O
+ 4H2O
2) Перекись водорода восстанавливается до H2O типичными восстановителями:
KI (HI, йодиды), K2SO3 (SO2, сульфиты), KNO2 (нитриты), PbS (H2S, сульфиды), соединения Cr+3 в щелочной среде, соединения Fe+2, NH3 и некоторыми другими.
H2O2 + Na2SO3 → Na2SO4 + H2O
H2O2 + KNO2 → KNO3 + H2O
3H2O2 + 2NaCrO2 + 2NaOH → 2Na2CrO4 + 4H2O
Свойства пероксида водорода с примерами
Правило 5. Галогены
1) Галогены диспропорционируют в щелочах:
Cl2 + 2NaOH → NaCl + NaClO + H2O (аналогично для Br2, I2)
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O (при нагревании, аналогично для Br2, I2)
2) Простые вещества галогены и соединения галогенов в любой положительной степени окисления восстанавливаются, как правило, до галогенид-ионов (т.е. до ст. ок. -1) в реакциях с типичными восстановителями:
5HClO3 + 6P + 9H2O → 5HCl + 6H3PO4
KClO3 + 6Fe(OH)2 + 18HCl → 6FeCl3 + KCl + 15H2O
2Cl2 + H3PO2 + 7KOH → K3PO4 + 4KCl + 5H2O
2Br2 + CrCl2 + 8NaOH → Na2CrO4 + 2NaCl + 4NaBr + 4H2O
Исключение: соединения йода в высоких степенях окисления могут восстанавливаться до I2, а не до йодид-иона
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2SO4 + 3H2O.
3) Галогенид-ионы окисляются, как правило, до простых веществ: Cl2, Br2, I2:
14HCl + K2Cr2O7 → 3Cl2 + 2CrCl3 + 2KCl + 7H2O
16HCl + 2KMnO4  → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
4) Йодид меди восстанавливает серную кислоту до SO2, тогда как йодиды активных металлов до H2S:
2CuI + 4H2SO4(конц.) → I2 + 2SO2 + 2CuSO4 + 4H2O
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
5) Концентрированной серной кислотой окисляются только бромид- и йодид-ионы. В первом случае образуется SO2, во втором H2S.
2KBr + 2H2SO4(конц.) → Br2 + SO2 + K2SO4 + 2H2O
8KI + 5H2SO4(конц.) → 4I2 + H2S + 4K2SO4 + 4H2O
Правило 6. Сера
1) Сульфид-ионы обычно окисляются до S типичными окислителями: Br2, I2, растворами солей K2Cr2O7, KMnO4 и др.:
3Na2S + K2Cr2O7 + 7H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O
+ Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O
5Na2S + 2KMnO4 + 16HCl → 5S + 2MnCl2 + 10NaCl + 2KCl + 8H2O
+ 2MnCl2 + 10NaCl + 2KCl + 8H2O
H2S + Br2 → S + 2HBr
+ 2HBr
H2S + H2O2 → S + 2H2O (образование H2SO4 возможно, зависит от условий задания)
+ 2H2O (образование H2SO4 возможно, зависит от условий задания)
2) С H2SO4(к) сероводород и сульфиды реагируют с образованием SO2, аналогично реакции кислоты с серой:
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
+ 2H2O (t)
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O (t)
+ 4H2O (t)
K2S + 4H2SO4(конц.) → K2SO4 + 4SO2 + 4H2O
+ 4H2O
В этой реакции сульфид-ион окисляется до SO2: S–2 -6e → S+4.
Часть сульфат-ионов восстанавливается также до SO2 и часть остается для образования соли K2SO4.
3) Окисление H2S и сульфидов до сульфат-ионов протекает в реакциях с такими окислителями, как Cl2 в воде, H2O2, HNO3(конц.) при нагревании:
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O (образование S будет считаться ошибкой!)
+ 4H2O (образование S будет считаться ошибкой!)
PbS + 4H2O2 → PbSO4 + 4H2O (черный сульфид свинца превращается в белый сульфат)
4) Сульфит-ионы любыми окислителями окисляются до сульфат-иона:
3Na2SO3 + 2KMnO4 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
5) Взаимодействие серной кислоты с простыми и сложными веществами
Правило 7. Медь
1) Соединения Cu+2 окисляют соединения S+4 и I– (восстанавливаясь до Cu+1):
2CuCl2 + SO2 + 2H2O → 2CuCl + 2HCl + H2SO4
+ 2HCl + H2SO4
2Cu(NO3)2 + 4KI → 2CuI + I2
+ I2 + 4KNO3
+ 4KNO3
В реакции с аммиаком выделяется металлическая медь:
3CuO + 2NH3 → N2 + 3Cu + 3H2O
+ 3Cu + 3H2O
2) Йодиды меди реагируют с H2SO4(к) с образованием SO2, тогда как йодиды щелочных металлов с образованием H2S:
2CuI + 4H2SO4 → 2CuSO4 + I2 + 2SO2 + 4H2O
8KI + 5H2SO4(конц.) → 4K2SO4 + 4I2 + H2S + 4H2O
3) Медь по-разному реагирует с галогенами:
Cu + Cl2 → CuCl2
Cu + Br2 → CuBr2
2Cu + I2 → 2CuI (соль меди +1)
4) Медь в степени окисления +2 восстанавливается самой медью:
CuO + Cu → Cu2O (t)
CuCl2 + Cu → 2CuCl (t).
Правило 8. Железо
1) Соединения Fe+3 окисляют соединения S–2, S+4, I– и некоторые слабые металлы (восстанавливаясь до Fe+2):
Fe2O3 + 6HI → 2FeI2 + I2 + 3H2O
+ 3H2O
2FeCl3 + 3Na2S → 2FeS + S
+ S + 6NaCl
+ 6NaCl
2FeCl3 + H2S → 2FeCl2 + S + 2HCl
+ 2HCl
2FeCl3 + Na2SO3 +H2O → 2FeCl2 + Na2SO4 + 2HCl
2FeCl3 + Cu → CuCl2 + 2FeCl2 (соль железа +2)
Fe2(SO4)3 + Cu → CuSO4 + 2FeSO4 (соль железа +2)
2Fe(NO3)3 + Fe → 3Fe(NO3)2 (соль железа +2)
2) В кислой среде соединения Fe+2 окисляются такими окислителями, как KMnO4, K2Cr2O7, HNO3, H2SO4(к) и др. до солей Fe+3:
6FeCl2 + Na2Cr2O7 + 14HCl → 6FeCl3 + 2CrCl3 + 2NaCl + 7H2O
3) Железо по-разному реагирует с галогенами:
2Fe + 3F2 → 2FeF3
2Fe + 3Cl2 → 2FeCl3
2Fe + 3Br2 → 2FeBr3
Fe + I2 → FeI2 (соль железа +2)
4) Соединения Fe+2, Fe+3 также могут быть окислены до степени окисления +6 (до ферратов, например, Na2FeO4) очень сильными окислителями, но на ЕГЭ знание этих реакций не проверяется (источник: вебинары от разработчиков экзамена):
3FeSO4 + 2NaClO3 + 12NaOH → 3Na2FeO4 + 2NaCl + 3Na2SO4 + 6H2O.
Правило 9. Марганец
1) В кислой среде образуются соли Mn+2:
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2) В щелочной среде образуется манганат-ион MnO42– (зеленого цвета):
MnSO4 + 2Br2 + 8KOH → K2MnO4+ 4KBr + Na2SO4 + 4H2O
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
+ Na2MnO4 + 2Na2SO4
3) В нейтральной среде образуется осадок бурого цвета MnO2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4
+ K2SO4 + 2H2SO4
2KMnO4 + 3K2S + 4H2O → 2MnO2 + 3S
+ 3S + 8KOH
+ 8KOH
K2MnO4 + Na2S + 2H2O → S + MnO2
+ MnO2 + 2NaOH + 2KOH
+ 2NaOH + 2KOH
Правило 10. Хром
1) Восстановление дихроматов в кислой среде протекает с образованием солей Cr+3:
Na2Cr2O7 + 6NaI + 7H2SO4 → Cr2(SO4)3 + 3I2 + 4Na2SO4 + 7H2O
+ 4Na2SO4 + 7H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 → Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
2) Окисление соединений Cr+2в кислой среде протекает с образованием солей Cr+3:
6CrCl2 + K2Cr2O7 + 14HCl → 8CrCl3 + 2KCl + 7H2O
2CrCl2 + 4H2SO4(конц.) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
3) Окисление соединений Cr+3 очень сильными окислителями с щелочами или с карбонатами щелочных металлов протекает с образованием хроматов (типичные окислители: KNO3, Cl2, KClO3, H2O2 и др. в щел. среде):
Cr2O3 + 3KNO3 + 2K2CO3 → 2K2CrO4 + 3KNO2 + 2CO2
Cr2(SO4)3 + 3Cl2 + 16KOH → 2K2CrO4 + 6KCl + 3K2SO4 + 8H2O
2Cr(OH)3 + KClO3 + 4NaOH → 2Na2CrO4 + KCl + 5H2O
2Cr(OH)3 + 3H2O2 + 4KOH → 2K2CrO4 + 8H2O
4) Соединения Cr+6 в различных средах:
В щелочной среде устойчивы соли хромовой кислоты (хроматы, желтого цвета), например, Na2CrO4.
В кислой среде устойчивы соли дихромовой кислоты (дихроматы, оранжевого цвета), например, Na2Cr2O7.
CrO3 + 2KOH → K2CrO4 + H2O
2K2CrO4 + H2SO4 → K2Cr2O7 + K2SO4 + H2O (в кислотной среде желтая окраска переходит в оранжевую).
Na2Cr2O7 + 2NaOH → 2Na2CrO4 + H2O (в щелочной среде оранжевая окраска переходит в желтую).
Правило 11. Среда раствора
1) С карбонатами щелочных металлов реакции протекают аналогично щелочной среде реакции:
Cr2O3 + 3KNO3 + 2K2CO3 → 2K2CrO4 + 3KNO2 + 2CO2
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
2) Если в реакцию вступает оксид серы (IV) SO2 в нейтральном растворе, то реакция протекает аналогично кислой среде раствора:
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4.
Поэтому очень важно не зубрить окислительно-восстановительные реакции, а знать какие соединения проявляют окислительные, а какие восстановительные свойства, и знать основные правила, приведенные выше.
Основаны на процессе окисления анионов Cl-
2Cl— 2e- = Cl20
Электролиз водных растворов хлоридов, чаще — NaCl:
2NaCl + 2Н2O = Cl2↑ + 2NaOH + H2↑
Окисление конц. HCI различными окислителями:
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-:
Cl20+ 2e- = 2Cl-
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Примеры:
Cl2+ 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Примеры:
Cl2 + Сu = CuCl2
3Cl2 + 2Аu = 2AuCl3
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Примеры:
Cl2 + Н2 =2НС1
Cl2 + 2S (расплав) = S2Cl2
ЗCl2 + 2Р = 2РCl3 (или РCl5 — в избытке Cl2)
2Cl2 + Si = SiCl4
3Cl2 + I2 = 2ICl3
Примеры:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
Cl2 + 2HI = I2 + 2HCl
Cl2 + H2S = S + 2HCl
ЗСl2 + 2NH3 = N2 + 6HCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3-.
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Cl2 + 2КОН =KCl + KClO + Н2O
3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2O
3Cl2 + 2Са(ОН)2 = CaCl2 + Са(ClO)2+ 2Н2O
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
а) замещение атомов водорода в молекулах ОВ

б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
H2C=CH2 + Cl2 → ClH2C-CH2Cl 1,2-дихлорэтан
HC≡CH + 2Cl2 → Cl2HC-CHCl2 1,1,2,2-тетрахлорэтан
Хлороводород и соляная кислота
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
2HCl + F2 = Сl2 + 2HF
4HCl + O2 = 2Сl2 + 2Н2O
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
Н2 + Cl2 = 2HCl
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н+
HCl → H+ + Cl-
Взаимодействие:
а) с металлами (до Н):
2HCl2 + Zn = ZnCl2 + H2
б) с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
в) с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
г) с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
д) с аммиаком:
HCl + NH3 = NH4Cl
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl-окисляется до свободного галогена:
2Cl— 2e- = Cl20
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:

Взаимодействие:
а) с аминами (как органическими основаниями)
R-NH2 + HCl → [RNH3]+Cl-
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.

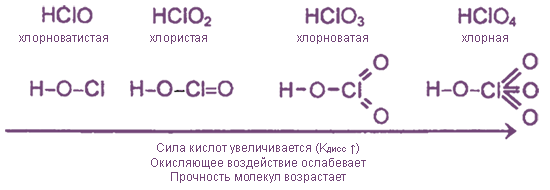
гипохлориты | хлориты | хлораты | перхлораты |
NaClOKClOCa(ClO)2 | Ca(ClO2)2 | KClO3 бертолетова сольMg(ClO3)2 | KClO4NaClO4NH4ClO4 |
1. Все оксокислоты хлора и их соли являются сильными окислителями.
2. Почти все соединения при нагревании разлагаются за счет внутримолекулярного окисления-восстановления или диспропорционирования.
Примеры:
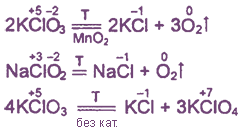
Хлорная известь
Хлорная (белильная) известь — смесь гипохлорита и хлорида кальция, обладает отбеливающим и дезинфицирующим действием. Иногда рассматривается как пример смешанной соли, имеющей в своем составе одновременно анионы двух кислот:

Жавелевая вода
Водный раствор хлорида и гапохлорита калия KCl + KClO + H2O
