Какой тип кристаллической решетки характерен для металлов какие свойства
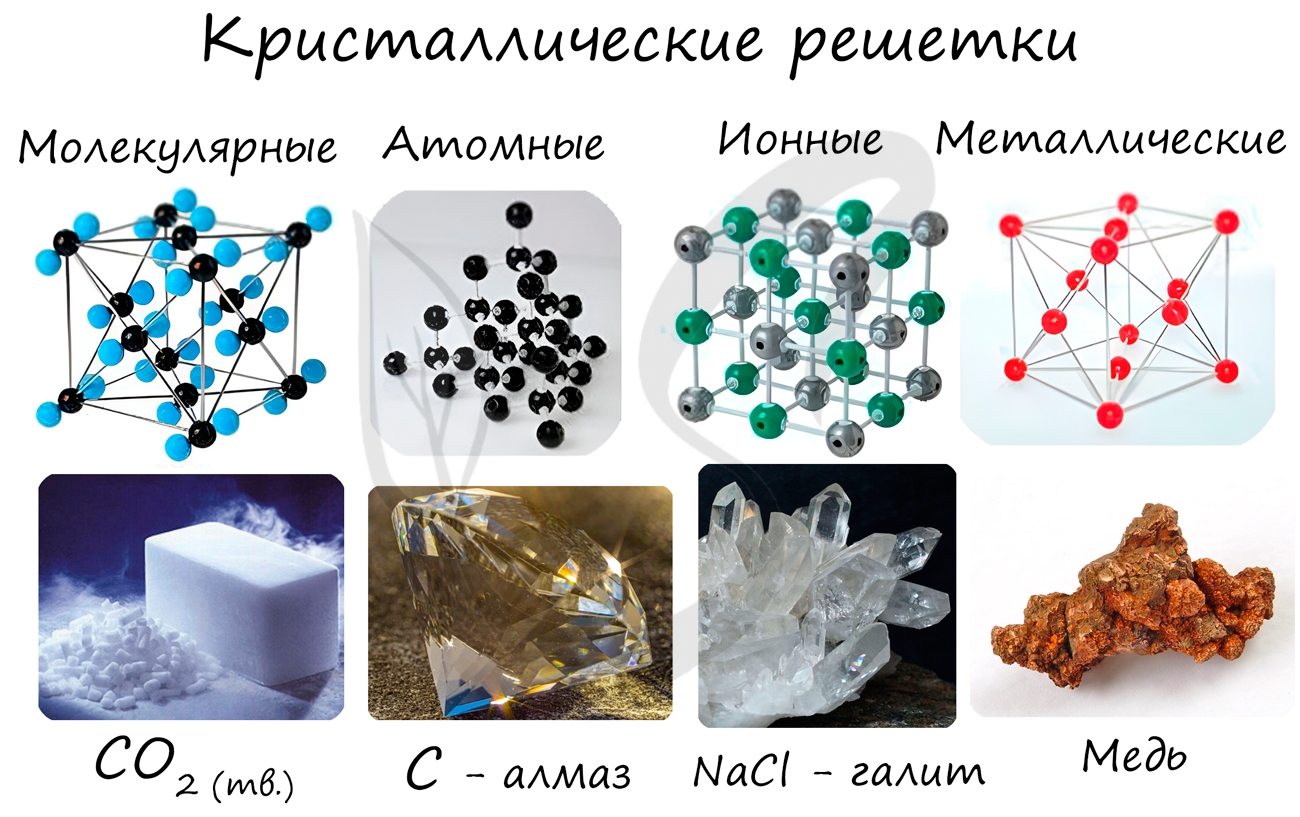
Кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще всего имеют кристаллическое строение).
Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка Точки, в которых размещены частицы, называются узлами кристаллической решетки.
В узлах кристаллической решетки могут находиться ионы, атомы или молекулы.
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионная решетка
Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. Примеры: КОН, СаСО$_3$, СН$_3$СООК, NH$_4$NO$_3$, [CH$_3$NH$_3$]Cl, С$_2$Н$_5$ОК. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная.

Свойства ионных кристаллов:
твердые, но хрупкие;
отличаются высокими температурами плавления;
нелетучи, не имеют запаха;
расплавы ионных кристаллов обладают электропроводностью;
многие растворимы в воде. При растворении в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Атомная решетка
В узлах решетки — атомы, связанные ковалентными связями. Химическая связь — ковалентная полярная или неполярная. Атомная кристаллическая решетка характерна для углерода (алмаз, графит — рисунок), бора, кремния, германия, оксида кремния SiO$_2$ (кремнезем, кварц, речной песок), карбида кремния SiC (карборунд), нитрида бора BN. Свойства: высокая твердость, высокие температуры плавления, нерастворимость, нелетучесть, отсутствие запаха.
Свойства веществ с атомной кристаллической решеткой:
высокая твердость;
высокие температуры плавления;
нерастворимость;
нелетучесть;
отсутствие запаха.
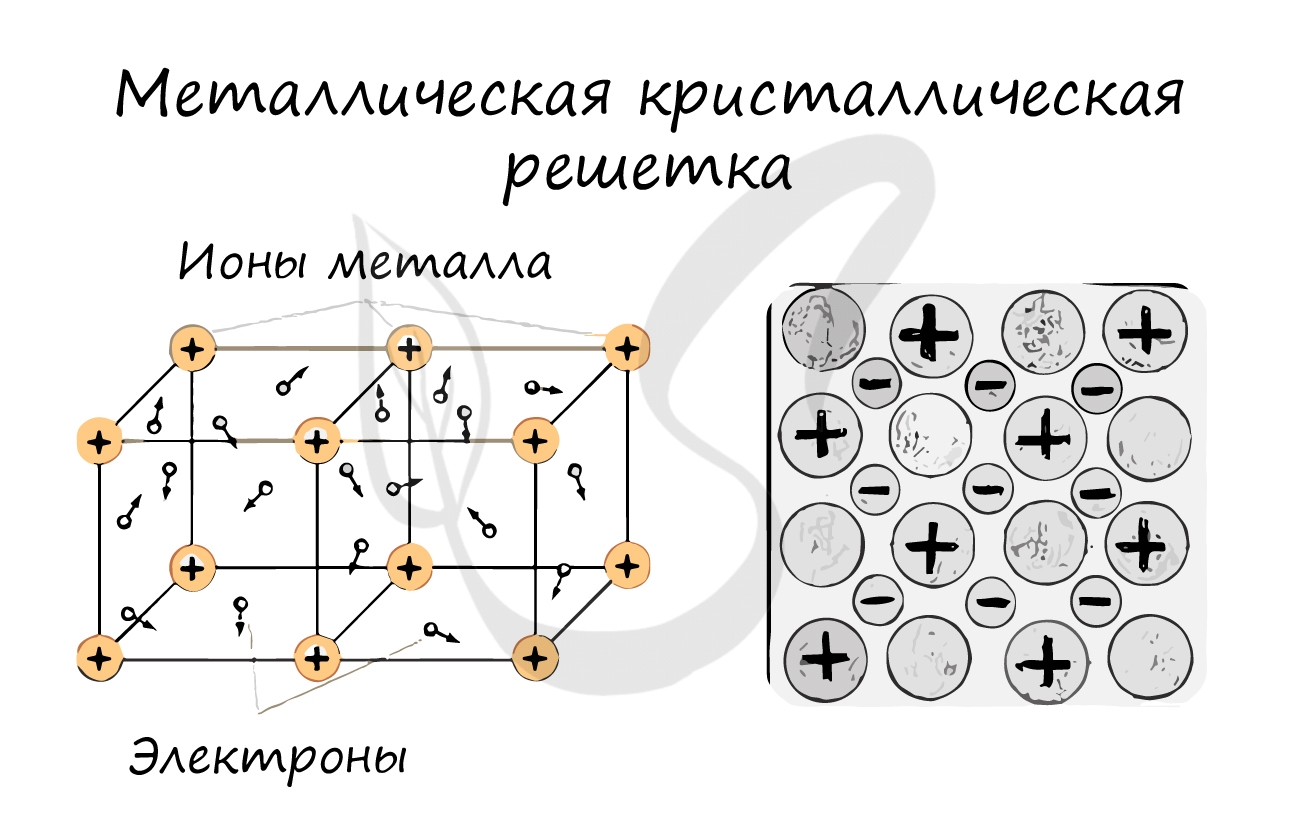
Металлическая решетка
Реализуется в простых веществах — металлах и их сплавах. В узлах решетки — атомы и катионы металла, при этом электроны металла обобществляются и образуют так называемый электронный газ, который движется между узлами решетки, обеспечивая ее устойчивость.

Молекулярные решетки
В узлах — молекулы веществ, которые удерживаются в узлах решетки с помощью слабых межмолекулярных сил.
Молекулярное строение имеют:
все органические вещества (кроме солей);
вещества — газы и жидкости;
легкоплавкие и летучие твердые вещества, в молекулах которых ковалентные связи (полярные и неполярные).
Подобные вещества часто имеют запах.
Обобщающая таблица
Кристаллические решетки, вид связи и свойства веществ
| Тип решетки | Виды частиц в узлах решетки | Вид связи между частицами | Примеры веществ | Физические свойства веществ |
| Ионная | Ионы | Ионная — связь прочная | Соли, галогениды (IA, IIA), оксиды и гидроксиды щелочных и щел.-зем. металлов | Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток |
| Атомная | Атомы | 1. Ковалентная неполярная — очень прочная 2. Ковалентная полярная связь — очень прочная. Простые вещества: алмаз (C), графит (C), бор (B), кремний (Si) | Сложные вещества:оксид алюминия (Al$_2$O$_3$), оксид кремния (IV) SiO$_2$ | Очень твердые, очень тугоплавкие, прочные, нелетучие, нерастворимы в воде |
| Молекулярная | Молекулы | Между молекулами слабые силы межмолекулярного притяжения, внутри молекул прочная ковалентная связь | При обычных условиях – газы, жидкости или летучие твердые вещества (О$_2$, Н$_2$, Cl$_2$, N$_2$, Br$_2$, H$_2$O, CO$_2$, HCl); сера, белый фосфор, иод; органические вещества | Непрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую твердость |
| Металлическая | Атом-ионы | Металлическая разной прочности | Металлы и сплавы | Ковкие, обладают блеском, пластичностью, тепло- и электропроводны |
Большинство твёрдых веществ имеет кристаллическое строение, которое характеризуется строго определённым расположением частиц.
Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой.
Точки, в которых размещены частицы кристалла, называют узлами решётки. В узлах воображаемой решётки могут находиться атомы, ионы или молекулы.
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную, металлическую, атомную и молекулярную.
Ионными называют решётки, в узлах которых находятся ионы.
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионные кристаллические решётки имеют соли, щёлочи, оксиды активных металлов.
Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na+ и хлора Cl−, а в узлах решётки сульфата калия чередуются простые ионы калия K+ и сложные сульфат-ионы SO42−.
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые, тугоплавкие, нелетучие. Такие вещества хорошо растворяются в воде.
Кристаллическая решётка хлорида натрия
Кристалл хлорида натрия
Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Такие кристаллические решётки характерны для простых веществ металлов и сплавов.
Температуры плавления металлов могут быть разными (от (–37) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск, ковкость, пластичность, хорошо проводят электрический ток и тепло.
Металлическая кристаллическая решётка
Металлические изделия
Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит, кремний, бор и германий, а также сложные вещества, например, карборунд SiC и кремнезём, кварц, горный хрусталь, песок, в состав которых входит оксид кремния((IV)) SiO2.
Таким веществам характерны высокая прочность и твёрдость. Так, алмаз является самым твёрдым природным веществом.
У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения. Например, температура плавления кремнезёма — (1728) °С, а у графита она выше — (4000) °С.
Атомные кристаллы практически нерастворимы.
Кристаллическая решётка алмаза
Алмаз
Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость, низкие температуры плавления и кипения.
Многие молекулярные вещества при комнатной температуре представляют собой жидкости и газы.
Такие вещества летучи. Например, кристаллические иод и твёрдый оксид углерода((IV)) («сухой лёд») испаряются, не переходя в жидкое состояние.
Некоторые молекулярные вещества имеют запах.
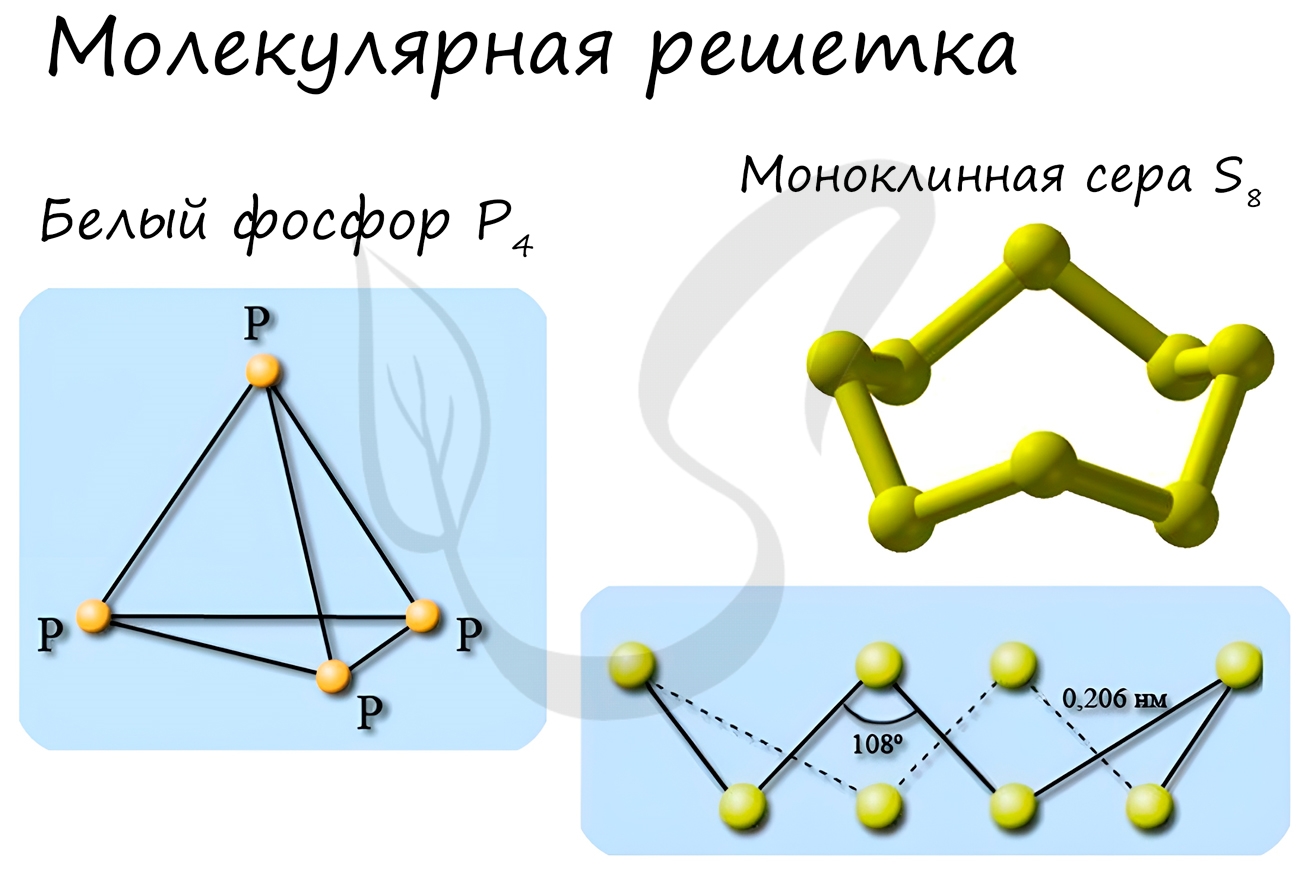
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами (He,Ne,Ar,Kr,Xe,Rn), а также неметаллы с двух- и многоатомными молекулами (H2,O2,N2,Cl2,I2,O3,P4,S8).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд, твёрдые аммиак, кислоты, оксиды большинства неметаллов. Большинство органических соединений тоже представляют собой молекулярные кристаллы (нафталин, сахар, глюкоза).
Кристаллическая решётка углекислого газа
«Сухой лёд»
Кристаллики иода
Если известно строение вещества, то можно предсказать его свойства.
Попробуем определить, каковы примерно температуры плавления у фторида натрия, фтороводорода и фтора.
У фторида натрия — ионная кристаллическая решётка. Значит, его температура плавления будет высокой. Фтороводород и фтор имеют молекулярные кристаллические решётки. Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные. Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Экспериментальные данные подтверждают эти предположения: температуры плавления NaF, HF и F2 составляют соответственно (995) °С, (–83) °С, (–220) °С.
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 133 с.
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки
кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают
пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей.
Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с
молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие
температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2.
Особо хочется отметить красный и белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы
подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли,
оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью — NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко
растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.
Примеры: NaCl, MgCl2, NH4Br, KNO3, Li2O, Na3PO4.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят
электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные,
нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), черный фосфор (P).

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Взаимосвязь
типа химической связи с видом кристаллической решеткиВещества и кристаллические решетки
Твердые вещества бывают аморфные или кристаллические (чаще
всего имеют кристаллическое строение).Кристаллическое строение характеризуется
правильным расположением частиц в определенных точках пространства. При
соединении этих точек воображаемыми прямыми линиями образуется так называемая
кристаллическая решетка. Точки, в которых размещены частицы, называются узлами кристаллической решетки.В узлах кристаллической решетки могут
находиться ионы, атомы или молекулы.В зависимости от вида частиц,
расположенных в узлах кристаллической решетки, и характера связи между ними
различают четыре типа кристаллических решеток:
·
ионные,·
атомные,·
молекулярные и·
металлические.Ионная решетка
Эту решетку образуют все вещества с
ионным типом связи — соли, щелочи, бинарные соединения активных металлов с
активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты,
соли аммония и аминов. В узлах решетки — ионы, между которыми существует
электростатическое притяжение. Ионная связь очень прочная.Примеры:
КОН, СаСО3, СН3СООК, NH4NO3, [CH3NH3]Cl,
С2Н5ОК.Свойства ионных кристаллов:
· твердые, но хрупкие;
· отличаются высокими температурами
плавления;· нелетучи, не имеют запаха;
· расплавы ионных кристаллов обладают
электропроводностью;· многие растворимы в воде; при растворении
в воде диссоциируют на катионы и анионы, и образующиеся растворы проводят
электрический ток.Металлическая решетка
Характерна для веществ с металлической
связью. Реализуется в простых веществах — металлах и их сплавах. В узлах
решетки — атомы и катионы металла, при этом электроны металла обобществляются и
образуют так называемый электронный газ, который движется между узлами решетки,
обеспечивая ее устойчивость. Именно свободно перемещающимися электронами и
обусловлены свойства веществ с
металлической решеткой:·
тепло- и электропроводность;·
обладают металлическим блеском;·
высокие температуры плавления.Атомная решетка
В узлах решетки — атомы, связанные
ковалентными связями. Химическая связь — ковалентная полярная или неполярная.
Атомная кристаллическая решетка характерна для углерода (алмаз, графит),
бора, кремния, германия, оксида кремния SiO2(кремнезем, кварц,
речной песок), карбида кремния SiC (карборунд), нитрида бора BN.Свойства веществ с атомной решеткой:
·
высокая твердость;·
высокие температуры плавления;·
нерастворимость;·
нелетучесть;·
отсутствие запаха.Молекулярная решетка
В узлах — молекулы веществ, которые
удерживаются в решетке с помощью слабых межмолекулярных сил.Молекулярное
строение имеют:o все органические вещества (кроме солей);
o вещества — газы и жидкости;
o легкоплавкие и летучие твердые вещества, в молекулах
которых ковалентные связи (полярные и неполярные).Подобные вещества часто имеют запах.
Обобщающая таблица
Кристаллические решетки, вид связи и
свойства веществ
Тип решетки
Виды частиц в узлах решетки
Вид связи между частицами
Примеры веществ
Физические свойства веществ
Ионная
Ионы
Ионная связь — прочная
Соли, галогениды (IA,IIA), оксиды и гидроксиды щелочных и щел.-зем.
металловТвердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в
воде, расплавы проводят электрический токАтомная
Атомы
1. Ковалентная неполярная -очень прочная
2. Ковалентная полярная связь — очень прочная
Простые вещества: алмаз (C), графит (C), бор (B), кремний (Si)
Сложные вещества: оксид алюминия (Al2O3), оксид кремния
(IV) SiO2Очень твердые, очень тугоплавкие, прочные, нелетучие, нерастворимы в воде
Молекулярная
Молекулы
Между молекулами — слабые силы межмолекулярного притяжения, внутри
молекул — прочная ковалентная связьПри обычных условиях — газы, жидкости или летучие твердые вещества:
(О2,Н2,Cl2,N2,Br2,
H2O, CO2, HCl); сера, белый фосфор, йод; органические
веществаНепрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую
твердостьМеталлическая
Атом-ионы
Металлическая связь — разной прочности
Металлы и сплавы
Ковкие, обладают блеском, пластичностью, тепло- и электропроводны
источник информации: https://foxford.ru/wiki/himiya/vzaimosvyaz-tipa-himicheskoy-svyazi-s-vidom-kristallicheskoy-reshetki
Строение вещества
В химические взаимодействия
вступают не отдельные атомы или молекулы, а вещества.
Наша задача познакомиться со
строением вещества.

При низких температурах для
веществ устойчиво твёрдое состояние.
☼ Самым твёрдым веществом в природе является алмаз. Он считается царём
всех самоцветов и драгоценных камней. Да и само его название означает
по-гречески «несокрушимый». На алмазы с давних пор смотрели как на
чудодейственные камни. Считалось, что человек, носящий алмазы, не знает
болезней желудка, на него не действует яд, он сохраняет до глубокой старости
память и весёлое расположение духа, пользуется царской милостью.
☼ Алмаз, подвергнутый ювелирной обработке – огранке, шлифовке, называют
бриллиантом.
При плавлении в результате
тепловых колебаний порядок частиц нарушается, они становятся подвижными, при
этом характер химической связи не нарушается. Таким образом, между твёрдым и
жидким состояниями принципиальных различий нет.
У жидкости появляется
текучесть (т. е. способность принимать форму сосуда).
Жидкие кристаллы
Жидкие кристаллы открыты в
конце XIX века, но изучены в последние
20-25 лет. Многие показывающие устройства современной техники, например
некоторые электронные часы, мини-ЭВМ, работают на жидких кристаллах.
В общем-то слова «жидкие
кристаллы» звучат не менее необычно, чем «горячий лёд» . Однако на самом деле и
лёд может быть горячим, т.к. при давлении более 10000 атм. водяной лёд
плавится при температуре выше 2000 С. Необычность сочетания
«жидкие кристаллы» состоит в том, что жидкое состояние указывает на подвижность
структуры, а кристалл предполагает строгую упорядоченность.
Если вещество состоит из
многоатомных молекул вытянутой или пластинчатой формы и имеющих несимметричное
строение, то при его плавлении эти молекулы ориентируются определённым образом
друг относительно друга (их длинные оси располагаются параллельно). При этом
молекулы могут свободно перемещаться параллельно самим себе, т.е. система
приобретает свойство текучести, характерное для жидкости. В то же время система
сохраняет упорядоченную структуру, обусловливающую свойства, характерное для
кристаллов.
Высокая подвижность такой
структуры даёт возможность управлять ею путём очень слабых воздействий
(тепловых, электрических и др.), т.е. целенаправленно изменять свойства
вещества, в том числе оптические, с очень малыми затратами энергии, что и
используется в современной технике.
Типы кристаллических
решёток
Любое химическое вещество
образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах,
когда тепловое движение затруднено, частицы строго ориентируются в пространстве
и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным
расположением частиц в пространстве.
В самой кристаллической
решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p, t,…) существует в различных
кристаллических формах (т.е. имеют разные кристаллические решетки) –
аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре
модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало
кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его
ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода.
Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали
«зеркальным углеродом». Зеркальный углерод химически инертен, термостоек,
непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью
с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» — пишу, рисую.
Графит представляет собой тёмно – серые кристаллы со слабым металлическим
блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита,
связанные между собой сравнительно слабо, легко отделяются друг от друга.
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
ионная | атомная | молекулярная | металлическая | |
Что в узлах кристаллической решётки, структурная | ионы | атомы
| молекулы | атомы и катионы |
Тип химической связи между частицами узла | ионная | ковалентная: полярная и неполярная | ковалентная: полярная и неполярная | металлическая |
Силы взаимодействия между частицами кристалла | электростати- ческие | ковалентные | межмолекуляр- ные | электростати- ческие |
Физические свойства, обусловленные кристаллической | · · · · · | · · · · | · · · · | · · · |
Агрегатное состояние вещества при обычных условиях | твёрдое | твёрдое | твёрдое, газообразное, жидкое | твёрдое, жидкое(Нg) |
Примеры | большинство солей, щелочей, оксиды типичных металлов | С (алмаз, графит), Si, Ge, B, SiO2, CaC2, SiC (карборунд), BN, Fe3C, TaC(tпл.=38000С) Красный и чёрный фосфор. Оксиды некоторых металлов. | все газы, жидкости, большинство неметаллов: инертные CO2 «сухой | Металлы, сплавы |
Если скорость
роста кристаллов мала при охлаждении – образуется стеклообразное состояние
(аморфное).
- Взаимосвязь между
положением элемента в Периодической
системе и кристаллической решёткой его простого вещества.
Между положением элемента в
периодической системе и кристаллической решёткой его соответствующего простого
вещества существует тесная взаимосвязь.
г р | |||||||||
I | II | III | IV | V | VI | VII | VIII | ||
п е р и о д | I | H2 | He | ||||||
II | Li | Be | B | C | N2 | O2 | F2 | Ne | |
III | Na | Mg | Al | Si | P4 | S8 | Cl2 | Ar | |
IV | K | Ca | Ga | Ge | As | Se | Br2 | Kr | |
V | Rb | Sr | In | Sn | Sb | Te | I2 | Xe | |
Тип кристаллической решётки | металлическая | атомная | молекулярная | ||||||
Простые вещества остальных элементов имеют
металлическую кристаллическую решётку.
ЗАКРЕПЛЕНИЕ
Изучите материал лекции, ответьте на следующие
вопросы письменно в тетради:
- Что такое кристаллическая решётка?
- Какие виды кристаллических решёток существуют?
- Охарактеризуйте каждый вид кристаллической решётки по плану: Что в узлах кристаллической решётки, структурная
единица → Тип химической связи между частицами узла → Силы взаимодействия между частицами кристалла → Физические свойства, обусловленные кристаллической
решёткой → Агрегатное состояние вещества при обычных
условиях → Примеры
Выполните задания по данной теме:
- Какой тип кристаллической решётки у следующих широко используемых в
быту веществ: вода, уксусная кислота (CH3COOH),
сахар (C12H22O11), калийное удобрение (KCl),
речной песок (SiO2) – температура плавления 1710 0C, аммиак (NH3), поваренная соль? Сделайте
обобщённый вывод: по каким свойствам вещества можно определить тип его
кристаллической решётки? - По формулам приведённых веществ: SiC, CS2, NaBr, C2H2 — определите тип кристаллической решётки
(ионная, молекулярная) каждого соединения и на основе этого опишите физические
свойства каждого из четырёх веществ. - Тренажёр №1. «Кристаллические решётки»
- Тренажёр №2. «Тестовые задания»
- Тест (самоконтроль):
1) Вещества, имеющие
молекулярную кристаллическую решётку, как правило:
a).
тугоплавки и хорошо растворимы в воде
б). легкоплавки и летучи
в). Тверды и
электропроводны
г).
Теплопроводны и пластичны
2) Понятия «молекула» не
применимо по отношению к структурной единице вещества:
a).
вода
б). кислород
в).
алмаз
г). озон
3) Атомная кристаллическая решётка
характерна для:
a).
алюминия и графита
б). серы и йода
в).
оксида кремния и хлорида натрия
г). алмаза и
бора
4) Если вещество хорошо
растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая
решётка:
а).
молекулярная
б). атомная
в).
ионная
г).
металлическая


