Какой продукт получается при нитровании бензола

| Нитробензол | ||
|---|---|---|
| Систематическое наименование | Нитробензол | |
| Традиционные названия | мирбановое масло | |
| Хим. формула | C6H5NO2 | |
| Состояние | жидкость | |
| Молярная масса | 123,06 г/моль | |
| Плотность | 1,199 г/см³ | |
| Энергия ионизации | 9,92 ± 0,01 эВ[1] | |
| Температура | ||
| • плавления | 5,85 °C | |
| • кипения | 210,9 °C | |
| • вспышки | 88 °C | |
| • самовоспламенения | 482 °C | |
| Пределы взрываемости | 1,8 ± 0,1 об.%[1] | |
| Уд. теплоёмк. | 1510 Дж/(кг·К) | |
| Давление пара | 0,3 ± 0,1 мм рт.ст.[1] | |
| Растворимость | ||
| • в воде | 0,19 г/100 мл (20 °C) | |
| Показатель преломления | 1,5562 | |
| Дипольный момент | 4,22 Д | |
| Рег. номер CAS | 98-95-3 | |
| PubChem | 7416 | |
| Рег. номер EINECS | 202-716-0 | |
| SMILES | C1=CC=C(C=C1)[N+](=O)[O-] | |
| InChI | 1S/C6H5NO2/c8-7(9)6-4-2-1-3-5-6/h1-5H LQNUZADURLCDLV-UHFFFAOYSA-N | |
| RTECS | QJ0525000 | |
| ChEBI | 27798 | |
| ChemSpider | 7138 | |
| Предельная концентрация | 3 мг/м3 | |
| Фразы риска (R) | R23/24/25, R40, R48/23/24, R51/53, R62 | |
| Фразы безопасности (S) | (S1/2), S28, S36/37, S45, S61 | |
| NFPA 704 | 2 3 1 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
| Медиафайлы на Викискладе | ||
Нитробензол — токсичное органическое вещество, имеющее миндальный запах. Формула C6H5NO2.
Физические и химические свойства[править | править код]
Внешний вид нитробензола — ярко-желтые кристаллы или маслянистая жидкость (бесцветная или зеленовато-жёлтая) с запахом горького миндаля, нерастворимая в воде (0,19 % по массе при 297 K, 0,8 % при 350 K). Проявляет слабые основные свойства. Растворяется в концентрированных кислотах (при разведении таких растворов водой осаждается)[2]. Неограниченно смешивается с диэтиловым эфиром, бензолом, некоторыми другими органическими растворителями. Перегоняется с водяным паром. Показатель преломления (для D-линии натрия (589 нм), при 297K) 1,5562. Дипольный момент газообразных молекул (в дебаях) 4,22 D. Удельная теплоёмкость 1,51 Дж/(г·К)[3].
Электрофильное замещение[править | править код]
В связи с сильным электроноакцепторным действием нитрогруппы реакции электрофильного замещения идут в мета-положение и скорость реакции ниже чем у бензола.
- Нитрование. Образуется смесь изомеров: 93% м-динитробензола, 6,5 % о-динитробензола и 0,5 % п-динитробензола.
- Сульфирование
- Галогенирование
В присутствии катализаторов.
Например, порошка железа[4]:
Не вступает в реакцию Фриделя-Крафтса[5]
Нуклеофильное замещение[править | править код]
- При обработке магнийорганическими соединениями в эфире углеводородный радикал как нуклеофил вступает в орто- и в пара-положения к нитрогруппе (которая при этом восстанавливается до нитрозогруппы)[2]
Восстановление[править | править код]
Наиболее важной реакцией ароматических нитросоединений является восстановление их до первичных аминов.
Эта реакция была открыта в 1842 году Н. Н. Зининым, который впервые восстановил нитробензол до анилина действием сульфида аммония. В настоящее время для восстановления нитрогруппы в аренах до аминогруппы в промышленных условиях применяется каталитическое гидрирование. В качестве катализатора используют медь на силикагеле в качестве носителя. Катализатор готовят нанесением карбоната меди из суспензии в растворе силиката натрия и последующим восстановлением водородом при нагревании. Выход анилина над этим катализатором составляет 98 %.
Иногда в промышленном гидрировании нитробензола до анилина в качестве катализатора используют никель в комбинации с оксидами ванадия и алюминия. Такой катализатор эффективен в интервале 250—300° и легко регенерируется при окислении воздухом. Выход анилина и других аминов составляет 97—98 %. Восстановление нитросоединений до аминов может сопровождаться гидрированием бензольного кольца. По этой причине для получения ароматических аминов избегают использовать в качестве катализаторов платину, палладий или никель Ренея.
В промышленности анилин получают каталитическим восстановлением нитробензола на медном или никелевом катализаторе, который вытеснил старинный способ восстановления нитробензола чугунными стружками в водном растворе хлорного железа и соляной кислоты. Промежуточные продукты — нитрозобензол и N-фенилгидроксиламин.
Другой вариант получения нитрозобензола[4]:
Восстановление нитрогруппы до аминогруппы сульфидом и гидросульфидом натрия в настоящее время имеет значение только для частичного восстановления одной из двух нитрогрупп, например, в м-динитробензоле или 2,4-динитроанилине.
При ступенчатом восстановлении полинитросоединений с помощью сульфида натрия этот неорганический реагент превращается в тетрасульфид натрия, что сопровождается образованием щелочи.
Высокая щелочность среды приводит к образованию азокси- и азо- и гидразосоединений в качестве побочных продуктов. Для того чтобы избежать этого в качестве восстановителя следует использовать гидросульфид натрия, где щелочь не образуется.
Азоксибензол может быть получен восстановлением нитробензола: спиртовым раствором едкого кали, амальгамой натрия, водородом в присутствии окиси свинца, метиловым спиртом и едким натром, метилатом натрия и метиловым спиртом, закисью свинца в щелочной суспензии, декстрозой в щелочной суспензии, β-фенилгидроксиламином[4].
Азобензол можно получить, например, восстановлением нитробензола при кипячении с цинковой пылью в водно-спиртовом растворе щёлочи[4].
Многие более восстановленные производные могут быть получены электрохимически, при правильном подборе электродов.
Известны методы восстановления нитросоединений до амидов (амальгамами натрия или цинка, сульфидами натрия и аммония)[6].
Получение[править | править код]
Основной способ получения нитробензола (как и других нитроаренов) — нитрование в условиях электрофильного замещения бензола (соответственно, аренов)[2]. Электрофильной частицей является ион нитрония NO2+[6][7].
Например, в промышленности нитробензол получают непрерывным нитрованием бензола смесью концентрированных H2SO4 и HNO3 с выходом 96—99 %.
В лабораторных условиях нитробензол получают нитрованием бензола смесью H2SO4 (1,84 г/см3) и HNO3 (1,4 г/см3) в соотношении 1:1 при 40—60 °C (45 мин). Выход целевого продукта достигает 80 %.
Принципиально возможна (но не применяется в силу низкого выхода) реакция нитрования бензола концентрированной азотной кислотой[6].
Несколько реже (как и для получения других нитроаренов) в лабораториях используют замещение, модификацию или элиминирование заместителей, уже имеющихся при бензольном кольце[2].
Например, возможно получать нитробензол окислением анилина перокситрифторуксусной кислотой (или другими окислителями; чем менее кислая среда — тем больше доля азоксибензола в продуктах)[7].
Применение[править | править код]
Исходное сырьё в производстве анилина, ароматических азотсодержащих соединений (бензидин, хинолин, азобензол), растворитель эфиров целлюлозы[5], компонент полировальных составов для металлов. Применяется как растворитель и мягкий окислитель. В основном используется как прекурсор для производства анилина.
Производные нитробензола используются в качестве взрывчатых веществ и как компоненты ракетных топлив. В парфюмерии — в качестве душистых или фиксирующих запах веществ, в том числе — искусственных мускусов. Сам нитробензол ранее выпускали под названием «горько-миндального» или «мирбанового» масла. Некоторые производные нитробензола используются в составе лаков и красок. Некоторые применяются в медицине[2][6].
Токсичность[править | править код]
Впитывается через кожу, оказывает сильное действие на ЦНС, нарушает обмен веществ, вызывает заболевания печени, окисляет гемоглобин в метгемоглобин.
Примечания[править | править код]
- ↑ 1 2 3 https://www.cdc.gov/niosh/npg/npgd0450.html
- ↑ 1 2 3 4 5 Шабаров Ю. С. «Органическая химия», М.:Химия, 2002, стр. 848. ISBN 5-7245-1218-1, стр. 715—725
- ↑ Волков А. И. Жарский И. М. «Большой химический справочник». Мн.:Современная школа, 2005, 608 с. ISBN 985-6751-04-7 стр. 257, 267
- ↑ 1 2 3 4 Гельман Х. (ред.) Казанский Б. А. (ред.) «Синтезы органических препаратов», М.: Гос. Изд-во иностранной литературы, 1949. Сб. 1, стр. 130—134. Сб. 2, стр. 12-15. Сб. 3, стр. 7-8, 354—356
- ↑ 1 2 Кнунянц И. Л. (глав.ред.) «Химическая энциклопедия» в пяти томах. М.:Советская энциклопедия, 1988. Т.3, стр. 267—268
- ↑ 1 2 3 4 Горленко В. А. и др. «Органическая химия», М.:Мастерство, 2003, стр. 624. ISBN 5-294-00176-4, стр. 397—403
- ↑ 1 2 Бартон Д, Оллис Д.(ред.) «Общая органическая химия» в 12 т., М.:Химия, 1982. Т.3, стр. 403—410
Литература[править | править код]
- Кнунянц И. Л. и др. т.3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
Ссылки[править | править код]
- International Chemical Safety Card 0065 (англ.)
- NIOSH Pocket Guide to Chemical Hazards (англ.)
- IARC Monograph: «Nitrobenzene» (англ.)
- US EPA factsheet (англ.)
- Механизм восстановления нитробензола цинком в щелочной среде и железом в соляной кислоте (реакция Бешама) (англ.)
1. Реакции замещения в бензольном кольце
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах, но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
![]()
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.
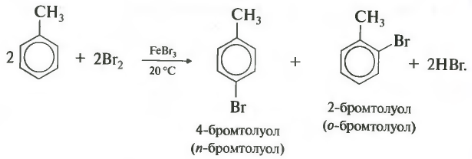
Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.
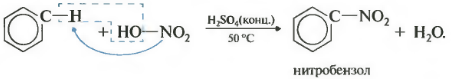
Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
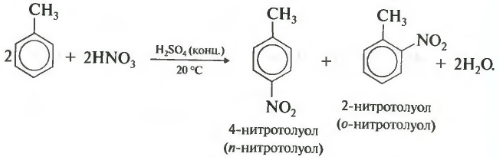
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство алкилирование бензола галогеналканами.
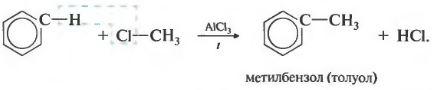
Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.
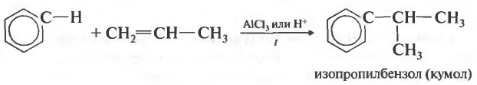
Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
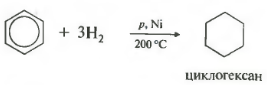
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
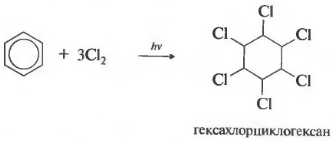
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.
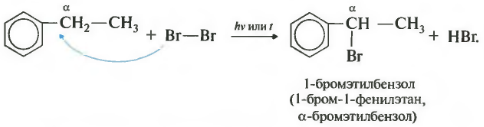
Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.
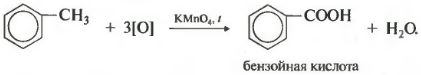
Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
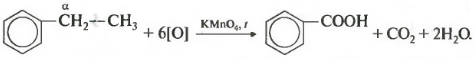
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.
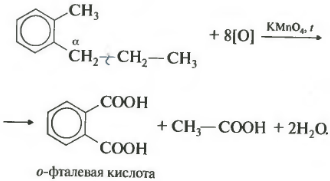
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
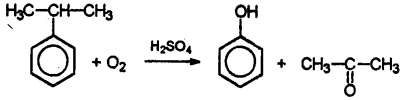
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
![]()
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO2. Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости
со специфическим запахом. Ароматические углеводороды легче воды и в ней не
растворяются, однако легко растворяются в органических растворителях – спирте,
эфире, ацетоне.
Бензол и его гомологи сами являются хорошими
растворителями для многих органических веществ. Все арены горят коптящим
пламенем ввиду высокого содержания углерода вих молекулах.
Физические свойства некоторых аренов представлены
в таблице.
Таблица.
Физические свойства некоторых аренов
Название | Формула | t°.пл., | t°.кип., |
Бензол | C6H6 | +5,5 | 80,1 |
Толуол | С6Н5СH3 | -95,0 | 110,6 |
Этилбензол | С6Н5С2H5 | -95,0 | 136,2 |
Ксилол | С6Н4(СH3)2 | ||
орто- | -25,18 | 144,41 | |
мета- | -47,87 | 139,10 | |
пара- | 13,26 | 138,35 | |
Пропилбензол | С6Н5(CH2)2CH3 | -99,0 | 159,20 |
Кумол | C6H5CH(CH3)2 | -96,0 | 152,39 |
Стирол | С6Н5CH=СН2 | -30,6 | 145,2 |
Бензол – легкокипящая (tкип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при
длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для
жизни, токсичны.
Получение
аренов (бензола и его гомологов)
В лаборатории
1. Сплавление солей
бензойной кислоты с твёрдыми щелочами
C6H5-COONa
+ NaOH t → C6H6 + Na2CO3
бензоат натрия
2. Реакция Вюрца-Фиттинга:
(здесь
Г – галоген)
С6H5-Г
+ 2Na + R-Г → C6H5—R + 2NaГ
С6H5-Cl
+ 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
В промышленности
- выделяют
из нефти и угля методом фракционной перегонки, риформингом; - из
каменноугольной смолы и коксового газа
1. Дегидроциклизацией
алканов с числом атомов углерода больше 6:
C6H14 t, kat→ C6H6 + 4H2

2. Тримеризация ацетилена
(только для бензола) – р. Зелинского:
3С2H2 600°C, акт. уголь →
C6H6

3. Дегидрированием
циклогексана и его гомологов:
Советский
академик Николай Дмитриевич Зелинский установил, что бензол образуется из
циклогексана (дегидрирование циклоалканов
C6H12 t,
kat→ C6H6 +
3H2

C6H11-CH3
t, kat→ C6H5-CH3 + 3H2
метилциклогексан толуол
4. Алкилирование бензола
(получение гомологов бензола) – р
Фриделя-Крафтса.
C6H6 +
C2H5-Cl t, AlCl3→ C6H5-C2H5
+ HCl
хлорэтан этилбензол
Химические
свойства аренов
I. РЕАКЦИИ
ОКИСЛЕНИЯ
1. Горение (коптящее пламя):
2C6H6 + 15O2t →
12CO2 + 6H2O + Q
2. Бензол при обычных условиях не обесцвечивает
бромную воду и водный раствор марганцовки
3. Гомологи бензола окисляются перманганатом калия
(обесцвечивают марганцовку):
А) в кислой среде до
бензойной кислоты
При действии на гомологи бензола перманганата калия и
других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была
цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную
кислоту:
Гомологи, содержащие две боковые цепи, дают
двухосновные кислоты:
5C6H5-C2H5
+ 12KMnO4 + 18H2SO4 → 5C6H5COOH
+ 5CO2 + 6K2SO4 + 12MnSO4+28H2O
5C6H5-CH3
+ 6KMnO4 + 9H2SO4 → 5C6H5COOH
+ 3K2SO4 + 6MnSO4 +14H2O
Упрощённо:
C6H5-CH3
+ 3O KMnO4 → C6H5COOH
+ H2O
Б) в нейтральной и
слабощелочной до солей бензойной кислоты
C6H5-CH3
+ 2KMnO4 → C6H5COOК + KОН + 2MnO2 + H2O
II. РЕАКЦИИ
ПРИСОЕДИНЕНИЯ (труднее, чем у алкенов)
1. Галогенирование
C6H6 +3Cl2hν → C6H6Cl6(гексахлорциклогексан —
гексахлоран)

2. Гидрирование
C6H6 + 3H2 t,Pt или Ni → C6H12 (циклогексан)

3. Полимеризация
III. РЕАКЦИИ
ЗАМЕЩЕНИЯ – ионный механизм (легче, чем у алканов)
1. Галогенирование —
a) бензола
C6H6 + Cl2 AlCl3→ C6H5-Cl + HCl (хлорбензол)

C6H6
+ 6Cl2 t ,AlCl3→ C6Cl6
+ 6HCl (гексахлорбензол)
C6H6
+ Br2 t,FeCl3→ C6H5-Br + HBr (бромбензол)

б) гомологов бензола при облучении
или нагревании
По химическим свойствам алкильные радикалы подобны
алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному
механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении
идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца
на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно
связанного с бензольным кольцом (a -атома углерода).
1) C6H5-CH3
+ Cl2hν→ C6H5-CH2-Cl +
HCl
2)
в) гомологов бензола в
присутствии катализатора
C6H5-CH3 + Cl2 AlCl3→ (смесь орта, пара производных) + HCl
2. Нитрование (с азотной кислотой)
C6H6
+ HO-NO2 t, H2SO4→ C6H5-NO2 +
H2O
нитробензол — запахминдаля!

C6H5-CH3
+ 3HO-NO2 t, H2SO4→ СH3-C6H2(NO2)3
+ 3H2O
2,4,6-тринитротолуол (тол, тротил)
Применение бензола и его гомологов
Бензол C6H6 – хороший
растворитель. Бензол в качестве добавки улучшает качество моторного топлива.
Служит сырьем для получения многих ароматических органических соединений –
нитробензола C6H5NO2 (растворитель, из него
получают анилин), хлорбензола C6H5Cl, фенола C6H5OH,
стирола и т.д.
Толуол C6H5–CH3 – растворитель,
используется при производстве красителей, лекарственных и взрывчатых веществ
(тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C6H4(CH3)2.
Технический ксилол – смесь трех изомеров (орто-, мета— и пара-ксилолов) –
применяется в качестве растворителя и исходного продукта для синтеза многих
органических соединений.
Изопропилбензол C6H5–CH(CH3)2
служит для получения фенола и ацетона.
Хлорпроизводные
бензола используют для защиты
растений. Так, продукт замещения в бензоле атомов Н атомами хлора –
гексахлорбензол С6Сl6 – фунгицид; его применяют для
сухого протравливания семян пшеницы и ржи против твердой головни. Продукт
присоединения хлора к бензолу – гексахлорциклогексан (гексахлоран) С6Н6Сl6 –
инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые
вещества относятся к пестицидам – химическим средствам борьбы с
микроорганизмами, растениями и животными.
Стирол C6H5 – CH = CH2
очень легко полимеризуется, образуя полистирол, а сополимеризуясь с
бутадиеном – бутадиенстирольные каучуки.
ВИДЕО-ОПЫТЫ
Изучение физических свойств бензола
Горениебензола
Изучениеотношения бензола к бромной воде и раствору перманганата калия
Бромирование бензола
Нитрование бензола
Хлорированиебензола (получение гексахлорана)
