Какой из продуктов обесцвечивает бромную воду

СВОЙСТВА АЛКЕНОВ
АЛКЕНЫ (олефины, этиленовые углеводороды)
Общая формула CnH2n, одна двойная связь (= ) между атомами углерода
По месту С=С — sp2 гибридизация,
угол между связями С=С — 120°, поэтому молекула угловая
одна подвижная π-связь, длина двойной связи 0,134 нм.
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ
По физическим свойствам близки к алканам.
При нормальных условиях углеводороды
C2–C4 – газы,
C5–C17 – жидкости,
высшие представители – твердые вещества.
Температура их плавления и кипения, а также плотность увеличиваются с ростом молекулярной массы.
Все олефины легче воды, плохо растворимы в ней, однако растворимы в органических растворителях.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКЕНОВ.
Для алкенов характерны:
1. реакции присоединения к двойной связи,
2. реакции окисления,
3. реакции замещения в «боковой цепи».
РЕАКЦИИ ПРИСОЕДИНЕНИЯ ПО ДВОЙНОЙ СВЯЗИ:
менее прочная π-связь разрывается, образуется насыщенное соединение.
1) Гидрирование → + Н2: из алкенов → алканы

2) Галогенирование → + Cl2, Br2 : из алкенов → дигалогеналканы

Обесцвечивание бромной воды — качественная реакция на непредельность.
3) Гидрогалогенирование: + НBr, HCl из алкенов → галогеналканы

(Правило Марковникова: — водород присоединяется к наиболее гидрированному атому углерода).
4) Гидратация → + Н₂О : из алкенов одноатомные спирты
(присоединение также происходит по правилу Марковникова)

5. Эффект Хараша — присоединение в присутствии катализатора
Присоединение галогеноводородов и воды в присутствии пероксидов идет против правила Марковникова

6. Полимеризация – это реакция образования высокомолекулярного соединения (полимера) из низкомолекулярного (мономера).
Высокомолекулярное соединение (полимер) – это вещество с большой молекулярной массой, состоящее из многократно повторяющихся сегментов (структурных звеньев), связанных между собой.

РЕАКЦИИ ОКИСЛЕНИЯ
1. Горение – полное окисление алкенов кислородом до углекислого газа и воды.

2. Мягкое окисление алкенов – реакция Вагнера — реакция с холодным водным (нейтральным) раствором перманганата калия (или Н₂О₂) → многоатомные спирты..

Обесцвечивание раствора перманганата калия – качественная реакция на непредельные углеводороды.
3.Окисление алкенов в нейтральной среде при нагревании
Если двойная связь на краю — карбонат, если в середине — соль карбоновой кислоты, если к двойной связи радикал — кетон.

4. Жесткое окисление алкенов – реакция с горячим кислым раствором перманганата калия — идёт с разрывом двойной связи С=С в зависимости от алкена образуются карбоновые кислоты, углекислый газ, кетоны.
В зависимости от строения скелета алкена механизм реакции разный:
а) Если у двойной связи нет радикалов → карбоновые кислоты и углекислый газ, если есть, только карбоновые кислоты

б) Если у двойной связи есть радикал → кетоны и карбоновые кислоты

5. Окисление этилена кислородом в присутствии солей палладия → уксусный альдегид

6. Окисление этилена кислородом при нагревании в присутствии катализатора металлического серебра, в водной среде → промышленный способ получения этиленгликоля.

РЕАКЦИИ ЗАМЕЩЕНИЯ В «БОКОВОЙ ЦЕПИ».
1. Хлорирование и бромировнаие в боковую цепь:
если реакция с хлором проводится на свету или при высокой температуре – идёт замещение водорода в боковой цепи.

СВОЙСТВА АЛКАДИЕНОВ
Две двойные связи.
Первый член ряда – С3Н4 (пропадиен или аллен). В названии появляется суффикс – ДИЕН.

ТИПЫ ДВОЙНЫХ СВЯЗЕЙ В ДИЕНАХ:
1.Изолированные — двойные связи разделены в цепи двумя или более σ-связями: СН2=СН–СН2–СН=СН2.
Диены этого типа проявляют свойства, характерные для алкенов.
2. Кумулированные — двойные связи расположены у одного атома углерода: СН2=С=СН2 (аллен)
Подобные диены (аллены) относятся к довольно редкому и неустойчивому типу соединений.
3.Сопряженные — двойные связи разделены одной σ-связью: СН2=СН–СН=СН2
Сопряженные диены отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью четырех sp2-атомов углерода.
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАДИЕНОВ
В обычных условиях пропадиен-1,2 и бутадиен-1,3 — газы, 2-метилбутадиен-1,3 — летучая жидкость.
Алкадиены с изолированными двойными связями (простейший из них — пентадиен-1,4) — жидкости.
Высшие диены — твёрдые вещества.
Все алкадиены нерастворимы в воде
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАДИЕНОВ С СОПРЯЖЕННЫМИ СВЯЗЯМИ
РЕАКЦИИ ПРИСОЕДИНЕНИЯ
Для сопряженных диенов характерны реакции присоединения алкенов, наблюдается так называемое 1,4-присоединение (в реакции участвует вся делокализованная системы из двух двойных связей):

1. Гидрирование — сначала алкены, затем алканы

В присутствии катализатора Ni получается продукт полного гидрирования:

2. Галогенирование — сначала образуются дигалогенпроизводные, затем тетрагалогенпроизводные.

3. Гидрогалогенирование — сначала галогенпроизводные, затем дигалогенпроизводные.

4. Гидратация — сначала одноатомные спирты, затем двухатомные спирты.

5. Реакция полимеризации
Реакция протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком:
Полимеризация бутадиена


РЕАКЦИИ ОКИСЛЕНИЯ — мягкое, жесткое, а также горение.
Протекают так же, как и в случае алкенов – мягкое окисление приводит к многоатомному спирту, жесткое окисление – к смеси различных продуктов, зависящих от строения диена:
1. Мягкое окисление – многоатомные спирты

2. Окисление в жестких условиях. В качестве окислителя используется концентрированный раствор перманганата калия или хромовая смесь (раствор бихромата калия в серной кислоте).
Происходит разрыв связей, с образованием, в зависимости от строения исходного алкена: карбоновых кислот, кетонов или смеси кислот и кетона.
3. Алкадиены горят → углекислый газ (угарный газ, углерод) и вода.

СВОЙСТВА АЛКИНОВ
АЛКИНЫ (ацетиленовые углеводороды)
Общая формула CnH2n-2
одна тройная связь (≡).
≡ — sp-гибридизация,
≡ — одна σ- и две π-связи
угол по месту ≡ 180°.
Молекула линейная
длина тройной связи 0,120нм.
ИЮПАК — суффикс -ан заменяется суффиксом -ин:

ОСОБЕННОСТИ АЛКИНОВ:
1. π-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей подвижностью.
2. Реакции присоединения к алкинам протекают медленнее, чем к алкенам.
3. Алкины с концевой тройной связью (алкины-1) проявляют кислотные свойства и способны, вступая в реакции с активными металлами, образовывать соли.
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКИНОВ
По своим физическим свойствам напоминают соответствующие алкены.
Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах.
Алкины плохо растворимы в воде, лучше — в органических растворителях.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ
1. Гидрирование → + Н2 – сначала алкены, затем алканы
В присутствии металлических катализаторов (Pt, Ni) алкины образуют алкены (разрывается первая π-связь), затем алканов (разрывается вторая π-связь):

При использовании менее активного катализатора (Pd) гидрирование останавливается на стадии образования алкенов.
2. Галогенирование → + Cl2, Br2 : из алкинов → дигалогеналкены, затем тетрагалогеналканы :
Присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая π-связь разрывается труднее, чем вторая):

Алкины обесцвечивают бромную воду (качественная реакция).
3. Гидрогалогенирование → + НBr, HCl из алкенов → галогеналкены, из галогеналкенов — дигалогеналканы
Присоединение к несимметричным алкинам определяются правилом Марковникова:

4. Гидратация (реакция Кучерова) → + Н₂О : из ацетилена – этаналь (альдегид), из всех остальных – кетоны. Катализаторы — соли ртути (II) — присоединение протекает по правилу Марковникова

5. Полимеризация алкинов.
а) Димеризация — из двух молекул ацетилена образуется димер — винилацетилен в присутствии соли CuCl

2) Тримеризация — образуются ароматические углеводороды
Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского):


КИСЛОТНЫЕ СВОЙСТВА АЛКИНОВ С КОНЦЕВОЙ ТРОЙНОЙ СВЯЗЬЮ
1. С щелочными металлами — образование солей ацетиленидов (замещается водород только на концевых связях):
Концевые атомы водорода у ацетилена и алкинов-1 могут замещаться атомами металла. При этом образуются соли – ацетилениды:


2. С аммиачными растворами оксида серебра или хлорида меди (I) выпадают осадки нерастворимых ацетиленидов:

Образование серовато-белого осадка ацетиленида серебра (ли красно-коричневого ацетиленида меди) — качественная реакция на концевую тройную связь.
ОКИСЛЕНИЕ АЦЕТИЛЕНА:
Алкины обесцвечивают раствор KMnO4, что используется для их качественного определения (обесцвечивание перманганата).
1. В слабощелочной среде → соли щавелевой кислоты (оксалаты)

Алкины обесцвечивают раствор KMnO4 – качественное определение (обесцвечивание перманганата).
2. В слабокислой среде → углекислый газ

Остальные алкины окисляются аналогично алкенам
в нейтральной и щелочной среде при нагревании получаются калиевые соли
Реакция с горячим кислым раствором перманганата калия — идёт с разрывом тройной связи — образуются карбоновые кислоты, углекислый газ:

3. Горение алкинов.
На воздухе алкины горят коптящим пламенем:
Если вдувать в пламя воздух или кислород, то алкины сгорают полностью, без копоти:


Задание 25. Качественные реакции (подробно)
1. Как распознать алкены и стирол (в случае стирола в реакции вступает только двойная связь боковой цепи, а не бензольное кольцо)
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях)
CH2=CH2 + Br2 → CH2Br-CH2Br
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
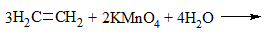
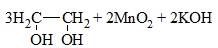
Раствор перманганат калия фиолетового цвета. В результате реакции окраска исчезает, образуется осадок MnO2 бурого цвета.
2. Как распознать алкины
1) + Br2 (бромная вода) → обесцвечивание раствора (реакция протекает в обычных условиях):
C2H2 + 2Br2 → CHBr2-CHBr2
2) + KMnO4 (водный раствор) → обесцвечивание раствора, образование осадка MnO2 бурого цвета:
3C2H2 + 8KMnO4 → 3K2C2O4 + 8MnO2 + 2KOH + 2H2O (K2C2O4 — соль щавелевой кислоты)
3) + [Ag(NH3)2]OH → выпадение осадка в случае концевой тройной связи:
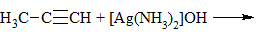
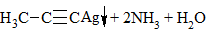
4) + Металл → выпадение осадка и выделение водорода в случае концевой тройной связи
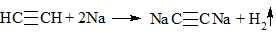
3. Как распознать бензол
1) Бензол горит коптящим пламенем из-за большого содержания углерода.
Благодаря устойчивой ароматической системе бензол не вступает в реакции с водным раствором Br2 и раствором KMnO4.
4. Как распознать одноатомные спирты
1) + CuO → наблюдаем выделение металлической меди:
CH3-CH2-OH + CuO → CH3-CHO + Cu + H2O (t, окисление спиртов до альдегидов)
2) + Na → наблюдаем выделение газа:
2C2H5-OH + 2Na → 2C2H5-ONa + H2
С основаниями одноатомные спирты не взаимодействуют.
5. Как распознать многоатомные спирты
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора:
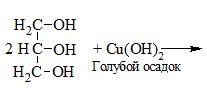
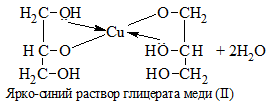
С щелочами многоатомные спирты не взаимодействуют.
6. Как распознать фенолы
1) + Br2 → выпадение белого осадка 2,4,6-трибромфенола
2) + FeCl3 → раствор фиолетового цвета
7. Как распознать альдегиды
1) + [Ag(NH3)2]OH → восстановление металлического серебра
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета
8. Как распознать карбоновые кислоты
1) раствор лакмуса → изменение окраски на красную
2) + Na2CO3/NaHCO3  → выделение газа CO2
9. Как распознать соли высших карбоновых кислот
1) + HCl (любая сильная кислота) → появление хлопьев нерастворимых высших кислот
10. Как отличить муравьиную кислоту от уксусной
Муравьиная кислота содержит и альдегидную группу тоже, следовательно, возможны реакции, характерные альдегидам:
1) + [Ag(NH3)2]OH → восстановление металлического серебра и выделение газа (так как кислота окисляется до CO2)
2) + Cu(OH)2 → выпадение осадка Cu2O кирпично-красного цвета и выделение газа (так как кислота окисляется до CO2).
11. Как распознать низшие амины
1) раствор лакмуса → изменение окраски на синюю (так как среда раствора щелочная)
1) раствор фенолфталеина → изменение окраски на малиновую
12. Как распознать анилин
1) + Br2 → выпадение белого осадка 2,4,6-триброманилина
13. Как распознать белок
1) + HNO3 → желтое окрашивание (ксантопротеиновая реакция)
2) + Cu(OH)2 → фиолетовое окрашивание (биуретовая реакция)
14. Как распознать глюкозу C6H12O6
1) + Cu(OH)2 → растворение голубого осадка и появление ярко-синей окраски раствора (реакция на несколько гидроксильных групп)
2) + Cu(OH)2 → при нагревании образуется осадок Cu2O красного цвета (реакция на альдегидную группу)
3) + [Ag(NH3)2]OH → восстановление металлического серебра
15. Как распознать крахмал
1) + I2 → появление синей окраски.
| Соединение, функциональная группа | Реагент | Что наблюдается, уравнение реакции |
Алкены >C=C< | Водный раствор KMnO4 | Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка диоксида марганца бурого цвета 3 >C=C< + 2KMnO4 + 4H2O → 3 >C(OH)-C(OH)< + 2MnO2↓ + 2KOH |
| Раствор Br2 в органическом растворителе или воде (бромная вода) | Исчезает желто-коричневая окраска раствора брома из-за протекания реакции: >C=C< + Br2 → >C(Br)-C(Br)< | |
| Алкины -С≡С- | Раствор Br2 в органическом растворителе или воде (бромная вода) | Исчезает желто-коричневая окраска раствора брома из-за протекания реакции: R-С≡С-R’ + 2Br2 → R-CBr2-CBr2-R’ |
Водные растворы аммиачных комплексов Ag(I), например, аммиачный раствор оксида серебра [Ag(NH3)2]OH | Алкины с тройной связью на конце молекулы дают желтый осадок: R-С≡СН + [Ag(NH3)2]OH → R-С≡СAg↓ + 2NH3 + H2O Алкины, у который при тройной связи нет атомов водорода в такую реакцию не вступают | |
Водный раствор аммиачных комплексов одновалентной меди Cu(I), например, аммиачный раствор оксида меди (I) [Cu(NH3)2]OH | Алкины с тройной связью на конце молекулы дают красный осадок : R-С≡СН + [Cu(NH3)2]OH → R-С≡СCu↓ + 2NH3 + H2O Алкины, у которых при тройной связи нет атомов водорода в такую реакцию не вступают, что позволяет отличить их друг от друга | |
| Бензол | Нитрующая смесь – смесь конц. азотной и серной кислот | Образование желтой жидкости с запахом горького миндаля на дне реакционной смеси |
| Гомологи бензола | Нейтральный водный раствор KMnO4 | При кипячении с каким-либо гомологом бензола водный раствор перманганата калия обесцвечивается и выпадает бурый осадок оксида марганца (IV). На примере с толуолом и этилбензолом реакции выглядят следующим образом: C6H5CH3 +2KMnO4 = C6H5COOK + 2MnO2↓ + KOH + H2O (при кипячении) C6H5CH2CH3 + 4KMnO4 = C6H5COOK + K2CO3 + 2H2O + 4MnO2↓ + KOH (при нагревании) |
| Подкисленный водный раствор перманганата калия KMnO4(водн.), H+ | Постепенное обесцвечивание подкисленного раствора KMnO4. Выпадения бурого осадка MnO2 не наблюдается, поскольку марганец восстанавливается до практически бесцветной соли двухвалентного марганца. Чаще всего в качестве подкислителя изпользуют серную кислоту. На примере с толуолом реакция выглядит следующим образом: 5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 6MnSO4 + 3K2SO4 +14H2O | |
| Фенол | Бромная вода | Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка трибромфенола: |
Разбавленный водный раствор соли железа (III), например, FeCl3 | Светло-желтая окраска разбавленного раствора соли трехвалентного железа сменяется на фиолетовую | |
| Анилин | Бромная вода | Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка триброманилина: |
Одноатомные первичные и вторичные спирты CH3OH, C2H5OH, (CH3)2CH-OH и т.д. | Оксид меди (II) CuO | Черный CuO при нагревании со спиртом изменяет свою окраску на красную в связи с восстановлением до Cu0. Первичный спирт при этом превращается в альдегид: R-CH2-OH + CuO =to=> R-CHO + Cu + H2O, вторичный — в кетон: R-C(OH)-R’+ CuO =to=> R-C(O)-R’ + Cu + H2O, В случае метанола появляется легко узнаваемый запах формальдегида (естественно, чтобы он был узнаваемым, нужно до этого быть знакомым с его запахом:-) ) В случае реакции с CuO этилового спирта чувствуется специфический запах ацетальдегида, схожий с ароматом прелых яблок сорта «антоновка» |
| Многоатомные спирты | Свежеосажденный Cu(OH)2 (II) | Растворение голубого осадка Cu(OH)2 с образование ярко-синего раствора комплексного соединения меди. На примере с глицерином уравнение реакции выглядит следующим образом: |
Альдегиды, —CHO | Аммиачный раствор оксида серебра [Ag(NH3)2]OH | Так называемая реакция серебряного зеркала. В результате восстановления Ag+1 в металлическое серебро Ag0 на стенках сосуда образуется зеркало. При небрежном смешении реагентов или в недостаточно чистом сосуде вместо серебряного зеркала может образоваться черный осадок, состоящий из мелкодисперсных частиц металлического серебра. В обоих случаях наблюдаемые явления описываются уравнением в общем виде: R-CHO + 2[Ag(NH3)2]OH = R-СООNH4 + 2Ag↓ + 3NH3↑ + H2O |
Свежеосажденный Cu(OH)2 | Образование оранжево-красного осадка Cu2O при нагревании в результате реакции: R-CHO + 2Cu(OH)2 = R-COOH + Cu2O↓ + 2H2O | |
Карбоновые кислоты, -COOH | Лакмус | Окрашивание лакмуса в красный цвет |
| Карбонаты, например, K2CO3 | Выделение углекислого газа в результате разложения образующейся нестойкой угольной кислоты H2CO3: 2R-COOH + CO32- → CO2 + H2O + R-COO— | |
| Спирт + конц. H2SO4 | Появление запаха сложного эфира, образующегося в результате реакции: R-COOH + R’-OH → R-COO-R’ + H2O Запахи эфиров весьма разнообразны, но общим является ярко выраженная пахучесть, нередко, могут напоминать ароматы различных фруктов. | |
Муравиная кислота -СНО и -СООН | Лакмус | Окрашивание лакмуса в красный цвет, по причине кислой среды, создаваемой муравьиной кислотой: HCOOH ↔ HCOO— + H+ |
Аммиачный раствор оксида серебра [Ag(NH3)2]OH | Молекуле муравьиной кислоты, не смотря на ее малый размер удается сочетать в себе помимо карбоксильной группы также и карбонильную, которая позволяет вступать муравьиной кислоте в реакцию серебряного зеркала подобно альдегидам: HCOOH + 2[Ag(NH3)2]OH → 2Ag↓ + 4NH3↑ + CO2↑ + 2H2O | |
Растворимые соли жирных карб. кислот, например, стеарат натрия CH3(CH2)16COONa (мыло) | Любая сильная неорганическая кислота или кислота средней силы H2SO4 (разб.) HCl HI HBr HNO3(разб.) H3PO4 | Выпадение хлопьевидного белого осадка малорастворимой жирной кислоты: CH3(CH2)16COONa + H+ → Na+ + CH3(CH2)16COOH |
| Раствор соли Ca или Mg | Выпадение белого осадка нерастворимой кальциевой или магниевой соли жирной кислоты. Ионное уравнение в общем виде: 2R-COO— + Ca2+ → (R-COO)2Ca↓, где R-длинный углеводородный радикал. На примере, стеарата натрия и хлорида кальция молекулярное уравнение реакции выглядит так: 2CH3(CH2)16COONa + CaCl2 → (CH3(CH2)16COONa)2Ca↓ | |
| Фенолфталеин | Окрашивание фенолфталеина в малиновый цвет как в щелочах, ввиду того, что соли жирных кислот гидролизуются по аниону: CH3(CH2)16COO— + H2O → CH3(CH2)16COOH + OH— | |
Олеиновая кислота, -COOH; >C=C< | Водный раствор KMnO4(водн.) | Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка оксида марганца бурого цвета MnO2 3>C=C< + 2KMnO4 + 4H2O → 3>C(OH)-C(OH)< + 2MnO2↓ + 2KOH |
| Раствор Br2 в орг. растворителе или воде (бромная вода) | Исчезает желто-коричневая окраска раствора брома из-за протекания реакции (указан структурный фрагмент молекулы олеиновой кислоты): >C=C< + Br2 → C(Br)=C(Br)< | |
| Раствор щелочи, например, NaOH | Олеиновая кислота, будучи практически нерастворимой в воде жирной кислотой, растворяется в водных растворах щелочей: C17H33COOH + NaOH → C17H33COONa + H2O | |
Глюкоза, -CHO -C(OH)-C(OH)- | Аммиачный раствор оксида серебра [Ag(NH3)2]OH | Глюкоза относится к так называемым альдегидоспиртам, т.к. ее молекулы содержат альдегидную группу и 5 гидроксильных групп. Поэтому она вступает в реакцию «серебряного зеркала» |
| Свежеосажденный Cu(OH)2 | Если раствор глюкозы прибавить к свежеосажденному гидроксиду меди без нагревания наблюдается растворение осада гидроксида меди и образование синего раствора. В этом случае глюкоза реагирует как многоатомный спирт — с образованием растворимых комплексов меди. Если же полученный синий раствор нагреть, выпадает оранжево-красный осадок одновалентного оксида меди Cu2O. При этом глюкоза реагирует как альдегид — альдегидная группа молекулы глюкозы окисляется до карбоксильной — образуется глюконовая кислота. | |
| Крахмал | Йод, I2 | Появление синей окраски |
| Белок | концентрированная азотная кислота НNО3(конц.) | Ксантопротеиновая реакция Появление ярко-желтого окрашивания по причине нитрования бензольных колец молекул белка |
| Свежеосажденный Cu(OH)2 | Появляется сине-фиолетовое окрашивание раствора в следствие образование комплексов меди (II) с белком |
