Какой из элементов в большей степени проявляет восстановительные свойства
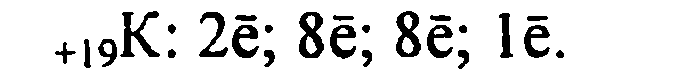
1 . Степень окисления хрома увеличивается в ряду:
1) СrO, Сr2O3, СrO3; 2) СrС13, CrO3, Cr2(SO4)3;
3) H2CrO4, CrSO4, KCrO2; 4) Cr(OH)3, КСrO2, Cr2O72-
2. Степень окисления углерода уменьшается в ряду:
1)СО, CF4, C2H6; 2) Н2С2О4, Н2СО3, СО2;
3) С6Н6, С2Н2, СаС2; 4) СО2, СаС2, СН4.
3. Какое их перечисленных веществ в большей степени проявляет восстановительные свойства:
l) Fе(ОН)3 ; 2) Fе (OH)2; 3)Со (ОН)2 4) Ni(ОН)2
4. Какое их перечисленных веществ в большей степени проявляет окислительные свойства:
1) СО 2 2) SiO 2 3) GeO 2 4) PbO 2
5. Укажите коэффициент перед формулой ZnSO4 в уравнении окислительно- восстановительной реакции:
Zn + H2SO4 → ZnSO4 + S↓ + H2
1) 7; 2) 3; 3) 4; 4) 1.
6. Сумма коэффициентов в уравнении окислительно-восстановительной реакции равна
HNO3 + Al → NH4NO3 + Al(NO3)3 + Н2О
1) 72; 2) 58; 3) 64; 4) 13.
7. При каком значении рН перманганат-ион принимает наибольшее число электронов ?
1) 3 2) 7 3) 9 4) 12
8. В каком случае образуется Cr(OH)3
1) К2Cr2O7 +K 2S + H2SO4® ; 2) К2Cr2O7 +( NH4) 2S + Н2О®;
3) К2CrO4 + ( NH4) 2S +KOH+ Н2О®; 4) К CrO2 +Br2 +KOH ®
9. При каком значении рН образуются манганат-ионы ?
1) 2 2) 5 3) 7 4) 12
10. Определите сумму коэффициентов в уравнении окислительно- восстановительной реакции
KMnO4 + FeSO4+ H2SO4 →; MnSO4 + Fe2(SO4)3 + K2SO4 + H2O →
1) 25; 2) 27; 3) 36; 4) 45
ТЕСТ 6
ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
1. Какая из приведенных реакций протекает в первую очередь на катоде?
| 1. Ag + 1e = Ag0 | 2. Fe2+ + 2e = Fe |
| 3. Zn2+ + 2e = Zn0 | 4. Ni2+ + 2e = Ni |
2. Анод из какого металла при электролизе соляной кислоты будет растворим?
3. В какой паре металлов при коррозии не будет разрушаться железо?
| 1. Fe — Au | 2. Fe — Ag | 3. Fe — Zn | 4. Fe — Cu |
4. Какой металл по отношению к железу может быть анодным покрытием?
5. Рассчитайте ЭДС гальванического элемента Ni/NiSO4/CuSo4/Cu и укажите, какое значение из приведенных правильно (соли с концентрацией 1 М).
| 1. 0.99 В | 2. 0.09 В | 3. 0.89 В | 4. 0.59В |
6. В каком из ниже перечисленных гальванических элементов медь является анодом?
| 1. Zn/ZnSO4//CuSO4/Cu | 2. Ag/AgSO4//Cu(NO3)2/Cu |
| 3. Fe/FeSO4//CuSO4/Cu | 4. Al/Al(NO3)3//Cu(NO3)2/Cu |
7. У какого металла наиболее положительный потенциал?
8. Какой процесс происходит на аноде при электролизе раствора AgNO3, если анод серебряный?
| 1. Ag + 1e = Ag | 2. 2H2+ + 2e = H2 |
| 3. 2OH- — 2e = 1/2O2 + H2O | 4. Ag- — e = Ag+ |
9. Укажите потенциал никелевой пластинки, опущенной в раствор 0.001 М раствора NiSO4?
| 1. – 0.34 В | 2. – 0.40 В | 3. – 0.25 В | 4. – 0.28 В |
10. В каком из ниже перечисленных гальванических элементов цинк является катодом?
| 1. Zn/ZnSO4//CuSO4/Cu | 2. Mg /MgSO4 // ZnSO4/Zn |
| 3. Fe/FeSO4// ZnSO4/Zn | 4. Zn/ZnSO4// Ni SO4 / Ni |
ТЕСТ 7
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
1. Какой из ионов обладает лучшими комплексообразующими свойствами ?
1) Са +2 , 2) Fe +3 , 3) Al+3 , 4) К +
2. Составьте координационные формулы и укажите соединение с комплексным анионом
1) Pt CI2 •2NH3, 2) Сr(ОН) 3 •3КОН 3) Co CI3 4 NH3,
4) FeCI3 • 6 H2O
3. В каком комплексном ионе имеет место dsp 2 -гибридизация?
1) [AuCI4 ] — 2) [ Au (CN)4 ] — 3) [ Fe (CN)6 ] 3- 4) [ Сr (CN)6] 3-
4. Укажите внешнеорбитальный комплексный ион
1) [ Сr (H2O)6] 3 — 2) [ Fe (CN)6 ] 4- 3) [ СоCI4 ] — 4) [ Ni (CN)4 ] 2-
5. Укажите низкоспиновый комплексный ион
1) К3[Cr(OH)6] 2) К2 [ Zn(OH)4] 3) [ Сr( NH3)6]CI3 4) Н2 [AuCI4 ]
6. Укажите парамагнитный комплекс
1)[ Ni(NH3)4 ]CI2 2) [ Cu (H2 O )4 ]CI2 3) К2[ СоCI4 ] 4) К4 [ Fe (CN)6 ]
7. Укажите комплексный неэлектролит
1) СrCI3 • 4H2O 2) Pt CI4 2NH3 3) HgI2 •2KI 4) Ni CI2 •4NH3 ;
8. Какая константа нестойкости соответствует наиболее устойчивому комплексу ?
1) 10 -5 2) 10 -9 3) 10 -12 4) 10 — 36
9. Укажите уравнение для определения Кн комплексного соединения [Сo (NH3) 4 ] CI2
1) [Сo 2+ ] +[NH3 ] 4 [Сo 2+ ] [NH3 ]
Кн = ___________________ 2) Кн = ___________________
[ [Сo (NH3) 4 ] 2+ ] [ [Сo (NH3) 4 ] 2+ ]
3) [Сo 2+ ] [NH3 ] 4 [CI ] 2 [Сo 2+ ] [NH3 ] 4
Кн = ___________________ 4) Кн = ___________________
[ [Сo (NH3) 4 ] CI2] [ [Сo (NH3) 4 ] 2+ ]
10. Какое из указанных соединений разрушит комплекс [ Cu ([NH3 )4 ]CI2?
1) КОН 2) К2S 3) H2 O 4) КCI
Вопросы к коллоквиуму
Семестр
| Коллоквиум 1 |
| 1. Многоэлектронные атомы. Принцип наименьших энергий. Правило Клечковского. Принцип Паули. Правило Хунда. |
| 2. Напишите электронные формулы элементов с порядковыми номерами 33 и 27. Для р-элемента определите степени окис-ления, напишите формулы оксидов, гидроксидов, солей, водо-родного соединения. . |
| 3. По методу валентных связей определите геометрии-ческую форму молекул: NH3, CH3 COOH. |
| 4. С какими из перечисленных веществ реагирует Н2SO4 конц.. Напишите уравнения реакций в молекулярном и ионном виде: Cu, Сr (NO3 )3 , AgNO3 , P, ZnO. |
| Коллоквиум 2 |
| 1. Напишите уравнения реакций обмена в молекулярном и ионном виде: а) сульфид цинка + соляная кислота б) 2CoSO4 + 2 NaOH® ; . |
| 2. Напишите уравнения реакций гидролиза в молекулярном и ионном виде: а) Сr 2(SO4 )3 +Na2 CO3 + H2O ®; б) CuSO4 + H2О® ; . |
| 3. Составьте электронно-ионные уравнения реакций MnO2 + NaBiO3 + HNO3® ; K2 S O3 + K2 S + H2SO4®; |
Ой семестр
| Коллоквиум 1 |
| 1. Опишите химическими реакциями механизм коррозии в кис-лой среде и на воздухе. |
| 2. Опишите работу гальванического элемента, в котором ни-кель является: а) анодом, б) катодом; укажите реакции, проис-ходящие на аноде и катоде; рассчитайте ЭДС . |
| 3. Составьте координационные формулы комплексных сое-динений, назовите их. Для второго комплекса напишите урав-недия диссоциации и выражение для определения Кнест . Как можно разрушить данный комплекс ? СrCI3 •6H2O; Pt CI2 •4NH3 |
| 4. Напишите электрорнно- ионные уравнения для реакции Zn + НNО3 разб. ¾® |
| Коллоквиум 2. |
| 1. Напишите уравнения реакций . с помощью которых можно осуществить превращения. Для реакций обмена напишите ион-ные уравнения, для ОВ-:реакций – электронно-ионные. К2Cr2O7¾® Cr(OH)3 ¾® CrСI 3 ¾® К2CrO4¾® К3[Cr(OH)6] ↓ + К2CO3 +Н2O постройте диаграмму гидроксокомплекса по МВС |
| 2.Как изменяются восстановительные свойства в ряду Fe2+®Co2+® Ni2+. (Ответ подтвердите уравнениями реакций). |
| 3.Почему медь на воздухе покрывается зеленым налетом, а серебро чернеет (Ответ подтвердите уравнениями реакций). |
Примеры экзаменационных билетов
Семестр
Билет № 1
по курсу « Неорганическая химия»
ВОПРОСЫ
1.Ковалентная связь. Теория Гейтлера и Лондона. Основные положения метода валентных связей.
2. Напишите электронную формулу элемента с порядковым номером 17, определите степени окисления, напишите формулы оксидов, гидроксидов, солей, водородного соединения. Назовите их. По методу ВС постройте графическую формулу молекулы СSСI 2 .
3. Напишите уравнения реакций обмена в молекулярном и ионном виде:
б) сульфид железа (II) + соляная кислота® ;
а) AI2 ( SO4 )3 + 8NaOH ® ;
4. Напишите в молекулярном и ионном виде уравнения реакций гидролиза:
а) Zn +Na3PO4 + H2O® б) Na3 AsO3 + H2O ® ;
5. Составьте электронно-ионные уравнения :
а) KMnO4 + Na2 SO3 + H2 SO4 ® ; б) K2Cr2O7 + H2O2 + H2 SO4 ®
Ой семестр
Билет № 1
по курсу Неорганическая химия
ВОПРОСЫ
1. Метод валентных связей .
2. Соединения хрома в степени окисления +6 : оксид, гидроксид, соли, роль в ОВ- реакциях.
3-4. Напишите уравнения реакций . с помощью которых можно осуществить превращения. Для реакций обмена напишите ион-ные уравнения, для ОВ-:реакций – электронно-ионные.
MnO2 ® K2MnO4 ® KMnO4 ¾® MnSO4 ® Mn(NO3 ) 2 ¾®
¾® НMnO4
5. а) Как изменяются окислительные свойства в ряду Fe3+®Co3+® Ni3+. Ответ подтвердите уравнениями реакций
б) Напишите уравнение реакции
а) Zn + Н2 SО4 конц. ¾®
А) Характеристика фосфора.
1. Фосфор— элемент пятой группы и третьего периода, Z = 15,
Аr(Р) = 31.
Соответственно, атом фосфора содержит в ядре 15 протонов,
16 нейтронов и 15 электронов. Строение его электронной оболочки
можно отразить с помощью следующей схемы:
![]()
Атомы фосфора проявляют как окислительные свойства (принима-
ют недостающие для завершения внешнего уровня три электрона, получая при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами— металлами, водородом и т.п.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.)
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Например, существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у
кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2O5. Это кислотный оксид.
Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота.
Р2O5 + 3Н2O => 2Н3РO4.
При взаимодействии его с основными оксидами и основаниями он
дает соли.
Р2O5 + 3MgO = Mg3(PO4)2; Р2O5 + 6КОН = 2К3РO4+ 3Н2O.
6. Высший гидроксид фосфора— фосфорная кислота Н3РO4, рас-
твор которой проявляет все типичные свойства кислот: взаимодействие с основаниями и основными оксидами:
Н3РO4 + 3NaOH = Na3PO4 + 3Н2O. 2Н3РO4 + 3СаО = Са,(РO4)2↓ + 3Н2O.
7. Фосфор образует летучее соединение Н3Р — фосфин.
Б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и относительную атомную массу Аr(К) = 39. Соответственно заряд ядра его атома +19 (равен числу протонов). Следовательно, число нейтронов в ядре равно 20. Так как атом электронейтрален, то число электронов, содержащихся в атоме калия, тоже равно 19. Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
![]()
Исходя из строения атома, можно предсказать степень окисления
калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.
Восстановительные свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий— простое вещество, для него характерна металлическая
кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
3. Металлические свойства у калия выражены сильнее, чем у на-
трия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона
атома кальция.
5. Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +Н2O; К2O + SO3 = K2SO4.
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
KOH+HNO3 = KNO3+H2O; 2KOH+N2O5 = 2KNO3+H2O.
7. Летучего водородного соединения калий не образует, а образует гидрид калия КН.
Химические элементы-неметаллы
Вы, очевидно, помните, что самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не потеряла своей значимости и в настоящее время.
Неметаллы — это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Это определение оставляет в стороне элементы VIII группы главной подгруппы — инертные или благородные газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам. Они являются теми объектами, которые в естественной системе четко разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные или благородные газы («благородство» выражается в инертности) иногда относят к неметаллам, но чисто формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур.
Инертность в химическом отношении у этих элементов относительна. Для ксенона и криптона известны соединения с фтором и кислородом. Несомненно, в образовании этих соединений инертные газы выступали в роли восстановителей.
Из определения неметаллов следует, что для их атомов характерны высокие значения электроотрнцательности. Оиа изменяется в пределах от 2 до 4. Неметаллы — это элементы главных подгрупп, преимущественно р элементы, исключение составляет водород — s-элемент.
Все элементы-неметаллы (кроме водорода) занимают в Периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор.
Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в I и VII группах главных подгрупп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов, имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация 1s1), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления +1, Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов. С другой стороны, атому водорода, как и атомам галогенов, для завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления -1 в гидридах — соединениях с металлами, подобных соединениям металлов с галогенами — галогенидам. Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
При обычных условиях водород Н2 — газ. Его молекула, подобно галогенам, двухатомна.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах (рис. 47).
Фтор — самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, то есть проявлять восстановительные свойства.
Конфигурация внешнего электронного слоя
Другие неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами; в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
