Какое свойство отличает монокристалл от аморфного

В зависимости от внутреннего строения твердые тела бывают либо кристаллическими, либо аморфными. Молекулы и атомы кристаллов расположены в определенной, повторяющейся последовательности на больших расстояниях, сохраняя так называемый дальний порядок. Атомы и молекулы в аморфных телах размещены неупорядоченно, для них характерен ближний порядок со строением аналогичным жидкому состоянию вещества. Рассмотрим основные отличия кристаллических тел от аморфных, которые проявляются в их физических свойствах.

Твердые тела
Все твердые тела обладают следующими общими свойствами:
- Способностью долгое время сохранять форму и объем (геометрические размеры);
- Наличием упругих сил, которые возникают при небольших изменениях объема от внешнего воздействия (сжатия, растяжения или сдвига).

Рис. 1. Примеры решеток кристаллических и аморфных тел – кварц аморфный и кристаллический.
Современные ученые исследуют пространственное расположение атомов и молекул в твердых телах с помощью электронных микроскопов, которые позволяют получить изображение объекта с сильным увеличением (до 106 раз). Первый электронный микроскоп был изобретен в 30-х годах прошлого века. В 2018 г. с помощью последних версий этого прибора было получено разрешение 0,39 ангстрем. Напомним, что 1 ангстрем равен 10-8 см. В большинстве кристаллов это соответствует шагу атомной решетки.
Аморфные тела
Смола, воск, графит, изделия из стекла и янтаря, пластмассы — все это примеры аморфных тел (от греч.слова Amorphous — бесформенный, некристаллический).
Отсутствие дальнего порядка в расположении частиц вещества у аморфных тел приводит к тому, что их физические свойства одинаковы во всех направлениях. Такие тела называют изотропными (слово “изотропный” составлено из двух греческих слов: isos — ровный, tropos — направление). Изотропность физических свойств аморфных тел является следствием хаотичного расположения составляющих их молекул и атомов.
Характерной особенностью аморфных тел является отсутствие определенной температуры плавления, то есть отсутствует четкий переход от твердого состояния к жидкому: при нагревании аморфное тело становится только более текучим.
Кристаллические тела
Твердые тела, в которых молекулы и атомы расположены упорядоченно и образуют периодически повторяющуюся структуру, называются кристаллами. Физические свойства кристаллов (упругие, механические, тепловые, электрические, магнитные, оптические) в разных направлениях неодинаковы. Такое свойство называется анизотропностью. Анизотропия кристаллов объясняется тем, что при упорядоченном расположении частиц расстояния между ними и силы взаимодействия (притяжения и отталкивания) оказываются неодинаковыми в разных направлениях.
Различают кристаллические тела двух видов: монокристаллы и поликристаллы. Главным признаком монокристаллов является повторяющееся внутреннее строение (структура) во всем объеме тела.
Поликристалл — это совокупность (набор) сросшихся друг с другом, хаотически ориентированных, небольших кристаллов. Каждый маленький кристалл обладает свойствами анизотропии, но их совокупность — поликристалл — изотропен.

Рис. 2. Монокристаллы и поликристаллы.
Часто встречаются кристаллические тела одинаковые по своему химическому составу, но обладающие очень разные физические свойства. Самый известный пример — это углерод, имеющий две модификации: графит и алмаз. Разное строение кристаллических решеток является причиной того, что алмаз имеет рекордные показатели твердости, а графит из-за его мягкости используется в качестве грифелей для карандашей.

Рис. 3. Графит и алмаз.
Что мы узнали?
Итак, мы узнали, что кристаллические и аморфные тела кроме общих признаков, которые относят их к твердым телам, имеют совершенно разные физические свойства. Аморфные тела обладают изотропными свойствами, а для кристаллов характерна анизотропия физических параметров. Кристаллические тела делятся на монокристаллы и поликристаллы.
Тест по теме
Оценка доклада
Средняя оценка: 4. Всего получено оценок: 252.
Автор Маргарита Малиновская На чтение 7 мин. Опубликовано 06.04.2020
Каждый школьник знает, что любое вещество на планете может существовать в одном из четырех агрегатных состояний. Большой интерес в физике представляют собой твердые тела. По своей структуре их разделяют на два основных класса: кристаллические и аморфные. Отличием тел друг от друга занимается специальный раздел физики конденсированного состояния.
Твердое вещество
В термодинамике существует понятие об энергии Гиббса, минимум которой является достаточным критерием для существования определенной фазы в конкретно заданных условиях. Основные параметры окружающей среды, от которых зависит энергия Гиббса, это температура и давление.
По мере увеличения температуры и уменьшения давления можно наблюдать следующую последовательность переходов между агрегатными состояниями одного и того же с точки зрения химии вещества:

- Плазма.
- Газ.
- Жидкость.
- Твердое тело.
Таким образом, твердое вещество является энергетически стабильным при низких температурах и высоких давлениях, причем обе величины оказывают независимый вклад в функцию энергии Гиббса.
В отличие от других агрегатных состояний твердое характеризуется следующими особенностями, которые присущи только ему:
- Способность сохранять свою форму. Любому механическому воздействию твердое тело оказывает сопротивление.
- Постоянство объема. Чтобы изменить объем газа, достаточно его поместить в любой другой сосуд. Для изменения же этой величины для твердого вещества придется приложить значительное внешнее механическое усилие.
Примерами являются деревянная палка, кусок металла, стекло, золотое украшение, пластиковый корпус компьютера и так далее. Все эти предметы способны длительное время сохранять свою форму и не изменять объем.
Характеристика кристаллических и аморфных тел
Чтобы ясно понять, чем отличаются аморфные вещества от кристаллических, необходимо с каждым из этих классов познакомиться отдельно. Отличить один вид от другого часто только по внешним признакам не удается, поскольку оба имеют признаки твердого соединения. Многие люди иногда путают их между собой. Например, красивые стеклянные фрески ошибочно воспринимают кристаллами, а сосульки на крышах домов считают неверно аморфными соединениями.
Основное отличие между двумя классами веществ заключается в особенностях их внутреннего строения, в основе которого лежит пространственное расположение структурных единиц (атомов, молекул).
Упорядоченное строение
Кристаллы являются достаточно обширным классом веществ. Для них характерна строгая периодичность в пространстве составляющих их структурных единиц. Последние носят название элементарных ячеек.

Наука, которая занимается изучением этого подвида твердых тел, называется кристаллографией. В ней для описания геометрических свойств монокристаллов вводят координатные оси. В большинстве случаев используют декартову прямоугольную систему координат, с которой удобно работать на практике. Если взять определенную группу атомов или молекул и перемещать ее на элементарные векторы вдоль каждой из трех взаимно перпендикулярных осей, то получится весь объем кристалла. Используемая при этом группа атомов называется элементарной ячейкой.
Поскольку периодичность в кристаллах может отличаться величинами элементарных векторов трансляции и характером расположения атомов в выбранной для перемещения группе, то в кристаллографии вводят несколько сингоний (кристаллических систем имеющих определенную пространственную группу симметрии). Их 6, и следует их расположить в таком порядке:
- Триклинная.
- Моноклинная.
- Орторомбическая.
- Тетрагональная.
- Гексагональная.
- Кубическая.
Чем больше номер сингонии, тем более высокой симметрией обладают ее кристаллы. Так, кубическая — это самая симметричная система. Ей обладают большинство металлов. Например, медь, серебро, золото и алюминий имеют гексагональную гранецентрированную кубическую решетку (ГЦК). В свою очередь, железо, вольфрам, ниобий, молибден, ванадий — это представители объемноцентрированной кубической решетки (ОЦК). Некоторые металлы характеризуются гексагональной сингонией (ГПУ), например, кобальт, титан и цирконий.
Аллотропные модификации
Необходимо вспомнить о существовании так называемых аллотропных модификациях. Они представляют собой разное кристаллическое строение одного и того же по своему химическому составу вещества.
Здесь будет наглядным привести пример железа при атмосферном давлении. Когда температура окружающей среды меньше 911 градусов по Цельсию, то его стабильной является решетка ОЦК. Как только температура становится выше, происходит перестройка структуры в более выгодное энергетическое состояние. Выше 911 градусов железо имеет решетку ГЦК. В промежутке температур 1392−1539 градусов по Цельсию снова образуются кристаллы ОЦК.

Другим примером является олово. Оно бывает двух аллотропных модификаций: белое и серое. Первая из них представляет собой высокотемпературную (выше 13 градусов) и обладает высокой пластичностью, свойственной любому металлу. Серое же олово существует в стабильном состоянии при температурах ниже 13 градусов и характеризуется высокой хрупкостью. Именно поэтому не следует использовать оловянную посуду при низких температурах, поскольку она просто-напросто превратится в пыль.
Анизотропия свойств

В какой бы аллотропной форме ни находилось кристаллическое вещество, оно всегда характеризуется анизотропией физических свойств. Причина этого — все то же упорядоченное строение. Например, поваренная соль при попадании в воду растворяется строго по определенным плоскостям, которые являются наиболее плотноупакованными. Другой пример — кристалл турмалина, в зависимости от того, в каком направлении относительно него падает луч света, он может проявлять или не проявлять свойства двойного лучепреломления.
Уникальным свойством многих кристаллов, подтверждающим их анизотропный характер, является отнесение многих из них к классу пьезо- или пироэлектриков. Так, механическая деформация в определенном направлении или локальный нагрев приводят к появлению разности потенциалов между двумя точками кристалла.
Весьма наглядным примером является также графит. Для него характерно наличие плотноупакованных гексагонов, которые соединены друг с другом слабыми пи-связями. Даже небольшое механическое усилие, направленное перпендикулярно этим связям, приводит к расслоению графита.
Отсутствие дальнего порядка
Аморфные вещества — это твердые тела, которые не обладают характерным для кристаллов дальним порядком. Иными словами, в них нельзя выбрать элементарную ячейку и оси трансляции таким образом, чтобы с помощью ее переноса на определенные вектора получить весь объем.
Детальное изучение амфотерных соединений и их сравнение с кристаллами привело ученых к выводу, что они все же обладают так называемым ближним порядком (сходство с кристаллическим состоянием). Этот факт можно объяснить тем, что каждый атом или молекула обладает способностью образовать определенное количество связей (ковалентных, диполь-дипольных, ионных, водородных и другие) до их насыщения. Кроме того, само пространство вокруг частицы является ограниченным, и в случае плотной упаковки в нем может расположиться лишь определенное количество атомов или молекул.

Практически любое твердое тело можно получить в аморфном виде. Для этого необходимо его расплав или газовую фазу охладить с высокой скоростью. В случае металлов она должна достигать миллионов градусов в секунду. Полученные в таких условиях аморфные ленты обладают рядом уникальных характеристик. Если сравнить их с аналогичными свойствами для кристаллов, то можно выделить следующее:
- изотропность;
- особое электронное строение (отсутствие четких валентных зон и зон проводимости, которые свойственны кристаллам);
- иные коэффициенты упругости, чем для кристаллов, и практически полное отсутствие пластичности при низких температурах;
- отсутствие аллотропных модификаций.
Аморф — это хаос в расположении составляющих его частиц, поэтому не идет никакой речи об аллотропных модификациях или анизотропии свойств в таких веществах. Также для них нет четкой температуры плавления, поскольку это твердое тело напоминает собой застывшую жидкость. Если его нагревать, то оно плавно будет уменьшать свою вязкость. Примером может служить любой пластик. Его нагрев приводит к постепенному появлению мягкости и тягучести.
Причина отличия свойств
Из описания характеристик кристаллов и аморфных веществ следует, что они различаются практически во всем, кроме того факта, что оба относятся к твердому агрегатному состоянию. Тем не менее у всех этих физических различий имеется лишь одна-единственная причина — пространственная структура на микроскопическом уровне.

Если наблюдается дальний порядок и периодичность в расположении элементарных структурных единиц, то вещество является кристаллом и для него характерны анизотропия, полиморфизм, четкий переход в жидкое состояние. Если же дальнего порядка в расположении частиц нет, а существует только их ближнее упорядочивание, то можно говорить, что его свойства по всем направлениям одинаковы, отсутствует полиморфизм и температурная точка плавления.
Различие характеристик кристаллов и аморфных веществ позволяет человеку значительно изменять свойства твердых тел с использованием только физических методов воздействия, что открывает широкие возможности для применения их для нужд жизнедеятельности. Изменение химического состава вещества может создавать условия для его кристаллизации или аморфизации.
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические.
Характерной особенностью аморфных тел является их изотропность, т. е. независимость всех физических свойств (механических, оптических и т. д.) от направления внешнего воздействия. Молекулы и атомы в изотропных твердых телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям. Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), пластики и т. д. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур.
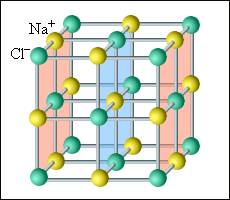
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы NaCl (рис. 3.6.1). Такие кристаллы называются ионными.
|
Рисунок 3.6.1. Кристаллическая решетка поваренной соли |
В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса (трансляции) элементарной ячейки по некоторым направлениям.
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур. Большинство из них (но не все) обнаружены в природе или созданы искусственно.
Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллические тела состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами. Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
В отличие от монокристаллов, поликристаллические тела изотропны, т. е. их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом. Переход из одной модификации в другую называется полиморфным переходом. Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60–100 тысяч атмосфер и температурах 1500–2000 К.
Структуры кристаллических решеток экспериментально изучаются с помощью дифракции рентгеновского излучения на монокристаллах или поликристаллических образцах.
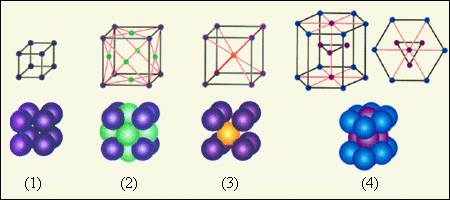
На рис. 3.6.2 приведены примеры простых кристаллических решеток. Следует помнить, что частицы в кристаллах плотно упакованы, так что расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решеток указывается только положение центров частиц.
|
Рисунок 3.6.2. Простые кристаллические решетки: 1 – простая кубическая решетка; 2 – гранецентрированная кубическая решетка; 3 – объемноцентрированная кубическая решетка; 4 – гексагональная решетка |
В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. 3.6.1 решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na+ и Cl–. В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
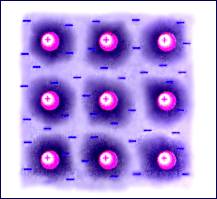
Кристаллические структуры металлов имеют важную особенность. Положительно заряженные ионы металла, образующие кристаллическую решетку, удерживаются вблизи положений равновесия силами взаимодействия с «газом свободных электронов» (рис. 3.6.3). Электронный газ образуется за счет одного или нескольких электронов, отданных каждым атомом. Свободные электроны способны блуждать по всему объему кристалла.
|
Рисунок 3.6.3. Структура металлического кристалла |
КРИСТАЛЛОГРАФИЯ
СИММЕТРИЯ
Лекция 1
Лекция 1
ОБЩИЕ СВЕДЕНИЯ О СТРОЕНИИ И СВОЙСТВАХ КРИСТАЛЛИЧЕСКИХ ТЕЛ
Содержание
1.1. Кристаллография как наука.
1.2. Виды твёрдых тел.
1.3. Отличительные особенности кристаллических и аморфных тел.
1.4. Особые свойства кристаллов.
1.5. Виды связей в кристаллах.
1.6. Силы взаимодействия частиц.
1.7. Кристаллическая решётка. Элементарная ячейка.
1.8. Индексы Миллера.
1.9. Рентгеноструктурный анализ.
КРИСТАЛЛОГРАФИЯ КАК НАУКА
Кристаллография– наука об атомно-молекулярном строении, симметрии, физических свойствах, образовании и росте кристаллов. Как самостоятельная наука существует с середины XVIII века. Сначала она развивалась как геометрическая кристаллография в тесной связи с минералогией, которая устанавливала закономерности огранки природных кристалликов, имеющих естественную форму правильных многогранников (Р. Гаюи). Затем появилась теория симметрии внешней формы кристаллов (А.В. Гадолини).
Геометрическая кристаллографияопределяет совокупность методов описания кристаллов и закономерности их огранки. В этой теории возникла гипотеза об упорядоченном трёхмерно-периодическом расположении частиц в кристалле с образованием кристаллической решётки (О. Браве, Е.С. Фёдоров, А. Шёнфлис).
Экспериментальными исследованиями дифракции рентгеновских лучей на кристаллах было подтверждено решёточное строение кристаллов и положено начало структурной кристаллографии(М. Лауэ). В качестве основных структурная кристаллографияиспользует метод рентгеноструктурного анализа, электроно- и нейтронографии, а также методы оптической и электронной спектроскопии. В результате всех исследований к настоящему времени определена структура более 105химических веществ.
Предметом кристаллохимии является изучение законов взаимного расположения атомов и молекул в кристаллах, их химических связей и плотнейших упаковок, а также явлений изо- и полиморфизма.
Кристаллооптика занимается вопросами прохождения света через прозрачные анизотропные кристаллы, сформулировала многие закономерности взаимного влияния симметрии и анизотропии физических свойств.
Кристаллофизикарассматривает в едином русле форму, симметрию и физические свойства кристаллов; занимается вопросами исследования механических, оптических, электрических, магнитных и других свойств кристаллов. В этой части кристаллография смыкается с физикой твёрдого тела.
В кристаллографии изучаются разнообразные дефекты построения идеальной кристаллической решётки: точечные, линейные (дислокации), поверхностные и объёмные. Многие из них появляются в результате роста кристалла или при внешнем воздействии на кристалл напряжением, облучением и т. д.
Для современной кристаллографиихарактерно дальнейшее изучение атомной и дефектной структур кристаллов, процессов их роста, поиск новых свойств и материалов. Основная задача кристаллографии как науки на сегодняшний день – получение новых материалов с важными физическими свойствами. К решению этой задачи необходимо подходить комплексно, рассматривая атомную структуру, анизотропию свойств, взаимодействие кристаллов с окружающей средой в их взаимодействии.
В современной кристаллографии исследуются строение и свойства различных агрегатов из микрокристалликов (поликристаллов, текстур, керамик), а также вещества с атомной упорядоченностью, близкой к кристаллической (жидкокристаллические вещества, полимерные и композиционные материалы).
Симметричные и структурные закономерности, изучаемые в кристаллографии, используются при рассмотрении общих закономерностей строения и свойств аморфных тел и жидкостей, полимеров, квазикристаллов, макромолекул, надмолекулярных аморфно-кристаллических, а также биологических структур. Поэтому современная кристаллография представляет собой обобщённую кристаллографию,математический аппарат которой основан на дискретной геометрии, теории групп, тензорном исчислении и теории преобразований Фурье.
ВИДЫ ТВЕРДЫХ ТЕЛ
Твёрдое телосостоит из большого числа частиц. Этими частицами могут быть атомы, атомные остатки, ионы, молекулы, макромолекулы. Концентрация частиц в твёрдых телах высока: (1026 – 1029) м-3 . Расстояния между частицами составляют несколько нанометров.
Структуру твёрдых телисследуют дифракционными методами, основанными на дифракции рентгеновских лучей, электронов, нейтронов, используя при этом стандартные установки: рентгеновский дифрактометр, электронный микроскоп, ионный проектор и др. Физика твёрдого тела и кристаллография имеют прямое отношение к нанотехнологиям (рис. 1.1). Нанотехнологии разрабатываются на эффектах, возникающих на уровне атомных размеров.
Свойства твёрдых телобъясняются многими факторами и зависят от химического состава вещества, типа частиц, их внутреннего расположения, типа химической связи между частицами.
Свойства кристаллов широко применяются в оптике, акустике, радиоэлектронике, металловедении, металлургии, химии, медицине. Твёрдые тела встречаются в природе в виде кристаллических и аморфных тел, а также полимеров. В физике к твёрдым телам относят только кристаллические тела.
Рис. 1.1. Электронная микрофотография структуры алмаза вдоль направления [110]
Кристаллы– твёрдые тела, обладающие трёхмерной периодической атомной структурой и имеющие при равновесных условиях образования естественную форму правильных симметричных многогранников. Атомная структура кристалла описывается как совокупность повторяющихся в пространстве одинаковых элементарных ячеек, имеющих форму параллелепипеда. Кристаллы, выросшие в равновесных условиях, имеют форму правильных многогранников той или иной симметрии. Грани кристалла плоские, а рёбра между гранями — прямолинейные. Выросшие в неравновесных условиях кристаллы не имеют правильной огранки, но сохраняют кристаллическую структуру и все присущие данной структуре свойства. Неравновесные условия кристаллизации приводят к отклонениям только формы от правильного многогранника – к округлости граней и рёбер. Примерами кристаллических тел являются горный хрусталь, поваренная соль, драгоценные камни.
В кристаллахчастицы расположены правильными, симметричными, периодически повторяющимися рядами, сетками, решётками. Кристаллы вырастают в форме многогранников (рис. 1.2). Способность кристалла приобретать конкретную форму – это проявление его физических свойств, определяющихся его структурой, симметрией и химическими связями между его частицами.
Рис. 1.2. Внешний вид кристаллических тел
Кристаллические тела встречаются в природе в виде моно- и поликристаллов. Монокристаллы(большие одиночные кристаллы) получают при создании специальных условий кристаллизации (рис. 1.3).
Рис. 1.3.Монокристаллы кремния
Монокристалл состоит из блоков мозаики,размер которых в монокристалле составляет (10–6–10–8) м. Так как кристаллическая решетка в соприкасающихся блоках имеет различную ориентацию, то возникает переходный слой, в котором решетка постепенно переходит от одной ориентации, свойственной одному блоку, к другой ориентации, свойственной другому блоку. Поэтому решетка в этом слое искажена по сравнению с решеткой идеального кристалла. Поликристаллсостоит из беспорядочно ориентированных кристалликов (кристаллитов) малых размеров (рис. 1.2, справа). Размер кристаллитов порядка 10–4 м.
Аморфные тела– вещества, в атомном строении которых нет порядка: частицы расположены беспорядочно, независимо друг от друга (воск, пластилин). Отличительной особенностью аморфных тел является изотропностьвсех физических и механических свойств.
Полимерысостоят из многочисленных звеньев одинакового химического состава – макромолекул. Например, полимерным материалом является политетрафторэтилен, химическая формула которого (СF2)n, где n = 13.
К особым видам твёрдых тел относятся жидкокристаллические тела,нашедшие широкое применение в телевидении и сотовой связи, и закристаллизованные жидкости,которые обладают особыми свойствами.
ОТЛИЧИТЕЛЬНЫЕ ОСОБЕННОСТИ КРИСТАЛЛИЧЕСКИХ И АМОРФНЫХ ТЕЛ
Рассмотрим некоторые свойства твёрдых тел, которые характеризуют их как кристаллические или аморфные тела.
1. Кристаллыимеютупорядоченное расположение частиц на сколь угоднобольших расстояниях. Частицы расположены в узлах кристаллической решётки.Аморфные тела имеют упорядоченноерасположение частиц на небольших расстояниях (в так называемых группах) (рис.1. 4). Расположение частиц в веществе характеризуется наличием дальнего и ближнего порядков.
Рис. 1.4. Вещество H2O в двух агрегатных состояниях: воды (1) и льда (2)
2. Дальний порядок– упорядоченное расположение частиц на сколь угодно больших расстояниях от рассматриваемой частицы.
– характеризуется коэффициентом α.
Ближний порядок– упорядоченное расположение частиц на малых расстояниях от рассматриваемой частицы.
– характеризуется коэффициентом β.
| Агрегатное состояние вещества | коэффициент дальнего порядка α | коэффициент ближнего порядка β |
| кристаллические тела | 1 | 1 |
| аморфные тела | < 1 | > 0 |
| жидкости | 0 | 1 |
| газы | 0 | 0 |
3. Кристаллические и аморфные тела различаются ходом температурной зависимости температуры плавления.
4. Для кристаллов характерно наличие анизотропии. Анизотропия– зависимость свойств вещества от направления в кристалле. Например, слюда по-разному разламывается в различных направлениях. Анизотропией диэлектрической проницаемости объясняется существование в кристаллах турмалина двойного лучепреломления (рис. 1.5).
Рис. 1.5. Двойное лучепреломление в кристалле турмалина
Обладают анизотропией очень многие физические и механические свойства кристаллических тел, например: теплопроводность, электропроводность, скорость света, двойное лучепреломление. Аморфные тела изотропны,у них свойства одинаковы по всем направлениям в веществе. Примером является пластилин, который легко сжимается в любых направлениях.