Какое свойство атомов химических элементов не изменяется в периодах
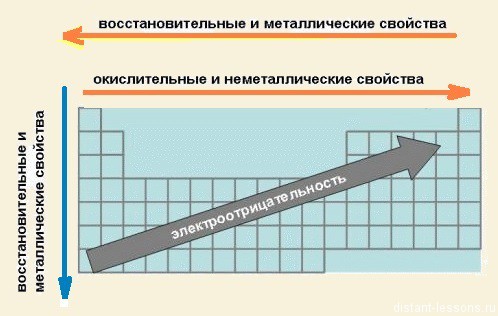
По каким закономерностям изменяются свойства элементов в таблице Менделеева?
Анонимный вопрос · 30 октября 2018
251,5 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
При движении по группе главной подгруппы сверху вниз⬇️
????Радиус атома увеличтвается
????Электроотрицательность уменьшается
????Окислительные свойства ослабевают
????Восстановительные свойства усиливаются
????Неметаллические ослабевают
????Металлические усиливаются
По периоду слева направо всё наоброт????
????Радиус уменьшается
????ЭО возрастает
????Окислительные свойства усиливаются
????Восстановительные ослабевают
????Неметаллические увеличиваются
????Металлические свойства ослабевают
Педагог, музыкант, начинающий путешественник и немножко психолог
В периодах (слева направо): увеличивается заряд ядра, число электронов на внешнем уровне, уменьшается радиус атомов, в связи с этим увеличивается прочность связи электронов с ядром и электроотрицательность, что в свою очередь ведет к усилению окислительных свойств (неметаличности) и ослаблению восстановительных (металличности).
В группах (сверху вниз): увеличивается… Читать далее
Можете зайти на этот форум и найти нужный вам ответ!!Осень будем рады вас там видеть!♥️https://blog.pachca.com/post… Читать дальше
Как построена периодическая система химических элементов?
Интересы часто менялись, поэтому во многих областях знаний что-то знаю:)
В периодической системе отражаются сходства свойств различных элементов.
Выделяют:
- группы (столбцы таблицы), в рамках которых элементы обыкновенно имеют одинаковые электронные конфигурации на их валентных оболочках.
- периоды (строки таблицы), в рамках которых элементы демонстрируют определённые закономерности в атомном радиусе, энергии ионизации и электроотрицательности, а также в энергии сродства к электрону.
- блоки, элементы в которых объединены тем, на какой оболочке находится последний электрон. Блоковая структура выглядит так:
Подробнее почитать обо всех закономерностях периодической системы можно здесь
Если есть, то какая вероятность того, что во вселенной есть еще не открытые химические элементы?
Есть, стопроцентная.
Менделеев, когда открыл периодическую таблицу химических элементов, расположил в ней все известные на тот момент элементы. Гениальность его открытия в том и состояла, что с помощью этой таблицы можно было предсказать свойства еще неоткрытых химических элементов.
И эта блестящая теория на сто процентов оправдала себя. С момента составления таблицы было открыто множество химических элементов и все они укладывадись в прогнозы.
На данный момент остались неоткрытыми 8 элементов:
- Унбибий
- Унбигексий
- Унбиквадий
- Унбинилий
- Унбипентий
- Унбитрий
- Унбиуний
- Унуненний
Сложность в том, что их место и предполагаемые свойства известны, а вот условия, в которых они появляются — нет. Но они явно далеки от земных и моделирование таких условий в научных лабораториях — дело не столь отдаленного будущего
Почему высшая валентность изменяется периодически?
TutorOnline — одна из крупнейших онлайн-школ. Мы преподаем более 150 предметов. Наша цель… · tutoronline.ru
С увеличением порядкового номера элемента в периоде увеличивается количество электронов на внешнем энергетическом поле, которые могут создавать химические связи. Больше электронов — выше валентность! В малых периодах с увеличением зарядов ядер радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается. Они всё сильнее притягиваются к ядру и труднее отрываются от атома. Легче всего отрываются электроны от атомов щелочного металла франция. В периоде с увеличением заряда ядра радиус атома уменьшается, число валентных электронов и их притяжение к ядру растёт, и атомам всё легче присоединять дополнительные электроны на внешний уровень. Наиболее активно принимают электроны атомы галогена фтора.
Что значит «сильные поля у атомов» в физике?
Сусанна Казарян, США, Физик
А то и значит, что в атомах огромные электростатические поля удерживают электроны на квантовых орбитах. Оценим количественно эти поля, используя квазиклассическое приближение Бора. Заряд протона q = 1,6×10⁻¹⁹ Кл. Напряжённость электростатического поля на первой Боровской орбите (радиус, r ≈ 5,3×10⁻¹¹ м) равен |Е| = kq/r² ≈ 5×10¹¹ В/м, где k ≈ 9×10⁹ Н⋅м²⋅Кл⁻². Таких огромных полей в природе нет, кроме как в атомах и в атомных ядрах.
Для сравнения, пробивная напряжённость электростатического поля в воздухе равна около 3×10⁶ В/м, что соответствует средней напряжённости электростатического поля, создаваемая грозовым облаком непосредственно перед формированием молнии. Видно, что это значение на 5 порядков (в 100000 раз) меньше, чем электрическое поле в атоме.
Кстати, именно такие гигантские электрические поля и приводят к частоте вращения (в квазиклассическом приближении) электрона в атоме водорода ~10¹⁶ оборотов в секунду и электрическому току на первой Боровской орбите атома водорода ~1 мА.
Чем определяется различие свойств изотопов калия 40,19 и аргона 40,18?
Различие определяется различием количества, и соответственно заполнения электронных орбиталей электронами (в следствие различия в заряде ядра).
Химические свойство определяются прежде всего заполнением орбиталей электронами, отсюда и свойства.
У аргона все орбитали заполнены полностью, поэтому он инертен. У калия появляется новый уровень с одном электроном, слабо связанным с ядром — отсюда его готовность вступать в химические реакции, отдавая валентный электрон.
26-Авг-2012 | комментарий 21 | Лолита Окольнова
по периодам и группам
Химические свойства элементов (а уж тем более их соединений!) напрямую зависят от строения атома.
Не надо учить наизусть химические свойства каждого атома, не надо зазубривать химические реакции… ответ на любой вопрос по химии находится в Периодической системе элементов.

Как изменяются электронные конфигурации s-, p-элементов (по группам и периодам) и d-элементов, тоже можно почитать отдельно.
Давайте рассмотрим, как изменяются свойства химических элементов в группах и в периодах.
1. Изменения свойств химических элементов и их соединений в группах:

В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
- Меняется размер атома — сверху вниз в группе радиусы атомов увеличиваются!
Что это означает? Это означает, что
1) внешние электроны все слабее притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны.
3) способность отдавать электроны=металлические свойства, т.е.
закономерность изменения химических свойств элементов и их соединений в группах:
- В группах сверху вниз возрастают металлические свойства элементов
- усиливаются основные свойства их соединений
Изменения химических свойств элементов и их соединений в периодах:

В периодах наблюдается несколько другая картина:
1) Слева направо в периодах радиусы атомов уменьшаются;
2) количество электронов на внешнем слое при этом увеличивается;
3) электроотрицательность элементов = неметаллические свойства увеличивается
закономерности изменения химических свойств элементов и их соединений в периодах:
- В периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность;
- усиливаются кислотные свойства их соединений

Исходя из этих соображений получается, что звание «Король Неметаллов» у нас присуждается… (барабанная дробь)… F ! Рядом с ним даже кислород (O) проявляет положительную степень окисления: OF2 — бесцветный ядовитый газ с неприятным запахом.
Итак, подведем итог:
С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.

Есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства.
К ним относятся:
- Zn
- Cr
- Al
- Sn
- Pb
- Mn
- Fe
- Be
- вопросы заданий ЕГЭ по этой теме — А2
- А2 ГИА (ОГЭ)
Тест
1. В ряду Li → Ве → В → С
усиливаются восстановительные свойства простых веществ
усиливается основность соединений
усиливаются кислотные свойства соединений
кислотные свойства элементов ослабевают
2. Усиление металлических свойств элементов представлено в ряду:
N → Р → As
S → Р → Si
Sb → As → P
Al → C → N
3. Электронную конфигурацию 1s(2)2s(2)2р(6)3s(2)Зр(6)4S(0)имеет ион
Ca(0)
Al(3+)
Cs(+)
K(+)
4. В каком ряду кислотность соединений возрастает
Cr(0), Cr(3+), Cr(+6)
Mn(+6), Mn(+4), Mn(+2)
Cl(+7), Cl(+3), Cl(+1)
S(+6), S(+4), S(0)
5. Как изменяются кислотные свойства оксидов хрома в ряду: CrO — Cr2O3 — CrO3
основной — кислотный — амфотерный
основной — амфотерный — кислотный
все основные
все несолеобразующие
6. Даны элементы: F, O, N, Cl. Какие утверждения верны?
в заданном ряду элементов электроотрицательность уменьшается
основные свойства оксидов этих элементов ослабевают, а кислотные усиливаются
неметаллические свойства простых веществ усиливаются
степень окисления атомов в высших оксидах одинакова
7. Наиболее выражены металлические свойства у:
фософра
азота
рубидия
водорода
8. Только амфотерные оксиды указаны в ряду:
Na2O, ZnO, CuO
ZnO, Al2O3, Cr2O3
Al2O3, FeO, SO3
CO2, CO, N2O5
9. Выберите правильное утверждение: А 9.в ряду элементов: Na – Si – Cl неметалличность простых веществ, образуемых этими элементами, усиливается B. в этом ряду степени окисления атомов в соединениях с кислородом увеличиваются
утвеждение А верно
веное утверждение — B
оба утверждения верны
оба неверны
10. Соединения элемента с порядковым номером 20
простое вещество проявляет металлические свойства
оксид элемента — кислотный
при взаимодействии с водой оксид элемента образует кислоту
в соединениях проявляет отрицательную степень окисления
Категории:
|
Обсуждение: «Закономерности изменения химических свойств элементов и их соединений»
(Правила комментирования)
Анонимный вопрос · 6 марта 2019
8,8 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️Что такое восстановительные свойства? ☘️
Это способность атома отдавать электроны????
????При движении по периоду слева направо восстановительные свойства уменьшаются???? Потому что электроотрицательность (способность отбирать электроны) возрастает, и атомы всё неохотнее отдают электроны????
????При движении по группе сверху вниз восстановительные свойства возрастают???? Потому что увеличиваются радиус атома и заряд ядра, а число электронов на внешнем уровне не меняется
Вот полезная табличка. Она показывает, как меняются свойства элементов в таблице Менделеева. С ней точно не запутаетесь????
Чем химический элемент отличается от вещества?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
????Чем отличается элемент от вещества ?????
✅Вещество- это то, из чего состоят физические тела.Является одной из форм материи
✅Выделяют простые вещества,состоящие из атомов одного элемента
Например, О2,Сl2,N2
И сложные вещества ,состоящие из атомов двух или более элементов
Например, Н2О,СО2,С6Н12О6
✅Элемент-это совокупность атомов с одинаковым зарядом атомных ядер
Элементы представлены в таблице Менделеева
✅Если сказать:«Кислород -это газ»,то здесь понятно,что это вещество
Если сказать: «Кислород входит в состав воды», то здесь можно сделать вывод о том,что кислород-это элемент
Прочитать ещё 2 ответа
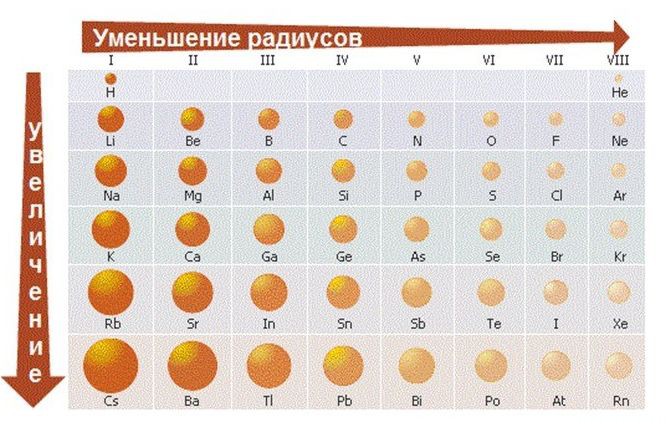
Как изменяется радиус атома в таблице менделеева?
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · vk.com/mendo_him
☘️При движении по периоду слева направо радиус атома уменьшается. Почему?
????Число электронов на внешнем уровне возрастает
P. S. Число электронов равно номеру элемента в таблице Менделеева????
????Много электронов сильно давят на атомное ядро ➡️атом сжимается➡️радиус уменьшается
☘️По группе сверху вниз радиус возрастает, т. к.
????Возрастает число уровней, значит, для электронов больше свободного пространства в атоме
????Электроны всё меньше и меньше давят на ядро ➡️радиус увеличивается????
Прочитать ещё 1 ответ
Почему высшая валентность изменяется периодически?
TutorOnline — одна из крупнейших онлайн-школ. Мы преподаем более 150 предметов. Наша цель… · tutoronline.ru
С увеличением порядкового номера элемента в периоде увеличивается количество электронов на внешнем энергетическом поле, которые могут создавать химические связи. Больше электронов — выше валентность! В малых периодах с увеличением зарядов ядер радиус атомов уменьшается, а число электронов на внешнем уровне увеличивается. Они всё сильнее притягиваются к ядру и труднее отрываются от атома. Легче всего отрываются электроны от атомов щелочного металла франция. В периоде с увеличением заряда ядра радиус атома уменьшается, число валентных электронов и их притяжение к ядру растёт, и атомам всё легче присоединять дополнительные электроны на внешний уровень. Наиболее активно принимают электроны атомы галогена фтора.
Можно ли в теории синтезировать 1000 или 10000 элемент таблицы Менделеева или есть какой-то предел?
Физик-теоретик, PhD студент в Университете Уппсалы, Швеция
Может показаться странным, но у таблицы Менделеева действительно существует предел и он равен 137.
Это неожиданное число берется из значения постоянной тонкой структуры. Последняя, в свою очередь, характеризует силу электромагнитного взаимодействия и равна почти точно 1/137 в любой системе единиц.
Постоянная тонкой структуры дает предел для максимального числа протонов в ядре, при котором электроны еще могут иметь стабильные орбиты. Другими словами эта постоянная позволяет определить последний возможный нейтральный атом таблицы Менделеева — 137й.
Я напомню, что на сегодняшний день в периодической таблице открыто 118 элементов, из которых 24 последних синтезированы искуссвенно.
Прочитать ещё 1 ответ
С чем связаны пустые клетки в первых трех периодах таблицы Менделеева? Возможны ли элементы, которые будут открыты позже и встанут на эти места?
Researcher, Institute of Physics, University of Tartu
Вы, вероятно, имеете в виду «длинный» вариант таблицы. В этом варианте d-элементы помещены по горизонтали между s- и р-элементами, что соответствует порядку заполнения орбиталей в старших периодах. В первых трех периодах при этом получается дырка, поскольку заполнение первой d-орбитали (3d) начинается только у элементов четвертого периода. Это вопрос энергии орбиталей, не суть важно для вопроса, почему это происходит у элементов 4-го периода, хотя орбиталь 3d.
Но с точки зрения количества протонов/электронов в ядре, никакой дырки нет, то есть, у каждого следующего атома на 1 электрон/протон больше, чем у предыдущего, поэтому никаких новых элементов не будет, меньше одного электрона/протона прибавить нельзя. Дырка появляется только за тем, чтобы графически отразить последовательность заполнения орбиталей.
Порядок заполнения
уровней и подуровней электронами.
I. Электронные формулы атомов химических
элементов составляют в следующем порядке:
·
Сначала по номеру элемента в таблице Д. И.
Менделеева определяют общее число электронов в атоме;
·
Затем по номеру периода, в котором расположен
элемент, определяют число энергетических уровней;
·
Уровни разбивают на подуровни и орбитали, и
заполняют их электронами в соответствии Принципом
наименьшей энергии
·
Для
удобства электроны можно распределить по энергетическим уровням, воспользовавшись
формулой N=2n2 и с учётом того, что:
1.
у элементов главных подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру группы.
2.
у элементов побочных подгрупп на
внешнем уровне обычно два электрона (исключение составляют
атомы Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, у которых на внешнем уровне один электрон, у Pd на внешнем уровне ноль
электронов);
3.
число электронов на предпоследнем уровне равно
общему числу электронов в атоме минус число электронов на всех остальных
уровнях.
II. Порядок заполнения электронами атомных
орбиталей определяется:
1.Принципом
наименьшей энергии
Шкала энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…

2. Состояние
атома с полностью или наполовину заполненным подуровнем (т. е. когда на каждой орбитали имеется по
одному неспаренному электрону) является более устойчивым.
Этим объясняется «провал» электрона. Так, устойчивому состоянию атома
хрома соответствует следующее распределение электронов:
Cr: 1s22s22p63s23p64s13d5,
а не 1s22s22p63s23p64s23d4,
т. е. происходит «провал» электрона с 4s-подуровня на 3d-подуровень.
III. Семейства химических элементов.
— Элементы, в атомах которых происходит
заполнение электронами s-подуровня внешнего
энергетического уровня, называются s-элементами. Это первые 2 элемента
каждого периода, составляющие главные подгруппы I иII групп.
— Элементы, в атомах которых электронами
заполняется p-подуровень внешнего энергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII),
составляющие главные подгруппы III—VIII групп.
— Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
— Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся
лантаноиды и актиноиды.
ЗАКРЕПЛЕНИЕ
Решите тестовые задания (один верный вариант ответа).
1. Заряд ядра атома фосфора равен
а) +30
б) +31
в) +15
г) +5
2. Количество энергоуровней в атоме равно
а) порядковому номеру элемента;
б) номеру группы;
в) заряду ядра атома;
г) номеру периода
3. Число нейтронов в атоме цинка равно
а) 30
б) 35
в) 4
г) 2
4. В ряду элементов Na, Mg, Al, Cl металлические свойства
а) убывают;
б) возрастают;
в) не изменяются;
г) сначала убывают, а затем возрастают
5. Формула высшего оксида RO2 характерна для
а) Li
б) Br
в) C
г) N
6. Электронная формула строения атома меди, это-
а) 1s22s22p63s23p64s23d10;
б) 1s22s22p63s23p64s23d9;
в) 1s22s22p63s23p64s13d10 ;
г) 1s22s22p63s23p64s13d11 .
7. Заряд ядра атома кальция равен
а) +20
б) +2
в) +40
г) +41
8. Число электронов на внешнем энергоуровне для элементов главных подгрупп равно
а) номеру периода;
б) номеру группы;
в) порядковому номеру элемента;
г) атомной массе.
9. Число нейтронов в атоме железа равно
а) 26
б) 55
в) 56
г) 30
10. В ряду элементов C, Si, Ge, Sn способность отдавать валентные электроны
а) уменьшается;
б) не изменяется;
в) увеличивается;
г) сначала увеличивается, а затем уменьшается.
11. Формула летучего водородного соединения для элемента с электронным строением атома 1s22s22p2 – это
а) RH4;
б) RH3;
в) RH2;
г) RH.
12. Электронная формула строения атома мышьяка, это-
а) 1s22s22p63s23p64s13d114p3;
б) 1s22s22p63s23p64s23d94p4;
в) 1s22s22p63s23p64s13d104p4 ;
г) 1s22s22p63s23p64s23d104p3 .
ТРЕНАЖЁР №1
ТРЕНАЖЁР №2
При рассмотрении свойств элементов отметим, что причиной их периодического изменения является периодичность структур электронных слоев и оболочек атомов. Важнейшими периодически изменяющимися свойствами свободных атомов являются радиусы атомов, энергия ионизации и сродство к электрону.
РАДИУСЫ АТОМОВ И ИОНОВ. Изолированный атом не имеет строго определенного размера из-за волновых свойств электрона. Следовательно, понятие размера атома, его радиуса весьма условно. Тем не менее, часто необходимо знать хотя бы приближенные значения радиусов атомов. Для их оценки используют так называемые ЭФФЕКТИВНЫЕ РАДИУСЫ. Это радиусы, которые имеют атомы, входя в состав реальных простых веществ. Их обозначают .
Эффективные атомные радиусы элементов в периодах уменьшаются от щелочного металла к галогену. Объяснить это можно тем, что с увеличением заряда ядра увеличивается сила кулоновского притяжения электронов к ядру, которая преобладает над силами взаимного отталкивания электронов. Происходит сжатие электронной оболочки. Наиболее заметное уменьшение эффективного радиуса наблюдается для s- и р – элементов. В рядах d и f – элементов радиусы изменяются более плавно вследствие заполнения электронами второй и третьей снаружи оболочки.
В главных подгруппах с увеличение главного квантового числа происходит заметное увеличение радиуса атома. Для элементов побочных подгрупп изменение радиусов незначительное, а при переходе от пятого к шестому периоду эффективные радиусы атомов практически не изменяются. Это является следствием сжатия электронной оболочки в семействе лантоноидов, которое и компенсирует увеличение объема атома.
При отрыве электрона с внешнего уровня атома происходит уменьшение эффективного радиуса, а в случае образования отрицательного иона – увеличение. Ионные радиусы, как и атомные, являются периодической функцией заряда ядра.
ЭНЕРГИЯ ИОНИЗАЦИИ. Мы уже знаем, что отдельный атом в основном состоянии представляет собой наиболее устойчивую систему из данных частиц. Поэтому для любого изменения структуры этой системы требуется затрата энергии. Величина энергии, которая затрачивается для отрыва одного электрона от нейтрального атома в основном состоянии, называется энергией ионизации данного атома (), или ионизационным потенциалом. Эту энергию обычно относят к одному молю атомов и выражают в килоджоулях на моль или электроновольтах (эВ).
Энергия ионизации – важная характеристика атома. Она позволяет судить о том, насколько прочно связаны электроны в атоме.
В группе при увеличении порядкового номера элемента наблюдается уменьшение энергии ионизации. Оно связано с увеличением радиуса атома.
В периодах энергия ионизации атомов слева направо возрастает. Это вызвано сжатием электронной оболочки вследствие увеличения эффективного заряда ядра. Наименьшей является прочность связи
— электрона с ядром (при . Поэтому атомы щелочных металлов имеют самые низкие значения энергии ионизации. Причем, с увеличениям n их энергия ионизации понижается вследствие экранирующего действия внутренних электронов. Эта закономерность имеется и у р- элементов (за исключением ). Атомы благородных газов имеют максимальную энергию ионизации при данном .
Отрыв второго, третьего и т.д. электронов требует гораздо большей затраты энергии. Это связано с ростом заряда образующегося положительного иона. Энергия ионизации, например, для и соответственно равна 5,14эВ и 47,3эВ.
Сравнение электронных структур атомов и значений энергии ионизации позволяет заключить, что ее максимальными значениями обладают атомы с завершенными внешним слоями и , т.е. атомы благородных элементов.
СРОДСТВО К ЭЛЕКТРОНУ. В ряде случаев важно оценить способность атома присоединять электроны. Эта способность характеризуется значением энергии, которая затрачивается или выделяется при присоединении электрона к нейтральному атому в основном состоянии и называется сродством атома к электрону (). Способность атома присоединять электроны тем больше, чем больше величина его сродства к электрону. По сравнению с энергией ионизации значение сродства к электрону невелико, поскольку избыточный электрон приводит к усилению межэлектронного отталкивания и повышению энергии атомной орбитали.
Минимальное сродство к электрону наблюдается у атомов, имеющих завершенные — и — оболочки, мало оно и у атомов с конфигурацией (азот, фосфор, мышьяк).
Наибольшим сродством к электрону обладают атомы элементов подгрупп VII А, имеющие конфигурацию . Как правило, у элементов третьего периода сродство к электрону больше, чем у элементов второго периода.
Таким образом, в большинстве случаев сродство к электрону в ряду атомов изменяется в той же последовательности, что и их энергия ионизации: растет с ростом числа электронов на внешнем уровне атомов данного периода и уменьшается с ростом радиусов атомов в пределах данной группы или подгруппы.
Практическое использование всех рассмотренных характеристик ограничено тем, что они относятся к изолированным атомам. В случае неизолированных атомов часто используют эмпирическую величину, называемую ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬЮ (ЭО). Ее ввел Л.Полинг как свойство связанного атома притягивать электроны, точнее – электронную плотность. Электронная плотность смещается к тому из атомов, который имеет большую электроотрицательность. Электроотрицательность измеряется в тех же единицах, что и энергия ионизации. Она зависит от многих факторов: электронной структуры, наличия вакантных орбиталей, числа и вида соседних атомов и т.д. Поэтому для данного атома электроотрицательность не может быть постоянной. На практике используют усредненную величину.
В каждом периоде электроотрицательность растет по мере накопления электронов в атомах, т.е. слева направо. В каждой группе она убывает по мере возрастания радиусов атомов. Наибольшей электроотрицательностью обладают самые маленькие атомы с семью внешними электронами (атомы галогенов малых периодов). Наименьшая электроотрицательность у самых больших атомов с одним внешним электроном (атомы щелочных металлов больших периодов).
Однако в этих закономерностях много исключений. Таким образом, применяя эту величину, не следует ее не переоценивать.
НЕПЕРИОДИЧЕСКИЕ СВОЙСТВА. Это свойства элементов, которые с порядковым номером изменяются монотонно. К их числу относятся, например, удельная теплоемкость простых веществ, частоты линий рентгеновского спектра и др.
В заключение подчеркнем, что в периодической зависимости от заряда ядра находятся не только свойства отдельных атомов. Периодически зависят от заряда ядра атома многие свойства аналогичных по составу и структуре веществ: температуры кипения и плавления, энергии диссоциации, магнитные свойства и др.
