Какое соединение серы проявляет только восстановительные свойства

Сера
Элемент сера 16S, как и кислород 8О, находится в главной подгруппе VI группы периодической системы элементов. Однако химия серы существенно отличается от химии кислорода. Это обусловлено следующими причинами:
1. В отличие от кислорода сера проявляет и окислительные, и восстановительные свойства.
2. В отличие от кислорода, имеющего постоянную валентность II и степень окисления в соединениях -2, сера — элемент с переменной валентностью и с переменной степенью окисления.
Характеристика элемента
16S1s22s22p63s23p4
Аr = 32,066
ЭО — 2,5
Изотопы: 32S (95,084 %); 34S (4,16 %); 33S и 36S (
Кларк в земной коре 0,05 % по массе. Формы нахождения:
1) самородная сера (свободная S);
2) S2- (H2S и сульфиды металлов);
3) S+6 (сульфаты Ва и Са);
4) в составе белков, витаминов.
Сера — типичный неметалл, р-элемент. Устойчивые С.О. в соединениях -2, +4, +6.
Отличительное свойство — способность образовывать прочные гомоатомные связи-S-S-S- что приводит к существованию линейных и циклических цепей.
Важнейшие S-содержащие вещества
S-2 | S0 | S+4 | S+6 |
восстановители | окислительно — восстановительная двойственность | окислители | |
H2S сероводород CS2 — сероуглерод | S, свободная сера, большое число аллотропов | SO2 сернистый ангидрид | SO3 |
Свободная сера
Аллотропные модификации серы: ромбическая — S8. Твердое кристаллическое вещество ли монно-желтого цвета; нерастворимо в воде, хорошо растворимо в сероуглероде, ацетоне, бензоле.
Моноклинная — S8. Существует при температуре около 950С. Отличается от ромбической взаимной ориентацией октаэдров в кристаллической решетке.
Пластическая. Длинные зигзагообразные цепи.
Получение серы
1. Извлечение самородной серы из ее месторождений
2. Переработка природных газов, содержащих H2S (окисление при недостатке О2).
3. В лаборатории серу получают взаимодействием SО2 и H2S в водном растворе:
SО2 + 2H2S = 3S↓ + 2H2О
Химические свойства серы
При обычной температуре твердофазная сера малореакционноспособна. Однако при нагревании, и особенно в расплавленном состоянии, сера ведет себя как очень химически активное вещество
Сера — окислитель:
S + 2e- = S2-
Для завершения октета на внешнем слое атомы серы принимают недостающие 2 электрона и в состоянии S2- образуют ионные и ковалентные связи с водородом, металлами и некоторыми неметаллами.
1) Сера непосредственно соединяется с большинством Me (кроме Pt, Au), образуя сульфиды. С некоторыми Me реакция протекает при обычной температуре, например:
S + Сu = CuS
S + 2Ag = Ag2S
S + Hg = HgS
С железом и многими другими Me сера реагирует при нагревании:
S + Fe = FeS
S + Н2 = H2S сероводород
2S + С = CS2 сероуглерод
3S + 2Р = P2S3 сульфид фосфора (III)
Сера — восстановитель:
S — 4e- = S+4; S — 6e- = S+6
В соединениях с более ЭО элементами атомы серы находятся в положительно заряженном состоянии.
Непосредственно сера не взаимодействует с азотом и йодом.
Практически важными являются реакции соединения серы с кислородом. При обычных условиях сера горит на воздухе, окисляясь кислородом до диоксида серы:
S + O2 = SO2
Высший оксид SO3 образуется при окислении серы или SO2 кислородом в присутствии катализаторов:
2S + 3O2 = 2SO3 триоксид серы (оксид серы (VI)).
Сера непосредственно соединяется с фтором (при обычной температуре) и с хлором (расплавленная сера):
S + 3F2 = SF6 гексафторид серы
2S + Cl2 = S2CI2 дитиодихлорид серы
S2Cl2 + Cl2 = 2SCI2 дихлорид серы
Сильные окислители (HNO3, H2SO4 конц., К2Сr2O7 и др.) окисляют свободную серу до SO2 или H2SO4:
S + 2HNO3(разб.) = H2SO4 + 2NO↑
S + 6HNO3(конц.) = H2SO4 + 6NO2↑ + 2Н2O
S + 2H2SO4(конц.) = 3SO2↑ + 2Н2O
S + К2Сr2O7 = Сr2O3 + K2SO4
Диспропорционирование серы в растворах щелочей
3S+ 6NaOH = 2Na2S + Na2SO3 + 3Н2O
2. Химические свойства соединений серы с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки ЕГЭ, но также являются полезными.
Правило 2.1. Соединения S+4 преимущественно проявляют восстановительные свойства при взаимодействии с большинством окислителей, т.е. довольно легко окисляются до S+6 :
С такими окислителями как кислород, пероксид водорода и оксиды азота:
2SO2 + O2 → 2SO3 (t, kt = V2O5)
SO2 + H2O2 → H2SO4
С солями Fe+3 и Cu+2:
SO2 + 2FeCl3 + 2H2O → 2FeCl2 + H2SO4 + 2HCl
SO2 + 2CuCl2 + 2H2O → 2CuCl + H2SO4+ 2HCl
С растворами галогенов (кроме F2):
SO2 + Cl2 + H2O → H2SO4 + 2HCl
SO2 + Br2 + H2O → H2SO4 + 2HBr
SO2 + I2 + H2O → H2SO4 + 2HI
С раствором перманганата калия в различных средах:
5SO2 + 2KMnO4 +2H2O → 2MnSO4 + K2SO4 + 2H2SO4
SO2 + 2KMnO4 + 4KOH → 2K2MnO4 +K2SO4 + 2H2O
Примеры реакций окисления сульфита натрия до сульфата различными окислителями:
Na2SO3 + Cl2 + H2O → Na2SO4 + 2HCl
Na2SO3 + H2O2 → Na2SO4 + H2O
Na2SO3 + H2SO4(к) → Na2SO4 + SO2 + H2O
5Na2SO3 + 2KMnO4 + 3H2SO4 → 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
3Na2SO3 + 2KMnO4 + H2O → 2Na2SO4 + 2MnO2 + 2KOH
Na2SO3 + 2KMnO4 + 2KOH → Na2SO4 + 2K2MnO4 + H2O
3Na2SO3 + K2Cr2O7 + 4H2SO4 → 3Na2SO4 + Cr2(SO4)3 + K2SO4 + 4H2O
3Na2SO3 + K2Cr2O7 + 4H2O → 3Na2SO4 + 2Cr(OH)3 + 2KOH
Только очень сильными восстановителями S+4 восстанавливается до S0:
SO2 + 2H2S → 3S + 2H2O
SO2 + 2C → S + 2CO2
SO2 + 4HI → S + 2I2 + 2H2O
SO2 + 2CO → S + 2CO2 (Al2O3, 500°C)
Серная кислота (конц.)
Правило 2.2.
- При взаимодействии H2SO4(к) со слабыми восстановителями (неметаллами: S, P, C, средне- и малоактивными металлами: Fe, Cu, Ag, сложными веществами: H2S, сульфидами металлов, солями Fe2+ и т.д.) образуются SO2 и H2O.
- При взаимодействии H2SO4(к) с сильными восстановителями (активными металлами: Li-Zn, некоторыми сложными веществами: HI, KI) образуются H2S или S.
4Zn + 5H2SO4(конц.) → 4ZnSO4 + H2S + 4H2O (возможно образование SO2 и S, так как Zn — хороший восстановитель)
+ 4H2O (возможно образование SO2 и S, так как Zn — хороший восстановитель)
2Fe + 6H2SO4(конц.) → Fe2(SO4)3 + 3SO2 + 6H2O (только при нагревании)
+ 6H2O (только при нагревании)
Al, Cr, Fe пассивируются холодной концентрированной серной кислотой (т.е. покрываются оксидной пленкой, препятствующей дальнейшей реакции). Реакции идут только при нагревании.
C + H2SO4(конц.) → CO2 + 2SO2 + 2H2O (t)
+ 2H2O (t)
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
+ 2H2O (t)
2P + 5H2SO4(конц.) → 2H3PO4 + 5SO2 + 2H2O (t)
+ 2H2O (t)
Из галогеноводородов концентрированная серная кислота может окислить только ионы Br– и I– :
HF + H2SO4(конц.) → реакция не идет
HCl + H2SO4(конц.) → реакция не идет
2HBr + H2SO4(конц.) → Br2 + SO2 + 2H2O
+ 2H2O
8HI + H2SO4(конц.) → 4I2 + H2S + 4H2O
+ 4H2O
2CuI + 4H2SO4(конц.) → 2CuSO4 + I2 + 2SO2 + 4H2O
+ 4H2O
2CrCl2 + 4H2SO4(конц.) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
+ 4HCl + 2H2O
Соли меди восстанавливают кислоту до SO2, тогда как соли активных металлов до H2S:
2CuI + 4H2SO4(конц.) → 2CuSO4 + I2 + 2SO2 + 4H2O
+ 4H2O
8KI + 5H2SO4(конц.) → 4K2SO4 + 4I2 + H2S + 4H2O
+ 4H2O
Примеры реакций с солями (окисляем анион):
4H2SO4(конц., гор.) + CuS → CuSO4 + 4SO2 + 4H2O
+ 4H2O
Примеры реакций с солями (окисляем катион):
2H2SO4(к) + 2FeSO4 → Fe2(SO4)3 + SO2 + 2H2O
+ 2H2O
4H2SO4 + 2CrCl2 → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
+ 4HCl + 2H2O
Правило 2.3. Окисление соединений S–2 до S+6 происходит под действием следующих окислителей: H2O2, Cl2(водн.), HNO3(конц.):
H2S + Cl2 + 4H2O → H2SO4 + 8HCl
PbS + 4H2O2 → PbSO4 + 4H2O (черный сульфид свинца превращается в белый сульфат)
H2S + 8HNO3(конц.) → H2SO4 + 8NO2 + 4H2O (образование S будет считаться ошибкой!)
+ 4H2O (образование S будет считаться ошибкой!)
CuS + 8HNO3(конц., гор.) → CuSO4 + 8NO2 + 4H2O
Na2S + 8HNO3(конц, гор.) → Na2SO4 + 8NO2 + 4H2O
С H2SO4(к) при нагревании сероводород и сульфиды реагируют с образованием SO2, аналогично реакции кислоты с серой:
S + H2SO4(конц.) → 3SO2 + 2H2O (t)
+ 2H2O (t)
H2S + 3H2SO4(конц.) → 4SO2 + 4H2O (t)
+ 4H2O (t)
CuS + 4H2SO4(конц., гор.) → CuSO4 + 4SO2 + 4H2O
+ 4H2O
K2S + 4H2SO4(конц.) → K2SO4 + 4SO2 + 4H2O
+ 4H2O
В этой реакции сульфид-ион окисляется до SO2: S–2 -6e → S+4.
Часть сульфат-ионов восстанавливается также до SO2 и часть остается для образования соли K2SO4.
Без нагревания возможна реакция:
K2S + 2H2SO4 → S + SO2
+ SO2 + K2SO4 + 2H2O
+ K2SO4 + 2H2O
Источник: лекция на youtube.com от разработчиков экзамена «Методические рекомендации по подготовке ЕГЭ по химии», время 49:52.
Правило 2.4. Сера в степени окисления -2 может быть окислена до простого вещества галогенами (Cl2, Br2, I2) или солями Fe+3, Mn+7 и Cr+6 :
1. Реакции с Cl2, Br2 и I2:
H2S + Cl2 (газ) → S + 2HCl
H2S + Br2 → S + 2HBr
H2S + I2 → S + 2HI
2. Реакции с солями Fe+3, Mn+7 и Cr+6:
3H2S + 2FeCl3 → S + 2FeCl2 + 2HCl
5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 + 8H2O
3H2S + 2KMnO4 → 3S + 2MnO2 + 2KOH + 2H2O
3H2S + 2KMnO4 + 2CO2 → 3S + 2MnO2 + 2KHCO3 + 2H2O
3H2S + K2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 7H2O
3H2S + 2K2CrO4 + 2H2O → 3S + 2Cr(OH)3 + 4KOH
3H2S + 2HMnO → 3S + 2MnO2+ 4H2O
3K2S + 2KMnO4 + 4H2O → 3S + 2MnO2 + 8KOH
3H2S + Na2Cr2O7 + 4H2SO4 → 3S + Cr2(SO4)3 + Na2SO4 + 7H2O
3Na2S + K2Cr2O7 + 7H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 7H2O
3(NH4)2S + K2Cr2O7 + 7H2SO4 → 3S + Cr2(SO4)3 + K2SO4 + 3(NH4)2SO4 + 7H2O.
Согласно разработчикам экзамена (Вебинар «Методические рекомендации по подготовке к ЕГЭ по химии от разработчиков«, время 33:41, ссылка естьв разделе «О проекте»), окисление сульфид-ионов протекает с образованием S0, но образование сульфат-иона (в реакциях с такими сильными окислителями, как KMnO4, K2Cr2O7) также будет засчитано как правильный ответ.
Глава 4. Обобщение знаний по химии за курс основной школы. Подготовка к ГИА
Окислительно-восстановительными реакциями (ОВР) называют реакции, в ходе которых происходит изменение степеней окисления элементов, образующих реагирующие вещества.
Окислитель — вещество (элемент в составе этого вещества), принимающее электроны. Само оно при этом восстанавливается.
Восстановитель — вещество (элемент в составе этого вещества), отдающее электроны. Само оно при этом окисляется.
Примеры тестовых заданий и рекомендации к их выполнению
1. Веществом, которое за счёт аниона проявляет только восстановительные свойства, является
1)H2SO4 2) SO2 3) Na2SO3 4) H2S
Восстановителем является та частица, в которой элемент имеет наименьшее значение степени окисления. Так как все анионы веществ, данных в вариантах ответов, образованы серой, то наименьшее значение степени окисления равно -2 (сера — элемент VI группы, и её атому недостаёт до завершения внешнего слоя именно двух электронов). Это значение степени окисления имеет сера в сероводороде. Ответ: 4.
2. Хлор проявляет только восстановительные свойства в соединении, формула которого
1)КСlO 2) КСlO4 3)Сl2O7 4) НСl
Данное задание выполняется по аналогии с предыдущим. Ответ: 4.
3. Процессу восстановления соответствует схема

Достаточно сложное задание, однако эту сложность легко преодолеть, используя логику. Так как процесс восстановления — это понижение степени окисления, то сразу следует исключить ответ 3 и обратить внимание на ответ 4, поскольку сера изменила степень окисления. Определив значение этого изменения с 0 до -2, можно сделать вывод, что именно ответ 4 является верным. В этом случае не нужно будет испытывать затруднений и тратить время для определения степеней окисления в катионе аммония и в сульфит-анионе. Ответ: 4.
4. Элемент бром является восстановителем в реакции, уравнение которой
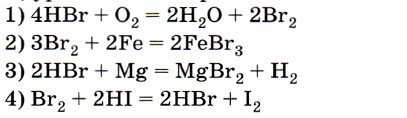
Ответы 2 и 3 из претендентов на верный ответ следует сразу исключить, так как металлы (простые вещества) проявляют только восстановительные свойства. Анализ изменения степени окисления брома для первого уравнения (от -1 до 0) позволяет сделать вывод, что этот ответ является верным. Ответ: 1.
5. Азот в аммиаке проявляет восстановительные свойства в реакции, уравнение которой
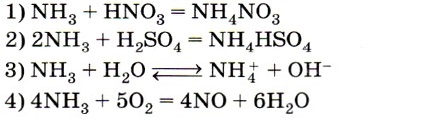
Следует знать, что в аммиаке и ионе аммония азот имеет одинаковую степень окисления -3, поэтому из числа возможных верных ответов исключаются ответы 1,2 и 3. В ответе 4 азот повышает свою степень окисления с -3 в аммиаке до +2 в оксиде азота (II). Ответ: 4.
6. Схеме превращения  соответствует схема
соответствует схема
реакции
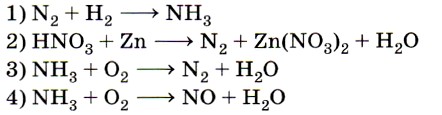
Отправной точкой для нахождения верного ответа служит  в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3.
в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3.
7. Изменению степени окисления
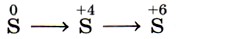
соответствует схема превращений

Так как во всех четырёх вариантах первое звено представлено простым веществом — серой, все они соответствуют первому звену искомой схемы. Следовательно, анализируются вторые звенья на предмет нахождения соединений серы в степени окисления +4. Это варианты 1 и 4. Третье звено (сера в степени окисления +6) содержится в варианте 4. Это и есть верный ответ. Ответ: 4.
Возможный равноценный вариант поиска верного ответа мог быть основан на определении последних звеньев, в которых записаны соединения серы в степени окисления +6. Это варианты ответов 2 и 4. Анализ вторых звеньев данных вариантов на предмет нахождения соединений серы в степени окисления +4 также позволяет определить верный ответ. Ответ: 4.
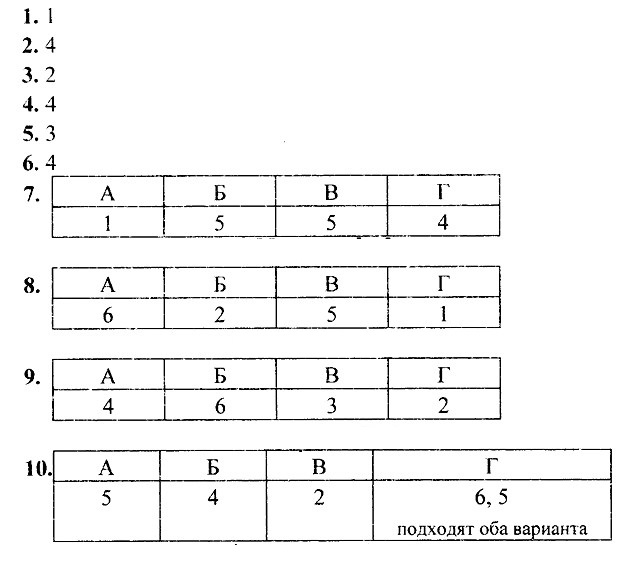
8. Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).
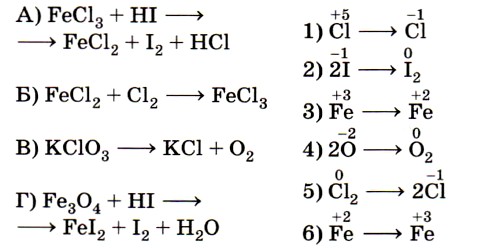
Ключевыми словами для выполнения этого задания являются «изменение степени окисления окислителя», т. е. элемента, понижающего значение степени окисления. Это позволит исключить из правого столбика процессы с участием восстановителей (отдачи электронов) — 2, 4 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степени окисления окислителей. Схеме А, в которой степень окисления железа +3, соответствует процесс 3; схеме Б, в которой хлор имеет степень окисления 0, соответствует процесс 5; схеме В, в которой хлор имеет степень окисления +5, соответствует процесс 1.
Некоторые сложности вызовет схема Г, так как железо в железной окалине (Fe3O4) имеет два значения степени окисления: +2 и +3 (FeO • Fe2O3) и именно железо в степени окисления +3 является окислителем (соответствие Г — 3). Ответ: 3513.
9. Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).

Ключевыми словами для выполнения этого задания являются «изменение степени окисления восстановителя», т. е. элемента, отдающего электроны и соответственно повышающего свою степень окисления. Это позволит исключить из правого столбика процессы с участием окислителей (принятия электронов)— 1, 5 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степеней окисления восстановителей. Схеме А, в которой степень окисления иода 0, соответствует процесс 2; схеме Б, в которой азот катиона аммония имеет степень окисления -3, соответствует процесс 3.
Некоторые сложности вызовут схемы В и Г, так как это реакции диспропорционирования, в которых один и тот же элемент выступает как в роли окислителя, так и в роли восстановителя. Однако выполнение этого задания ограничено рамками его условия. Для схемы В из двух вариантов происходящих изменений степени окисления иода выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие В— 2). Аналогично для схемы Г из двух вариантов происходящих изменений степени окисления азота выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие Г —4). Ответ: 2324.
10. Установите соответствие между схемой превращения элемента (левый столбец) и уравнением ОВР (правый столбец).
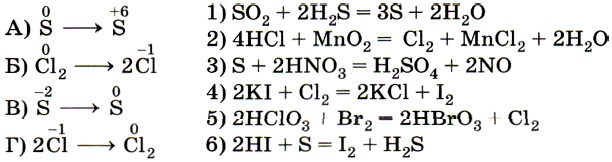
Превращению А в качестве продуктов реакции соответствуют соединения серы в форме сульфат-иона 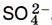 . Следовательно, этому превращению соответствует уравнение 3.
. Следовательно, этому превращению соответствует уравнение 3.
Превращению Б в качестве продуктов реакции соответствуют соединения хлора в форме хлорид-иона — Сl-. Следовательно, этому превращению соответствует уравнение 4.
Легко установить соответствие В — 1, так как свободная сера указана только в одном из приведённых уравнений.
Аналогично устанавливается соответствие Г — 2, так как хлор в степени окисления -1 указан в левой части только одного из приведённых уравнений. Ответ: 3412.

1. Не является окислительно-восстановительной реакция, схема которой
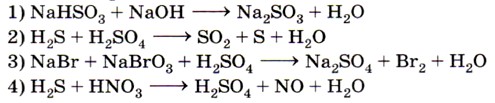
2. Только восстановительные свойства проявляет вещество, формула которого
1)SO2 2) НСl 3)Н2 4) Na2S
3. Только окислительные свойства проявляет вещество, формула которого
1)I2 2) F2 3)Н2 4)N2
4. Соляная кислота выполняет роль восстановителя в реакции, уравнение которой
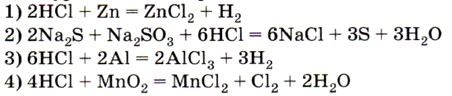
5. Процессу последовательного восстановления соответствует цепочка
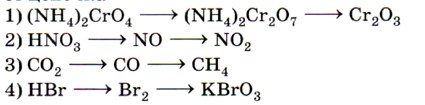
6. Пероксид водорода проявляет окислительные свойства в реакции, схема которой
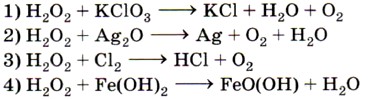
7. Установите соответствие между формулой вещества (левый столбец) и степенью окисления фосфора в нём (правый столбец).
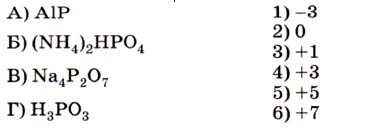
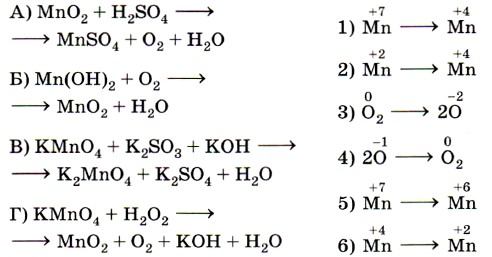
8. Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).
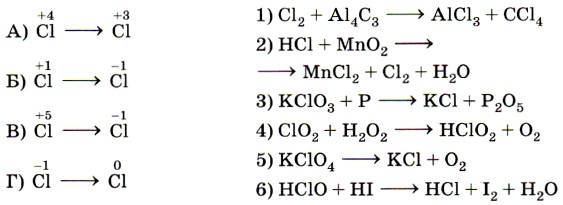
9. Установите соответствие между изменением степени окисления хлора (левый столбец) и схемой реакции (правый столбец).
10. Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).
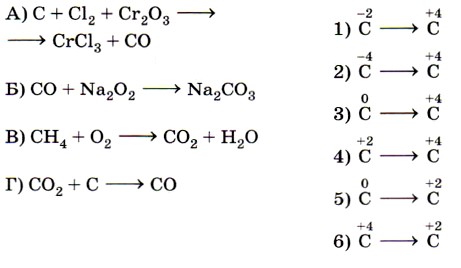
Окислительно-восстановительные реакции. Ответы
Химия
9 класс
Обязательный минимум знаний
Окислительно-восстановительными реакциями (ОВР) называют реакции, в ходе которых происходит изменение степеней окисления элементов, образующих реагирующие вещества.
Окислитель — вещество (элемент в составе этого вещества), принимающее электроны. Само оно при этом восстанавливается.
Восстановитель — вещество (элемент в составе этого вещества), отдающее электроны. Само оно при этом окисляется.
Примеры тестовых заданий и рекомендации к их выполнению
- Веществом, которое за счёт аниона проявляет только восстановительные свойства, является
- H2SO4
- SO2
- Na2SO3
- H2S
Восстановителем является та частица, в которой элемент имеет наименьшее значение степени окисления. Так как все анионы веществ, данных в вариантах ответов, образованы серой, то наименьшее значение степени окисления равно -2 (сера — элемент VI группы, и её атому недостаёт до завершения внешнего слоя именно двух электронов). Это значение степени окисления имеет сера в сероводороде. Ответ: 4.
- Хлор проявляет только восстановительные свойства в соединении, формула которого
- КСlO
- КСlO4
- Сl2O7
- НСl
Данное задание выполняется по аналогии с предыдущим. Ответ: 4.
- Процессу восстановления соответствует схема
- SO2 → SO2-3
- NH3 → NH+4
- Zn0 → Zn2+
- S → H2S
Достаточно сложное задание, однако эту сложность легко преодолеть, используя логику. Так как процесс восстановления — это понижение степени окисления, то сразу следует исключить ответ 3 и обратить внимание на ответ 4, поскольку сера изменила степень окисления. Определив значение этого изменения с 0 до -2, можно сделать вывод, что именно ответ 4 является верным. В этом случае не нужно будет испытывать затруднений и тратить время для определения степеней окисления в катионе аммония и в сульфит-анионе. Ответ: 4.
- Элемент бром является восстановителем в реакции, уравнение которой
- 4НВr + O2 = 2Н2O + 2Вr2
- 3Br2 + 2Fe = 2FeBr3
- 2HBr + Mg = MgBr2 + H2
- Br2 + 2HI = 2HBr + I2
Ответы 2 и 3 из претендентов на верный ответ следует сразу исключить, так как металлы (простые вещества) проявляют только восстановительные свойства. Анализ изменения степени окисления брома для первого уравнения (от -1 до 0) позволяет сделать вывод, что этот ответ является верным. Ответ: 1.
- Азот в аммиаке проявляет восстановительные свойства в реакции, уравнение которой


Следует знать, что в аммиаке и ионе аммония азот имеет одинаковую степень окисления -3, поэтому из числа возможных верных ответов исключаются ответы 1, 2 и 3. В ответе 4 азот повышает свою степень окисления с -3 в аммиаке до +2 в оксиде азота (II). Ответ: 4.
- Схеме превращения
 соответствует схема реакции
соответствует схема реакции
Отправной точкой для нахождения верного ответа служит
 в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3.
в исходной схеме. Знание того, что атомы в простых веществах имеют степень окисления, равную 0, позволяет исключить ответы 1 и 4. Из двух оставшихся сразу же выбирается ответ 3, так как именно в аммиаке азот имеет степень окисления -3. Ответ: 3. - Изменению степени окисления

соответствует схема превращений

Так как во всех четырёх вариантах первое звено представлено простым веществом — серой, все они соответствуют первому звену искомой схемы. Следовательно, анализируются вторые звенья на предмет нахождения соединений серы в степени окисления +4. Это варианты 1 и 4. Третье звено (сера в степени окисления +6) содержится в варианте 4. Это и есть верный ответ. Ответ: 4.
Возможный равноценный вариант поиска верного ответа мог быть основан на определении последних звеньев, в которых записаны соединения серы в степени окисления +6. Это варианты ответов 2 и 4. Анализ вторых звеньев данных вариантов на предмет нахождения соединений серы в степени окисления +4 также позволяет определить верный ответ. Ответ: 4.
- Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).

«изменение степени окисления окислителя», т. е. элемента, понижающего значение степени окисления. Это позволит исключить из правого столбика процессы с участием восстановителей (отдачи электронов) — 2, 4 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степени окисления окислителей. Схеме А, в которой степень окисления железа +3, соответствует процесс 3; схеме Б, в которой хлор имеет степень окисления 0, соответствует процесс 5; схеме В, в которой хлор имеет степень окисления +5, соответствует процесс 1.
Некоторые сложности вызовет схема Г, так как железо в железной окалине (Fe3O4) имеет два значения степени окисления: +2 и +3 (FeO • Fe2O3) и именно железо в степени окисления +3 является окислителем (соответствие Г — 3). Ответ: 3513.
- Установите соответствие между схемой химической реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).

Ключевыми словами для выполнения этого задания являются «изменение степени окисления восстановителя», т. е. элемента, отдающего электроны и соответственно повышающего свою степень окисления. Это позволит исключить из правого столбика процессы с участием окислителей (принятия электронов) — 1, 5 и 6. Остаётся установить соответствие между четырьмя схемами и тремя процессами изменения степеней окисления восстановителей. Схеме А, в которой степень окисления иода 0, соответствует процесс 2; схеме Б, в которой азот катиона аммония имеет степень окисления -3, соответствует процесс 3.
Некоторые сложности вызовут схемы В и Г, так как это реакции диспропорционирования, в которых один и тот же элемент выступает как в роли окислителя, так и в роли восстановителя. Однако выполнение этого задания ограничено рамками его условия. Для схемы В из двух вариантов происходящих изменений степени окисления иода выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие В — 2). Аналогично для схемы Г из двух вариантов происходящих изменений степени окисления азота выбирается процесс окисления, в котором он выступает в качестве восстановителя (соответствие Г —4). Ответ: 2324.
- Установите соответствие между схемой превращения элемента (левый столбец) и уравнением ОВР (правый столбец).

Превращению А в качестве продуктов реакции соответствуют соединения серы в форме сульфат-иона
 . Следовательно, этому превращению соответствует уравнение 3.
. Следовательно, этому превращению соответствует уравнение 3.Превращению Б в качестве продуктов реакции соответствуют соединения хлора в форме хлорид-иона — Сl-. Следовательно, этому превращению соответствует уравнение 4.
Легко установить соответствие В — 1, так как свободная сера указана только в одном из приведённых уравнений.
Аналогично устанавливается соответствие Г — 2, так как хлор в степени окисления -1 указан в левой части только одного из приведённых уравнений. Ответ: 3412.
Задания для самостоятельной работы
- Не является окислительно-восстановительной реакция, схема которой

- Только восстановительные свойства проявляет вещество, формула которого
- SO2
- НСl
- Н2
- Na2S
- Только окислительные свойства проявляет вещество, фор-мула которого
- I2
- F2
- Н2
- N2
- Соляная кислота выполняет роль восстановителя в реакции, уравнение которой

- Процессу последовательного восстановления соответствует цепочка

- Пероксид водорода проявляет окислительные свойства в реакции, схема которой

- Установите соответствие между формулой вещества (левый столбец) и степенью окисления фосфора в нём (правый столбец).

- Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления окислителя (правый столбец).

- Установите соответствие между изменением степени окисления хлора (левый столбец) и схемой реакции (правый столбец).

- Установите соответствие между схемой реакции (левый столбец) и изменением степени окисления восстановителя (правый столбец).

