Какое общее свойство солей аммония обусловлено


Соли аммония.
Аммоний,
NH
4+ это положительно — заряженный многоатомный ион, который образуется при протонировании (перенос протона от кислоты к основанию) аммиака (NH3).
Ион аммония образуется, когда аммиак, слабое основание, реагирует с кислотами Бренстеда (доноры протонов):
H+ + NH3 →NH4+
Однако, будучи слабокислым, реагирует с основаниями Бренстеда,
возвращаясь к незаряженной молекуле аммиака:
NH4+ + B- → OB- + NH3
Таким образом, обработка концентрированных растворов солей аммония сильным основанием дает аммиак.
Когда аммиак растворяется в воде, его небольшое количество превращается в ионы аммония:
NH3 + H2O → NH4+ + OH-
- Степень,
до которой аммиак образует ион аммония, зависит от
рН раствора:
— если pH
низкий, равновесие смещается вправо: больше молекул аммиака
превращается в ионы аммония.
— если pH высокий, равновесие сдвигается влево: ион гидроксида отнимает
протон от иона аммония, образуя аммиак.
Важно! Все соли аммония растворимы в воде, кроме гексахлороплатината аммония (раньше использовалось в качестве теста на NH4+)
Наибольшее значение среди солей аммония в промышленности имеют хлорид аммония (NH4Cl), сульфат аммония ((NH4)2SO4), нитрат аммония (NH4NO3), характеристики которых мы сегодня и пройдем.
Хлорид аммония, NH4Cl (аммиачная соль) — белое кристаллическое твердое вещество. хорошо растворим в воде (37%), образует слегка кислый раствор; испаряется без плавления при 340 ° C с образованием равных объемов аммиака и хлористого водорода.
Уровень опасности: раздражающее средство
- Его основное применение — подача азота в удобрениях и в качестве электролита в сухих элементах
- Также широко используется в качестве компонента флюсов для цинкования, лужения и пайки для удаления оксидных покрытий с металлов и, тем самым, улучшения адгезии припоев.
- Он является компонентом многих патентованных лекарств от простуды и средств от кашля благодаря своей эффективности в качестве отхаркивающего средства,
- В ветеринарной медицине его используют для профилактики мочекаменной болезни у коз, крупного рогатого скота и овец.
NH4Cl | |
Получение | 1) CO2 + 2NH3 + 2NaCl + H2O → 2NH4Cl + Na2CO3 2) NH3 + HCl → NH4Cl |
Химические свойства | 1) Разложение: NH4Cl → NH3↑ + HCl↑ 2) С неметаллами: NH4Cl + Cl2 → 4HCl + NCl3 3) С щелочами (Ме АІ): NH4Cl + NaOH →NaCl + NH3 + H2O 4) С щелочами (Ме АІІ): NH4Cl + Ca(OH)2(p)→ CaCl2 + 2NH3 + 2H2O 5) С нерастворимыми основаниями: NH4Cl + Al(OH)3, Cu(OH)2, Cr(OH)3, Fe(OH)3≠ 6) C основаниями (комплексообразующими): NH4Cl + 2Zn(OH)2(T)→ [Zn(NH3)4]Cl2 + ZnCl2 + 4H2O 7) С солями: NH4Cl + Na2S → 2NaCl + NH3 + H2S 8) С солями летучих кислот: NH4Cl + CaCO3 → CaCl2 + 2NH3 + CO2 + H2O 9) С оксидами малоактивных Ме: NH4Cl + 4MeO (T) → MeCl2 + 3Me + N2↑ + 4H2O 10) С оксидами активных Ме: NH4Cl + MeO (T) → MeCl2 + 2NH3 + H2O |
Сульфат аммония (диаммониевая соль серной кислоты) — белое, твердое вещество, без запаха, хорошо растворяется в воде (103,8 гр в 100 гр воды при 100° С), легко впитывает воду (если подвергается воздействию влажного воздуха, образует «струпья» на влажных поверхностях); температура плавления — выше 280° С; используется в процессе фракционирования (разделения) белков.
Уровень опасности: окислитель, раздражающее средство, экологически опасен
- Сульфат аммония широко распространен в качестве пищевой добавки E517 (регулятор кислотности в хлебе), благодаря активации дрожжей
- (NH4)2SO4 используется в качестве удобрения для щелочных почв (при
внесении во влажную почву выделяется
NH
4+, что создает небольшое
количество кислоты, которая снижает рН баланс почвы, а также
способствует выделению азота, который помогает росту растений)
- Наконец, он играет важную роль в разработке вакцин во время процесса очистки. Вакцина DTap, которая защищает детей от дифтерии, столбняка и коклюша, использует для этой цели сульфат аммония.
(NH4)2SO4 | |
Получение | 1) 2NH3 + H2SO4 → (NH4)2SO4 2) (NH4)2CO3 + CaSO4 → (NH4)2SO4 + CaCO3 |
Химические свойства | 1) Разложение: (NH4)2SO4 → NH3↑+ NH4HSO4 (t) 2) C солями: (NH4)2SO4 + 2NaCl → Na2SO4 + 2NH3↑ + 2HCl↑ (t) (NH4)2SO4 + Ca(NO3)2 → 2N2O + 4H2O + CaSO4 (t < 250 C) (NH4)2SO4 + Ca(NO3)2 → 2N2 + O2 + 4H2O + CaSO4 (t > 250 C) 7(NH4)2SO4 + 3Ca(NO3)2 → 8N2 + 18 H2O + 3CaSO4 + 4NH4HSO4 (t > 250 C) |
Нитрат аммония, NH4NO3 (аммиачная селитра, аммониевая соль азотной кислоты) — бесцветное кристаллическое вещество (температура плавления 169,6 ° C); хорошо растворим в воде.
Уровень опасности: окислитель (взрывчатое вещество), раздражающее вещество
- Нагревание водного раствора
разлагает соль до закиси азота (веселящий газ):
NH4NO3 = N2O + 2H2O (реакция Пристли, 190-250 С)
Поскольку твердая
аммиачная селитра может подвергаться взрывному разложению при нагревании
в замкнутом пространстве, на ее транспортировку и хранение были
наложены государственные стандарты.
- Товарный сорт содержит около 33,5% азота, причем все они находятся в формах, пригодных для использования растениями; это наиболее распространенный азотный компонент искусственных удобрений.
- Аммиачная селитра также используется для изменения скорости детонации других взрывчатых веществ, таких как нитроглицерин (в так называемых аммиачных динамитах), или в качестве окислителя в аммоналах, которые представляют собой смеси нитрата аммония и порошкообразного алюминия.
- Применяется в качестве питательного вещества при производстве антибиотиков и дрожжей.
NH4NO3 | |
Получение | 1) HNO3 + NH3 → NH4NO3 2) Ca(NO3)2 + 2NH3 + CO2 + H2O → 2NH4NO3 + CaCO3 |
Химические свойства | 1) Разложение: NH4NO3 → N2O + 2H2O (t = 190 – 240 C) 2NH4NO3 → N2↑ + 2NO↑ + 4H2O↑ (t = 250 -300 C) NH4NO3 → 2N2↑ + O2↑ + 4H2O↑ (t > 350 C, взрыв) 2) С металлами: 3NH4NO3 + 2Al→ 3N2↑ + 6H2O + Al2O3 + Q 3) С основаниями (щелочами): NH4NO3 + NaOH → NH3 + H2O + NaNO3 |
Физические свойства солей аммония
Большинство солей аммония – бесцветные твердые кристаллические вещества, хорошо растворимые в воде. По своему строению, цвету и другим свойствам они похожи на соответствующие соли натрия или калия, поскольку ионы Na+, K+ и NH4+ имеют близкие размеры.
Химические свойства солей аммония
Водный раствор аммиака представляет собой слабое основание, поэтому соли аммония гидролизуются в растворах. Растворы солей, образованных аммиаком и сильными кислотами, имеют слабокислую реакцию. Гидролиз иона аммония протекает следующим образом:
NH4+ + H2O ↔ NH4OH + H+
NH4+ + H2O ↔ NH3 + H3O+
Присутствие соли аммония в растворе можно обнаружить, нагревая соответствующий раствор, при этом происходит разложение соли – аммиак улетучивается, в чем можно убедиться по характерному резкому запаху.
Термическое разложение солей может протекать двояко – обратимо или необратимо. Соли аммония, анион которых не является окислителем или проявляет слабые окислительные свойства, распадаются обратимо. Например:
NH4Cl↔NH3↑ + HCl
Соли аммония, анион которых проявляет более резко выраженные окислительные свойства, распадаются необратимо: протекает ОВР, в ходе которой ион аммония окисляется, а анион восстанавливается. Например:
NH4NO3 = N2O↑ + 2 H2O
Взаимодействие солей аммония с кислотами и другими солями протекает по обменному механизму. Например:
(NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2 ↑
2NH4+ + CO32− + 2H+ + 2Cl− → 2NH4+ + 2Cl− + Н 2O + CO2 ↑
CO32− + 2H+ → Н2O + CO2 ↑
(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
2NH4+ + SO42− + Ba2+ + 2NO3− → BaSO4 ↓ + 2NH4+ + 2NO3−
Ba2+ + SO42− → BaSO4 ↓
Качественной реакцией на ион аммония является реакция взаимодействия солей аммония со щелочами при нагревании, в результате чего происходит выделение аммиака, что определяют по характерному резкому запаху (запах «нашатырного спирта»):
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
Важнейшие представители
К важнейшим представителям солей аммония относятся сульфат, нитрат и хлорид аммония.
Сульфат аммония ((NH4)2SO4) — бесцветные прозрачные кристаллы (или белый порошок) без запаха. Его получают путем действия серной кислоты на раствор аммиака и по обменной реакции между другими солями:
2NH3 + H2SO4 = (NH4)2SO4
Сульфат аммония нашел широкое применение в качестве минерального удобрения, используется в производстве вискозы, в пищевой промышленности и т.д.
Нитрат аммония (NH4NO3) – кристаллическое вещество белого цвета. В промышленных масштабах нитрат аммония получают действие концентрированной азотной кислоты на безводный аммиак:
NH3 + HNO3 = NH4NO3
Нитрат аммония применяют в качестве минерального удобрения – содержание азота в нем выше, чем в других используемых удобрениях. Он образует взрывчатые смеси с горючими веществами (аммоналы), поэтому его используют для взрывных работ.
Хлорид аммония (нашатырь) (NH4Cl) представляет собой белый кристаллический порошок без запаха. Основной промышленный способ получения хлорида аммония — упаривание маточного раствора, остающегося после отделения гидрокарбоната натрия после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия:
NH3 + H2O + CO2 + NaCl = NaHCO3 + NH4Cl
Хлорид аммония используется в красильном деле, в ситцепечатании, при паянии и лужении, а также, в гальванических элементах.
Примеры решения задач
Аммоний – одно из многочисленных соединений азота. Его соли обладают рядом интересных свойств и находят практическое применение во многих областях человеческой деятельности. Исследованием свойств этого элемента занимается химия. Соли аммония изучаются в разделе исследования взаимодействий азота с другими химическими элементами.

Что такое аммоний
Чтобы узнать, что такое аммоний, следует более внимательно ознакомиться с принципом соединения азота и атомов углерода. Молекула аммиака записывается в виде NH3. Атом азота связан своими ковалентными связями с тремя протонами. Вследствие внутренней структуры азота одна связь остается нераспределенной.
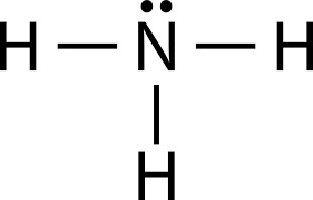
Поэтому NH3 активно вступает в различные ковалентные связи с другими элементами, задействуя нераспределенную электронную пару. Если в соединение вступает ядро водорода, то образуется ион аммония. Схема реакции приведена ниже:
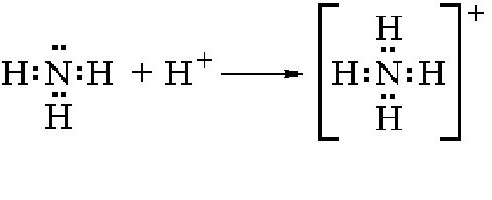
Как можно видеть, в данной реакции молекула аммиака является акцептором одного протона и тем самым ведет себя как основание. Аммоний в свободном виде не существует, так как практически мгновенно распадается на водород и аммиак. Соли аммония получаются в результате взаимодействия этого элемента с другими веществами. Как показывают практические опыты, аммоний вступает в различные соединения с кислотами, нейтрализуя их и образовывая соли аммония. Например, в случае вступления в реакцию с соляной кислотой происходит образование одной из солей этого элемента:
NH3 + HCl = NH4Cl
В результате реакции получается хлорид соли аммония.
Взаимодействие с водой
Аммоний хорошо взаимодействует с водой. В итоге реакции получаются гидраты аммиака усиленной концентрацией ОН-. Химическая запись реакции:
NH3 + H2O → NH4 + OH-
Поскольку количество ионов гидроксогруппы чрезвычайно велико, то водные растворы аммиака обладают щелочной реакцией. Однако по старой химической привычке водный раствор аммиака записывают, как NH4OH. Данное вещество называется гидроксидом аммония, а щелочную реакцию этого соединения рассматривают в виде диссоциации молекул, на которые раскладывается аммиак.
Соли аммония. Свойства и основные характеристики
Большая часть солей NH4 практически бесцветны и довольно хорошо растворяются в воде. Данное соединение обладает многими свойствами металлов, поэтому и соли аммония ведут себя так же, как и соли различных металлов. Вот несколько примеров такого подобия:
— Соли NH4 являются хорошими электролитами. Они подвергаются гидролизу в различных растворах. Эту реакцию можно проследить на примере диссоциации хлорида аммония:
NH4Cl= NH4++ HCl-
— Подвержены гидролизу. В результате получается реакция соли слабого основания и сильной кислоты:
— имеют ионную кристаллическую решетку, обладают электропроводимостью;
— не выдерживают высоких температур и распадаются на составляющие.
Необратимые и обратимые процессы
Распад солей аммония под воздействием температур может быть необратим, либо же представлять собой обратимый процесс. Если анион соли проявляет несильные свойства окислителя, соли распадается обратимо. Классическим примером такой реакции является хлорид аммония: при повышении температуры реакции он в конце концов распадается на собственные исходные элементы — хлористый водород, а также аммиак. Если стенки сосуда не прогревать, на них появляется налет. Так генерируется хлорид аммония.
Другие соли этого элемента, анион в которых имеет ярко выраженные свойства окислителя, распадаются безвозвратно. Стандартным примером такой реакции может служить распад нитрата аммония, который выглядит следующим образом:
NH4NO3 = N2O ↑+ H2O
Поскольку один из продуктов взаимодействия покидает ее поле, реакция прекращается.
Применение аммиака и солей аммония
Весомая доля аммиака, добываемого промышленным путем, идет на применение его в установках для заморозки и охлаждения. Находят соли аммония применение в повседневной жизни и в медицине. Но подавляющая часть аммиака идет на изготовление азотной кислоты и разнообразных азотсодержащих соединений, прежде всего, различных минеральных удобрений.
Азотистые удобрения
Наиболее известные соли производной азота, применение которых в хозяйственной деятельности крайне важно – это сульфат аммония, нитрат аммония, хлорид аммония. Азот – необходимая составляющая часть белков. Этот элемент является обязательным для существования любого живого организма. Растения извлекают азот из плодородного грунта, где этот элемент находится преимущественно в связанном виде. Обычно азот встречается, как соли аммония и соединения азотной кислоты. Растворяясь во влажной почве, эти неорганические соединения попадают в организмы растений и перерабатываются ими в различные белки и аминокислоты. Животные и люди не могут усваивать азот ни в свободном виде, ни в качестве его простых соединений. Для питания и роста им необходим белок, составной частью которого обязательно является азот. Только при участии растений мы получаем столь необходимый нам элемент для жизни и здоровья.

Почвы в естественной среде содержат незначительное количество азота. После сбора каждого урожая вместе с растениями уносится и то малое количество азота, которое прежде находилось в земле. Чтобы ускорить процесс регенерации почвы, и применяются азотистые удобрения.
Сульфат аммония. Формула этого соединения — (NH4)2SO4. Эта соль аммония служит основой для множества удобрений.
Нитрат аммония. Формула этого вещества — NH4NO3. Это также известное удобрение, которое хорошо усваивается растениями. Кроме сельскохозяйственного применения, нитрат аммония используется в военной и горнодобывающей отрасли – на его основе изготавливаются взрывчатые смеси (аммоналы), применяемые для подрывных работ.

Нашатырь
Хлорид аммония. Хорошо известен, как нашатырь. Его химическая формула — NH4Cl. Это соединение хорошо известно в производстве лакокрасочной продукции, в текстильном деле, используется нашатырь и в гальванических элементах. Хорошо известен хлорид аммония пайщикам и лудильщикам. В своей работе они часто задействуют хлористые соли аммония. Применение этого вещества помогает удалить с поверхности металлов тончайшие оксидные пленки. Прикосновение разогретого металла к нашатырю вызывает соответствующую реакцию оксидов – они либо переходят в хлориды, либо восстанавливаются. Хлориды быстро улетучиваются с поверхности металла. Процесс реакции для меди может быть записан следующим образом:
4CuO + 2 NH4Cl = 3Cu + 2CuCl2 + N2 +4H2O.
Аммиак в жидком виде и крепкие растворы солей аммония также применяются в качестве азотных удобрений – содержание азота в них выше, чем в твердых удобрениях, и усваивается растениями он лучше.
Тема 2 9 класс
Урок 34
Тема урока: Соли аммония.
Цели урока: образовательные – изучить состав солей аммония, повторить общие химические свойства солей на примере солей аммония, раскрыть специфические свойства этих солей, обусловленные ионом аммония; изучить практическое применение солей аммония; углубить основные химические понятия: вещество, химическая реакция; изучить практическое значение солей аммония.
развивающие – развивать у учащихся умение сравнивать, анализировать и применять информацию из других областей знаний, развивать коммуникативные способности, умение предъявлять результаты групповой деятельности;
воспитательные – способствовать воспитанию экологической грамотности у учащихся, активной жизненной позиции.
Тип урока: изучение нового материала.
Методы обучения: частично-поисковый, наглядный, самостоятельная работа с учебником, работа в парах.
Формы организации познавательной деятельности: групповая, фронтальная, практическая.
Технические средства обучения: компьютер, проектор, экран
Методы работы: самостоятельная работа с учебником, работа в парах.
Оборудование и реактивы: растворы — хлорида бария, гидроксида натрия, соляная кислота, карбонат аммония, хлорид аммония, сульфат аммония стакан с водой; гидроксид аммония, азотная кислота, сульфат аммония, хлорид аммония, карбонат аммония, нитрат серебра, нитрат калия, соляная кислота, гидроксид натрия;
пробирки, штатив для пробирок, спиртовка, ватка, пробиркодержатель, фенолфталеиновая бумажка.
ХОД УРОКА: 1.Организационная часть урока.
2. Проверка знаний учащихся.
Вопросы и задания опроса.
1.Задача: К 400г раствора с массовой долей хлорида аммония 8% прибавили избыток гидроксида кальция. Определите объём выделившегося газа».
2. Вопросы: 1.Строение молекулы аммиака.
2.Перечислите физические свойства аммиака.
3.Химические свойства аммиака.
4. Перечислите области применения аммиака.
3. Задание «третий лишний»
К3РО4, HCL, H2SO4
Ba (OH)2, NaNO3 , NaOH
K2O, CO2, MgSO4
4.Тест (1 вариант – азот, 2 вариант – аммиак)
1.Газообразный при обычных условиях
2.Не имеет запаха
3.Бесцветный
4.В воде малорастворим
5.Степень окисления азота -3
6.В воздухе не горит
7.Горит в кислороде
8.Взаимодействует с кислотами с образованием солей
9.В молекуле между атомами ковалентная полярная связь
10.Взаимоотношение с водородом в присутствии катализатора
11.Он является важнейшим биогенным элементом.
12.Водный раствор имеет щелочную среду
13.Он проявляет преимущественно восстановительные свойства
14.10%-ный раствор его называется нашатырным спиртом
(Обмениваемся тетрадями, проверяем).
азот
аммиак
1, 2, 3, 4, 6, 10, 11, 13
1, 3, 5, 7, 8, 9, 12, 13
3. Изучение программного материала.
1. Соли аммония —это сложные вещества, содержащие в своем составе ионы аммония, соединённые с кислотными остатками.
Аммония соли — соли, содержащие одновалентный ион аммония NH4+; по строению, цвету и другим свойствам они похожи на соответствующие соли калия. Все соли Аммония растворимы в воде, полностью диссоциируют в водном растворе. Соли Аммония проявляют общие свойства солей. При действии щелочи выделяется газообразный NH3. Все соли Аммония при нагревании разлагаются. Получают их при взаимодействии NH3 или NH4OH с кислотами. Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов, сульфат аммония (NH4)2SO4 применяется как дешевое азотное удобрение, бикарбонат аммония NH4HCO3и карбонат аммония (NH4)2СО3 применяют в пищевой промышленности, при крашении тканей, в производстве витаминов, в медицине; хлорид аммония (нашатырь) NH4Cl применяется в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии.
2. Общая формула солей аммония.
NH4R; (NH4)nR, где R— кислотный остаток.
— В NH4CL есть катион аммония

3. Физические свойства солей аммония.
Соли аммония – твердые, кристаллические вещества, хорошо растворимы в воде.
4. Химические свойства солей аммония.
Свойства общие с другими солями
Специфические свойства
1.Сильные электролиты
NH4NО3= NH4 ++NО3 —
2.Реагируют с кислотами — реакция обмена
(NH4)2СO3+2HCl=2NH4Cl+CO2+H2O
3.Реагируют с другими солями
(NH4)2SO4+BaCl2=2NH4Cl+Ba SO4
4.Подвергаются гидролизу
NH4Cl+H2O.
Это соль слабого основания и сильной кислоты. Цепочка рвется по слабому звену. Гидролиз идет по катиону аммония.
1.При высокой температуре разлагаются
а) если кислота летучая
NH4Cl= NH3+HCl
NH4HCO3 → NH3 + Н2O + CO2
б) если кислота нелетучая
(NH4)2SO4= ?
в) если кислота нелетучая и анион проявляет окислительные свойства
(NH4)2 Cr2O7 = Cr2O3 + N2 + 4H2O
NH4NO3 = N2O + 2Н2O
2.Реагируют с щелочами
NH4Cl+NaOH= NaCl + NH3 + Н2O
Это качественная реакция на соли аммония.
3. С кислотами и солями (реакция обмена)
a) (NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2
2NH4+ + CO32- + 2H+ + 2Cl- → 2NH4+ + 2Cl- + Н2O + CO2
CO32- + 2H+ → Н2O + CO2
б) (NH4)2SO4 + Ba(NO3)2 → BaSO4 + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3- → BaSO4 + 2NH4+ + 2NO3-
Ba2+ + SO42- → BaSO4
4. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O → NH4OH + HCl
NH4+ + Н2O → NH4OH + H+
5. Сильные электролиты (диссоциируют в водных растворах)
NH4Cl → NH4+ + Cl-
ВЫВОД:1) Соли аммония – это электролиты, которые диссоциируют на катион аммония NH4+ и анионы кислотного остатка.
2) Они проявляют свойства:
а) Общие с солями- взаимодействуют с кислотами, солями, если образуется осадок или газ.
б) Специфические – взаимодействуют с щелочами с образованием аммиака, при нагревании разлагаются, хорошо растворимы в воде и являются электролитами, при гидролизе показывают кислотную среду или гидролиз идет полностью.
Это интересно:
Название «аммоний» предложил в 1808г. Гемфри Дэви. Латинское слово аммониум когда-то означало «соль из Аммонии». Аммония – область Ливии. Там находился храм египетского бога Аммона, по имени которого и называлась вся область. В Аммонии издавна получали аммонийные соли, сжигая верблюжий навоз. При распаде солей получался газ, который сейчас называют аммиактом. В 1787г. комиссия по химической номенклатуре дала газу имя «аммониак». Русский химик Захаров сократил это название до «аммиака».
Раствор аммиака в воде называют нашатырным спиртом. «Нашатырный» потому, что может быть получен из нашатыря NH4Cl. Но почему спирт? Латинское спиритус означает «дух», «душа». Очевидно, неизвестный нам химик, растворивший в воде полученный из нашатыря аммиак, назвал остро пахнущую жидкость «душой нашатыря».
Название «нитраты» происходит от названия г.Нитрии в Верхнем Египте, где впервые был найден минерал NH4NO3.
4.Способы получения солей аммония.
1. Соли аммония получают при взаимодействии аммиака с кислотами.
2. При взаимодействии аммиачной воды с кислотами.
5. Важнейшие области применения солей аммония.
— Как удобрение
-Для производства взрывчатых веществ
-Гидрокарбонат аммония и карбонат аммония в пищевой промышленности в качестве разрыхлителя теста.
— При покраске тканей в текстильной промышленности
— В производстве витаминов
— В медицине
-При пайке
-В сухих батареях
-При выделке кожи
— В пиротехнике
Выводы :
Соли аммония образованы катионами аммония и анионами кислотных остатков
По физическим свойствам они похожи на соли щелочных металлов, особенно калия
Качественная реакция на катион аммония – взаимодействие со щелочами при нагревании, выделяющийся газ имеет характерный запах и окрашивает фенолфталеиновую бумажку в малиновый цвет.
4. Закрепление изученного материала
Закрепление изученного материала можно провести в форме дифференцированной индивидуальной самостоятельной работы обучающихся по вариантам.
ВАРИАНТ 1
Напишите полные и сокращенные ионные уравнения реакций, происходящих между веществами:
-хлоридом аммония и нитратом серебра;
-карбонатом аммония и соляной кислотой;
-нитратом аммония и гидроксидом натрия.
ВАРИАНТ 2
Допишите уравнения реакций в полной и сокращенной ионной форме:
(NH4)2SO4 + ? → NH4CI + BaSO4↓
NH4CI + ? → ? + ? + NH3↑
(NH4)2S + HCI → ? + ?
ВАРИАНТ 3
Напишите полные и сокращенные ионные уравнения реакций, происходящих между следующими парами веществ:
-соль аммония и другая соль;
-соль аммония и щелочь;
-соль аммония и кислота.
5.Домашнее задание: § 26,упр 1-4 (письменно)
