Какое количество вещества содержится в водороде объемом
Задача 53.
Сопоставить числа молекул, содержащихся в 1г NH3 и в 1г N2. В каком случае и во сколько раз число молекул больше?
Решение:
В одном моле любого вещества содержится 6,02 . 1023 молекул этого вещества.
Рассчитаем содержание количества вещества в 1г NH3 и N2 по формуле:

 (B) — количество вещества (В);
(B) — количество вещества (В);
m(B)- масса вещества (В);
M(B) — Молярная масса вещества (В).
М(NH3) = 17г/моль, M(N2) = 28г/моль.
Тогда

Число молекул NH3 больше числа молекул N2, так как  (NH3) >
(NH3) > (N2) . Теперь рассчитаем, во сколько раз число молекул NH3 больше числа молекул N2:
(N2) . Теперь рассчитаем, во сколько раз число молекул NH3 больше числа молекул N2:

Ответ: в 1,65 раз число молекул NH3 больше числа молекул N2.
Задача 54.
Выразить в граммах массу одной молекулы диоксида серы.
Решение:
Находим молекулярную массу диоксида серы:
M(SO2) = 32 + (16 . 2) = 64г/моль.
Молекулярная масса численно составляет массу одного моля вещества, а значит, вес одного моля численно равен молекулярной массе и составляет 64г. Известно, что в одном моле любого вещества содержится 6,02 . 1023 молекул данного вещества. Исходя из этого, рассчитаем массу в граммах одной молекулы диоксида серы:

Ответ: масса одной молекулы диоксида серы равна.
Задача 55.
Одинаково ли число молекул в 0,001кг Н2 и в 0,001кг О2? В 1 моле Н2 и в 1 моле 02? В 1л Н2 и в 1л О2 при одинаковых условиях?
Решение:
Молекулярные массы водорода и кислорода равны соответственно 2г/моль и 32г/моль. Отсюда находим количество водорода и кислорода, зная их массы:

Один моль любого вещества содержит 6,02 .1023 молекул. Следовательно, в 0,001кг водорода и в 0,001кг кислорода содержится разное число молекул:

Так как имеется по одному молю водорода и кислорода, то количество молекул веществ будет одинаково:

Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л, В которых содержится 6,02 . 1023 молекул. Отсюда рассчитаем количество молекул вещества, содержащихся в 1л водорода и в 1л кислорода:

Ответ: а) в 0,001кг водорода и в 0,001кг кислорода содержится разное число молекул; б) в одном моле водорода и в одном моле кислорода содержится одинаковое число молекул: в) в одном литре водорода и в одном литре кислорода содержится одинаковое число молекул.
Задача 56.
Сколько молекул содержится в 1,00 мл водорода при нормальных условиях?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л, В которых содержится 6,02 .1023 молекул. Отсюда рассчитаем количество молекул вещества, содержащихся в 1мл водорода из пропорции:

Ответ: 2,69 .1019 молекул.
Задача 57.
Какой объем при нормальных условиях занимают 27 .1021 молекул газа?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л, В которых содержится 6,02 . 1023 молекул. Отсюда находим какой объём при нормальных условиях занимают 27 .1021 молекул газа, составив пропорцию:

Ответ: V=1л.
Задача 58.
Каково соотношение объемов, занимаемых 1 молем О2 и 1 молем О3 (условия одинаковые)?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л. Следовательно соотношение объёмов, занимаемых одним молем О2 и одним молем О3 иметь вид:

Ответ: 1:1
Задача 59.
Взяты равные массы кислорода, водорода и метана при одинаковых условиях. Найти отношение объемов взятых газов.
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л. Мольные массы кислорода, водорода и метана, соответственно равны 32 г/моль; 2г/моль; 16 г/моль.
Так как массы кислорода, водорода и метана одинаковы при одинаковых условиях, то отношение объёмов взятых газов находим из пропорции:

Ответ: 1:16:2.
Задача 60.
На вопрос, какой объем займет 1моль воды при нормальных условиях, получен ответ: 22,4л. Правильный ли это ответ?
Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л. Так как вода при нормальных условиях находится в жидкой, а не в газообразной фазе, то ответ, что 1моль воды займёт 22,4л не правильный. Учитывая, что молярная масса воды равна 18г/моль, а плотность равна единице, то правильный ответ будет равен:

Ответ: 18мл.
Задача 61.
Сколько молекул диоксида углерода находится в 1л воздуха, если объемное содержание СО2 составляет 0,03% (условия нормальные)?
Решение:
При нормальных условиях углекислый газ, содержащийся в 1л воздуха, занимает объём 0,0003л. Зная, что мольный объём любого газа занимает 22,4л, рассчитаем число молей углекислого газа в 0,0003л из пропорции:

Учитывая, что в одном моле вещества содержится 6,02 . 1023 молекул, находим число молекул в 0,0003л газа:

Ответ: 8,07 .1018 молекул.
Задача № 1
Какова молярная (килломолярная, миллимолярная) масса водорода?
Ответ:
Задача № 2
Сколько молекул водорода содержится в 1моль водорода, в 1кмоль, в 1ммоль?
Ответ:
Задача № 3
Какой объем займут при нормальных условиях 3г водорода?
Ответ:
Задача № 4
Сколько будут весить 12 * 1020 молекул водорода, 12 * 1023 молекул,
12 * 1026 молекул?
Ответ:
Задача № 5
Какой объем займут 12 * 1020 молекул водорода, 12 * 1023 молекул,
12 * 1026 молекул?
Ответ:
Задача № 6
Какова молярная (киломолярная, миллимолярная) масса кислорода?
Ответ:
Задача № 7
Сколько молекул кислорода содержится в 2 моль вещества, в 2 кмоль, в 2 ммоль?
Ответ:
Задача № 8
Какой объем займут при н. у. 16г кислорода?
Ответ:
Задача № 9
Какую массу будут иметь 9*1020 молекул кислорода (9*1023, 9*1026 молекул)?
Ответ:
Задача № 10
Какой объем займут 9*1020 молекул кислорода (9*1023, 9*1026 молекул)?
Ответ:
Задача № 11
Какова миллимолярная, молярная, киломолярная масса озона?
Ответ:
Задача № 12
Сколько молекул озона содержится в 3 моль его (в 3 ммоль, в 3 кмоль)?
Ответ:
Задача № 13
Какой объем займут при н.у. 48 г озона?
Ответ:
Задача № 14
Какую массу будут иметь 3*1023 молекул, 3*1020 молекул, 3*1026 молекул озона?
Ответ:
Задача №15
Какой объем займут 6*1020 молекул, 6*1023 молекул, 6*1026 молекул озона?
Ответ:
Задача № 1
Сколько молекул содержится в 180 мг воды?
Ответ:
Задача № 2
Сколько молекул содержится в 704г С12Н22 О11?
Ответ:
Задача № 3
Найдите массу 24*1023 молекул хлора.
Ответ:
Задача № 4
Вычислите массу 3 *1023 молекул озона.
Ответ:
Задача № 5
Вычислите массу 48 *1023 молекул азота.
Ответ:
Задача № 6
Сколько молекул содержится в 11 г углекислого газа СО2?
Ответ:
Задача № 7
Найти массу 15*1023 молекул кислорода.
Ответ:
Задача № 8
Сколько молекул содержится в 44 г углекислого газа?
Ответ:
Задача № 9
Какое количество вещества составляет 342г гидроксида бария Ва(ОН)2?
Ответ:
Задача № 10
Какое количество вещества составляет 7,4 мг гидроксида кальция Са(ОН)2?
Ответ:
Задача № 11
Какое количество вещества составляет 490 г фосфорной кислоты Н3РО4?
Ответ:
Задача № 12
Какое количество вещества составляет 49 мг серной кислоты Н2SО4?
Ответ:
Задача № 13
Какое количество вещества составляет 40 кг сульфата железа (III) Fe 2(SO4 )3?
Ответ:
Задача № 14
Какое количество вещества составляет 94 мг нитрата меди (II) Cu(NO3)2?
Ответ:
Задача №15
Сколько молекул содержится в 342 г гидроксида бария Ва(ОН)2?
Ответ:
Задача № 1
Какой объем занимают 14 г азота при н.у.?
Ответ:
Задача № 2
Какова масса 33,6м3 аммиака NH3 при н.у.?
Ответ:
Задача № 3
Какой объем (н.у.) занимают 12*1023 молекул озона?
Ответ:
Задача № 4
Какой объем (н. у.) занимают 3*1023 молекул водорода?
Ответ:
Задача № 5
Какую массу имеют 11,2 мл (н.у.) кислорода?
Ответ:
Задача № 6
Какой объем (н.у.) занимают 32 г метана СН4?
Ответ:
Задача № 7
Какой объем займут 88мг оксида углерода (IV) СО2 при н.у.?
Ответ:
Задача № 8
Найдите массу 11,2 мл (н.у.) оксида серы (VI) SO3.
Ответ:
Задача № 9
Каковамасса 33,6л углекислого газаСО2?
Ответ:
Задача № 10
Какой объем займут 66 г углекислого газа СО2?
Ответ:
Задача № 11
Сколько молекул будет содержать 1,5моль углекислого газа СО2?
Ответ:
Задача № 12
Какой объем (н.у.) займут 18*1020 молекул сероводорода H2S?
Ответ:
Задача № 13
Какую массу будет иметь азот объемом 30л при н.у.?
Ответ:
Задача № 14
Какой объем займет при н.у. хлороводород НСl массой 14,6г?
Ответ:
Задача №15
Какова масса 200л хлора Cl2 при н.у.?
Ответ:
Задача № 16
Вычислите массу 1м3 оксида азота (I) N2O при н.у.
Ответ:
Задача № 17
Вычислите массу 1м3 дициана (СN)2 при н. у.
Ответ:
Задача № 18
Вычислите массу 1м3 фторида кремния SiF4 при н.у.
Ответ:
Задача № 19
Вычислите массу 1м3 диоксида серы SO2 при н.у.
Ответ:
Задача № 20
Вычислите массу 1 мл метана СН4 при н.у.
Ответ:
Задача № 21
Вычислите массу 1 мл ацетилена С2Н2 при н.у.
Ответ:
Задача № 22
Вычислите массу 1 мл хлороводорода НСl при н.у.
Ответ:
Задача № 23
Вычислите массу 1 мл оксида хлора (I) Cl2O при н.у.
Ответ:
Задача № 24
Какой объем займут при н.у. 3,5г азота N2?
Ответ:
Задача № 25
Какой объем займут 640г кислорода при н.у.?
Ответ:
Задача № 26
Какой объем займут при н.у. 70 г оксида углерода (II) СО?
Ответ:
Задача № 27
Какой объем (н.у.) займут 110 г оксида углерода (IV) СО2?
Ответ:
Задача № 28
Какой объем займет при н.у. 1 т хлороводорода НСl?
Ответ:
Задача № 29
Какой объем займет при н.у. 1,5 т оксида азота (II) NO?
Ответ:
Задача №30
Какой объем займут при н.у. 220кг оксида азота (I) N2O?
Ответ:
Решение задач на количественные характеристики вещества:
количества вещества, массу и объем
Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:
 в которых
в которых
Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
NA = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества.
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
№ 1.
Определите абсолютную массу (в г) одной молекулы воды.
 Ответ: m (молекулы Н2O) = 2,99 • 10–23 г.
Ответ: m (молекулы Н2O) = 2,99 • 10–23 г.
№ 2.
Определите массу порции оксида серы (VI), содержащей 7,224 • 1023 атомов кислорода.

Ответ: m(SO3) = 32 г.
№ 3.
Сколько атомов азота содержится в оксиде азота (I), объем которого (н. у.) равен 20,16 л?
 Ответ. N(N) = 10,836 • 1023.
Ответ. N(N) = 10,836 • 1023.
№ 4.
Определите объем (н. у.) оксида углерода (IV), в котором содержится столько же атомов кислорода, сколько их содержится в 48 г карбоната кальция.

Ответ. V(СO2) = 16,12 л.
№ 5.
Определите относительную плотность сероводорода по водороду и по воздуху.

Ответ: DH2(H2S) = 17; Dвозд(H2S) = 1,17.
№ 6.
Плотность газа по кислороду равна 0,875. Определите число молекул, содержащихся в 15,4 г этого газа.

Ответ. N(газа) = 3,311 • 1023.
ЗАДАЧИ с КРАТКИМ ОТВЕТОМ
№ 7. Сплав содержит 16 г меди и 11,2 г железа. Атомов какого метала будет больше в данном образце сплава?
№ 8. Смешали 16,8 г азота и 15,68 л (н. у.) водорода. Какое суммарное число молекул обоих газов будет содержаться в данной смеси?
№ 9. Чему равна масса порции хлорида бария, содержащая 1,3244 • 1024 ионов хлора?
№ 10. Какую массу должен иметь образец нитрата калия, чтобы в нем было столько же атомов кислорода, сколько их содержится в образце сульфата натрия массой 21,3 г?
№ 11. Сколько атомов хлора содержится в смеси, состоящей из 16,68 г хлорида фосфора (V) и 16,5 г хлорида фосфора (III)?
№ 12. Вычислите массу смеси, содержащей 672 мл (н. у.) оксида азота (I), 0,125 моль оксида азота (II) и 1,15 г оксида азота (IV). Сколько атомов азота будет содержаться в этой смеси?
№ 13. Молекула некоторого газа имеет массу 6,063* 10–23г. Определите плотность данного газа по гелию.
№ 14. Вычислите плотность газа по азоту, если 1 л (н. у.) этого газа имеет массу 1,7857 г.
№ 15. Плотность газа по воздуху равна 2,207. Найдите плотность этого газа по хлору и массу одной молекулы этого газа (в г).
№ 16. Масса порции оксида алюминия равна массе порции оксида кремния (IV). В какой порции будет содержаться больше атомов кислорода?
№ 17. Порции метана СН4 и аммиака NH3 содержат одинаковое число атомов водорода. Какая порция будет иметь большую массу?
№ 18. Десять молекул газа имеют массу 6,063 * 10–22г. Определите плотность данного газа по водороду.
№ 19. Определите массу и объем (н. у.) аммиака, содержащего столько же атомов водорода, сколько их содержится в 2,55 г сероводорода.
Решение задач на основные количественные характеристики вещества. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач с долей вещества в смеси, в соединении.
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
найдем количество водорода 1. = m/M =20г :2 г/моль = 10 моль.
число Авогадро = 6.0221415 × 10^23отсюда
2. число молекул =10 *6.0221415 × 10^23=
3. полученное число умножим на количество атомов в молекуле водорода т. е . на 2
=(10 *6.0221415 × 10^23)* 2= считай
и
Как найти количество атомов в веществе
Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
Для определения количества атомов в веществе возьмите точные весы (рычажные или электронные) , таблицу Менделеева, манометр, термометр.
Инструкция
1
Определение количества атомов в чистом веществе
Взвесьте образец исследуемого вещества на точных весах, результат получите в граммах. Убедитесь, что оно состоит из одноатомных молекул. Затем, используя таблицу Менделеева, найдите молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого найдите элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Например, для железа (Fe) это 55,845 г/моль. Если же точно известен изотоп, например железо 55, то можно брать целое число, правда, чистые изотопы зачастую радиоактивны. Затем массу вещества поделите на его молярную массу, а результат умножьте на 6,022*10^23. Это и будет количество атомов в данной массе вещества.
2
Количество атомов в сложном веществе
Если вещество состоит из многоатомных молекул, например, вода, молекула которой состоит из одного атома кислорода и двух атомов водорода, сделайте следующую последовательность действий. С помощью весов найдите массу образца. Затем запишите его химическую формулу, и с помощью таблицы Менделеева найдите молярную массу каждого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. Поскольку водорода 2 атома, умножьте молярную массу на это число, в результате получите общую молярную массу 18 грамм на моль. Затем массу в граммах делим на молярную массу в граммах на моль и умножаем на 6,022*10^23. Результатом будет количество молекул в веществе, это число умножьте на количество атомов в одной молекуле (для воды оно равно 3).
3
Количество атомов в смесях и сплавах
Если вещество представляет собой смесь нескольких веществ с известными массовыми долями, измерьте его общую массу. Затем найдите массы чистых веществ, умножив массу на соответствующие доли. Например, если бронза содержит 70% меди и 30 % олова, но для получения массы меди умножьте массу образца на 0,7, а для получения массы олова умножите массу образца на 0,3. Далее действуйте, как описано в предыдущих пунктах.
4
Количество атомов в газе
Если газ находится в нормальных условиях (давление 760 мм рт. ст. и температура 00С) , определите объем этого газа геометрическими методами (например, чтобы найти объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту) , выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте результат на 2.
Если известны давление, объем и температура газа (давление измеряется манометром, а температура термометром) , то найдите произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный результат умножьте на 6,022*10^23 и количество атомов в молекуле газа.
План урока:
Химическая формула
Массовая характеристика вещества
Количество вещества
Закон Авогадро и следствия с закона
Химическая формула
Химия — уникальная наука, которая обладает своим языком и «алфавитом». Каждый химический элемент имеет своё название и собственный «адрес» в периодической системе.
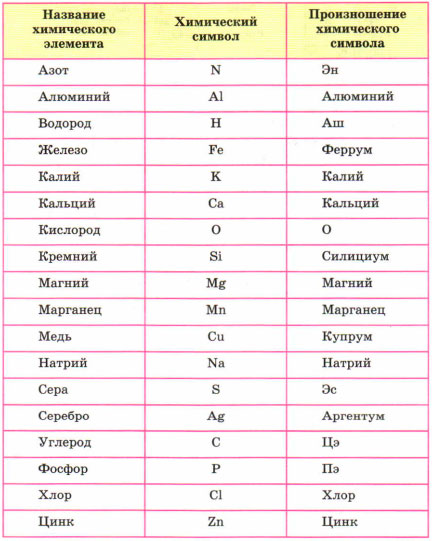
В этом разделе мы будем учиться составлять, читать химические слова, точнее на языке химии – формулы. Периодическая система служит алфавитом, она содержит 126 «букв». Но в ней содержатся только названия и символы элементов, но как они читаются не обозначено. Ниже приведены название и произношение наиболее употребляемых химических элементов.
(Источник)
Например, самый лёгкий элемент – водород, но его символ читается как АШ. Кислород читаем – О. Медь – купрум.
Как записать и прочитать с чего состоит соединение, чтобы нас могли понять не только русскоговорящие, но и те, кто говорит на другом языке? Помогут нам в этом символы, а также индексы.
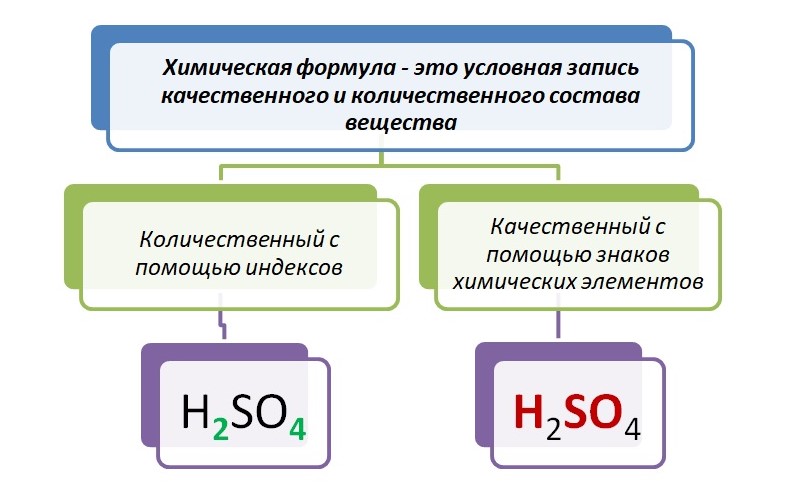
H2SO4 – зелёным цветом выделены индексы – маленькая цифра, которая записывается справа от символа. Он служит показателем количественного состава.
H2SO4 – красным выделены знаки элементов, они указывают качественный состав.
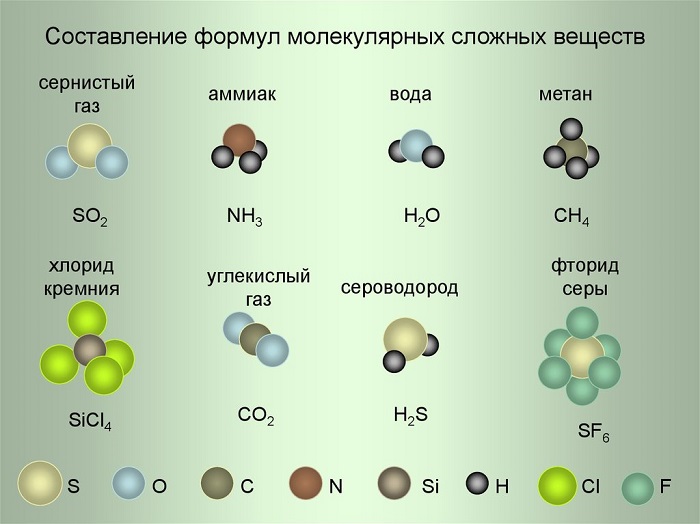
Рассмотрим примеры составления формул, используя условные обозначения на рисунке.
 (Источник)
(Источник)
- Сернистый газ. Из условных обозначений видим, что он состоит из одного атома Серы и двух атомов Кислорода – SO2, читается как эс-о-два.
- Аммиак. Один атом Азота и три Водорода – NH3 (эн-аш-три).
- Фторид серы. Один атом Серы и шесть атомов Фтора – SF6 (эс-фтор-шесть).
Коэффициент записывается всегда в начале формулы и никогда не ставится в середину. С его помощью мы узнаём количество молекул, либо свободных атомов. Например, запись 6SiCl4 читаем как: шесть молекул хлорида кремния, 3H2S– 3 молекулы сероводорода.
Массовая характеристика вещества
Относительная атомная масса (ОАМ)
Представим перед собой два кубика одинакового объёма 1 см3, только один сделан из свинца, а второй – из алюминия. ρ(Al) = 2.7 г/см3, ρ(Pb) = 11,3 г/см3. Свинцовый кубик будет 4,2 раза тяжелее алюминиевого. С чем это связано?
Атомы отличаются между собой количеством протонов и электронов. Логично будет предположить, что отличие также будет в размере и массе частиц.
Атом очень мал, что его невозможно увидеть невооружённым глазом. Так, если представить в числах размер Углерода, то его радиус r = 1.5∙10−10м и масса m = 19.94∙10−27кг. Эти параметры достаточно сложно представить. Но если, к примеру, прочертить простым карандашом (стержень карандаша в химии это графит – одна из аллотропных форм Углерода) отрезок длиной 3 см. В данном отрезке будет содержаться около 1 млн. в ширину и 100 млн. атомов Углерода в длину.
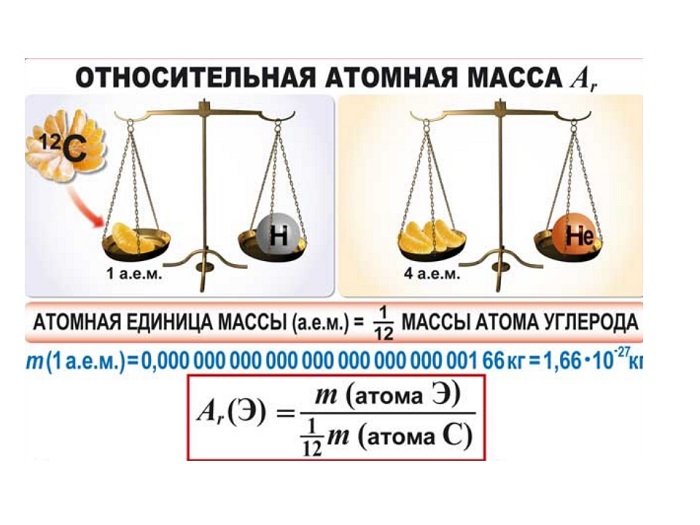
Как показывают числовые данные — масса и радиус очень малы, их достаточно трудно увидеть даже в современные оптические микроскопы. Именно по этой причине стали сравнивать атомные массы. На данный момент стандартом сравнения является химический элемент Углерод, а точнее 1/12 часть его массы.
Важно запомнить
 (Источник)
(Источник)
Иными словами, «всё познаётся в сравнении». Эталоном является двенадцатая часть атома Углерода. А ОАМ показывает ВО СКОЛЬКО РАЗ отличается масса элемента от эталона. Иначе можно объяснить: образцом сравнения является корзина, в которой содержится 12 яблок. Вся остальная численность, которая может содержаться в других корзинах (это может быть 10, 15, 5) будет сравниваться во сколько раз больше или меньше.
Закономерно также возникает вопрос, а какую размерность имеет ОАМ: граммы, миллиграммы? Поскольку это число, которое указывает сравнение, то это будет безразмерная величина.
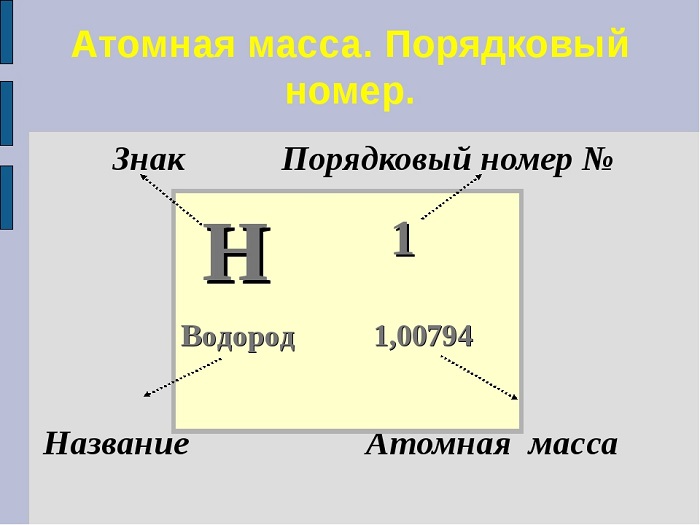
Чему равно Ar элемента подскажет периодическая система. Достаточно часто порядковый номер принимают за Ar. Чтобы избежать путаницы, запомним, что порядковый номер — целое число, а Ar записывается десятичной дробью, которую в химических расчётах общепринято округлять до целых (исключение составляет только Хлор).
 (Источник)
(Источник)
Например: Ar(Mg) = 24,305 ~ 24
Ar(Fe) = 55,847 ~ 56
Ar(Cl) = 35.453 ~ 35,5
Относительная молекулярная масса (ОММ)
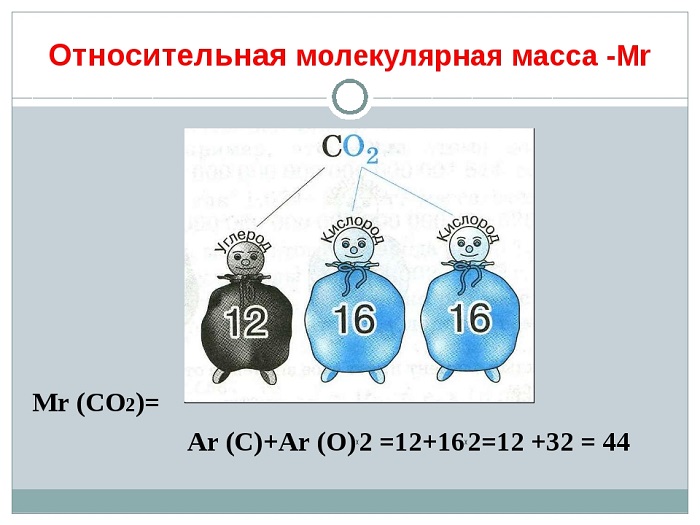
Данная величина относится также к количественным характеристикам. Более точное название — относительная формульная масса, потому что строение веществ бывает разным (в зависимости от того, какими частицами оно образовано).
Вычисляют ОММ (Mr) путём сложения Ar каждого элемента, которые входят в состав молекулы с учётом их индексов.
Здесь нам на помощь придут математические знания, а именно правила сложения, умножения и внимательное раскрытие скобок.
 (Источник)
(Источник)
Определим ОММ, например:
Сероводорода
Mr(H2S) = 2∙Ar(H) + Ar(S) = 2 ∙ 1 + 32 = 34
Так как в состав молекулы H2S входит 2 атома водорода, мы это учитываем выражением 2∙Ar(H) и один атом Серы Ar(S). В периодической таблице берём округлённое значение массы Н (1,00797 ~ 1) и S (32,064 ~ 32) и путём сложения вычисляем Mr(H2S).
Глюкозы
Mr (C6H12O6) = 6∙Ar(C) + 12∙Ar(H) + 6∙Ar(O) = 6∙12+12∙1 + 6∙16 = 180
Гашёной извести
Mr (Ca(OH)2) = Ar(Ca) + 2∙Ar(O) + 2∙Ar(H) = 40 + 2 ∙ 16 + 2 ∙ 1 = 74
Эта формула читается как кальций-о-аш-дважды. Что означает индекс два за скобками? Он показывает, что количество атомов H и O равно 2. Это будет равносильно, если раскрыть скобки и написать так: СаО2Н2.
Фосфата кальция
Mr(Ca3(PO4)2) = 3∙Ar(Ca) + 2∙Ar(P) + 8∙Ar(O) = 3 ∙ 40 + 2 ∙31 + 8 ∙ 16 = 310
Кальций-три-пе-о-четыре-дважды. В состав данного вещества входит 3 атома Кальция, два атома Фосфора (индекс 2 относится и к Фосфору и к Кислороду) и 8 атомов Кислорода (2 ∙ 4 = 8). Или, раскрыв скобки Са3Р2О8.
7 молекул угольной кислоты 7 ∙ Н2СО3
Mr (7 ∙ H2CO3) = 7 ∙ (2 ∙ Ar(H) + Ar(C) + 3 ∙ Ar(O)) = 14 ∙ Ar(H) + 7 ∙ Ar(C) + 21 ∙ Ar(O) = 14 ∙ 1 + 7 ∙ 12 + 21 ∙ 16 = 434
Следует обратить внимание, что в химии знак умножение между коэффициентом и формулой не ставится. Более корректная запись 7H2CO3, и действие умножение делается по умолчанию, т. е. раскрываются скобки.
Важно запомнить
Так как ОММ показывает во сколько раз молекула тяжелее 1/12 атома Углерода, то это безразмерная величина.
Не стоит путать с массой молекулы, которая имеет обозначение mM и имеет размерность а.е.м. (атомные единицы массы).
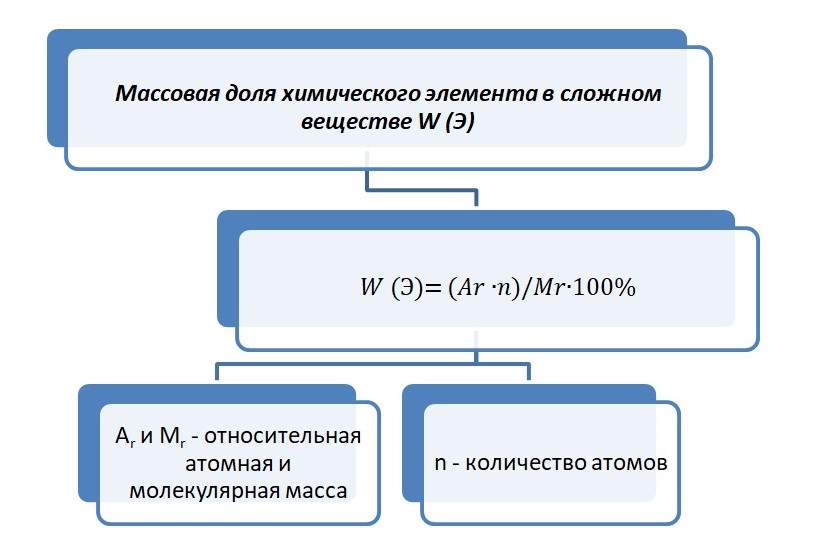
Благодаря химической формуле можно посчитать массовую долю элемента в сложном веществе.

Где n – число атомов элемента.
Сложное вещество можно очень условно сравнить с корзиной, в которой, допустим, находятся ягоды: малины, клубники и арбуз. Возьмём соединение ВаСО3.
Состав:
Mr(BaCO3) = Ar(Ba) + Ar(C) + 3∙Ar(O) = 137 + 12 + 3 ∙ 16 = 197
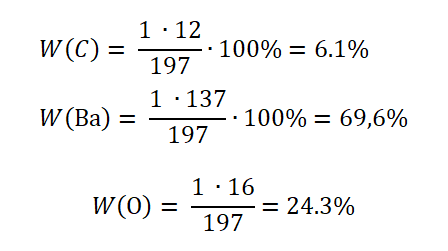
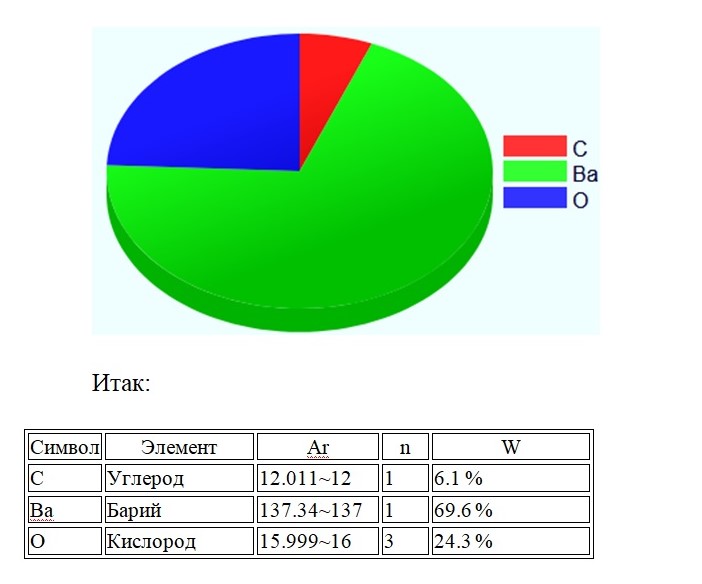
Не трудно догадаться, что арбузом будет атом бария, так как он занимает 69,6 % массы в корзинке фруктов.Проверить правильность решения можно, сложив доли элементов, в сумме должно получиться 100%.
Задача 1. Определите массовую долю Азота в натриевой селитре NaNO3
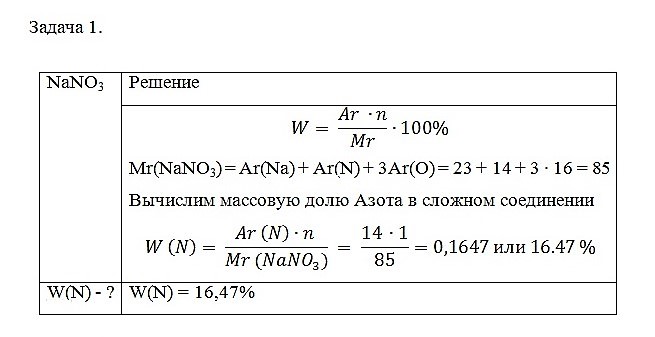
С помощью данных расчётов можно вычислить какая масса Азота, может быть получена из 1 кг натриевой селитры NaNO3.
m(N) = W (N) · m (NaNO3) = 0.1647 · 1 кг = 0,1647 кг или 164,7 г
Селитра применяется как азотное удобрение и с каждым кг растения получают 164,7 г азота.
Бывает так, что опытным путём определены массовые доли элементов и задача стоит в том, что необходимо определить количественный состав соединения. Такие задачи являются обратными идалее их.
Задача 2. Опытным путём установлено, что соединение состоит на 95,2% с Кальция и Водорода. Какова формула вещества?

Количество вещества
Как говорил Д. И. Менделеева «Наука начинается, когда начинают измерять». Но как можно измерить вещество? В порциях, штуках?
 (Источник)
(Источник)
Порцию считаем в граммах, в штуках количество. Например, в магазине вы не покупаете 1000 штук зёрен риса или пшена, а просите взвесить определённый вес (1 кг, 10 кг) или берёте с полки уже расфасованный. Либо необходимо взять молочные продукты, мы берём пакеты объёмом 0,5 л или 1 л. Одинаковая по весу порция содержит примерно одинаковое количество зёрен. Этот принцип применяется и в химии. Порция атомов или молекул называется количеством вещества.
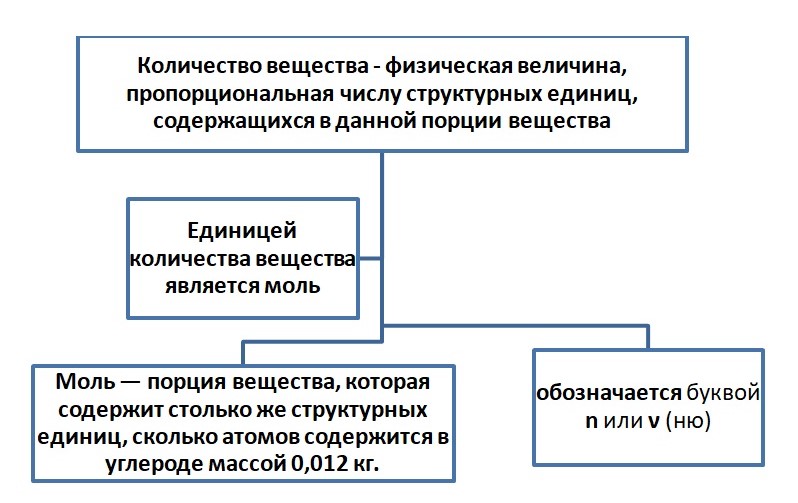
Размерность «моль» не сокращается, т. е. в отличие от литров (л), миллилитров (мл), сантиметров (см) на письме и при чтении указываем 4 моль, 5 сантиметров (5 см).
Если учесть, что атом Углерода имеет вес, (1.994 ∙ 10−23г), то не составит труда узнать, сколько атомов будет содержаться в порции 12 г.
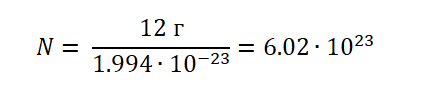
Можно сделать вывод, что 1 моль любого вещества (воды, углекислого газа, поваренной соли, серной кислоты и т. д) будет содержать 6,02∙1023 структурных единиц.
Это число является одним из важнейших не только в химии, но и в физике – оно носит название постоянная Авогадро (NA).
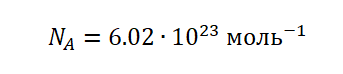
С этого следует, что NA показывает, сколько частиц содержится в 1 моль вещества, в этом и состоит её физический смысл.
Но что делать, если, к примеру, вещество дано в количестве 2 моль, 10 моль или 0.5 моль. Приведём сравнение с математикой, в одной корзине содержится 5 яблок, сколько яблок содержится в трёх таких корзинах. Ответ будет 15 яблок, полученный путём умножения 5 ∙ 3 = 15. Аналогично и с количеством молекул. Чтобы найти эту величину, используем формулу:
N = n * NA
Где N – количество структурных единиц.
Важно: не путать эти две величины, оба эти параметра показывают количество, но:
N — количество структурных единиц,
n — количество вещества (моль)
Рассмотрим подробно данные выводы.
Задача 3. Какое количество вещества составляют 2.709 ∙ 1024 молекул хлора? 
Так, в корзине может содержаться 5 яблок, 10 груш и 8 слив, и наша задача посчитать: «Сколько содержится фруктов?» А сколько будет содержаться в 8 таких корзинах яблок? Эти примеры нам знакомы ещё с первого класса. Молекула может состоять из нескольких атомов, и иногда необходимо точно знать, сколько их штук.
Задача 4. Вычислите сколько атомов Кислорода содержатся в 5 моль глюкозы (C6H12O6)

Молярная масса
Помните вопрос с первого класса: «Что тяжелее 1 кг золота и 1 кг пуха?». Ответ был: одинаковый вес, ведь и золото, и пух весят по 1 кг. Но если спросить, что тяжелее 1 моль метана или 1 моль фруктозы? Чтобы дать ответ на данный вопрос, введём следующее понятие.
Масса 1 моля любого вещества называется молярной массой (размерность г/моль, обозначение М). Не стоит путать с Mr, хоть они численно равны, но отличаются в следующем. Молярная имеет размерность (г/моль).
Связь количества вещества и массы выражается в следующем виде:
m = n * M
Возьмём для примера метан, фруктозу и хлороводород количеством вещества 1 моль.
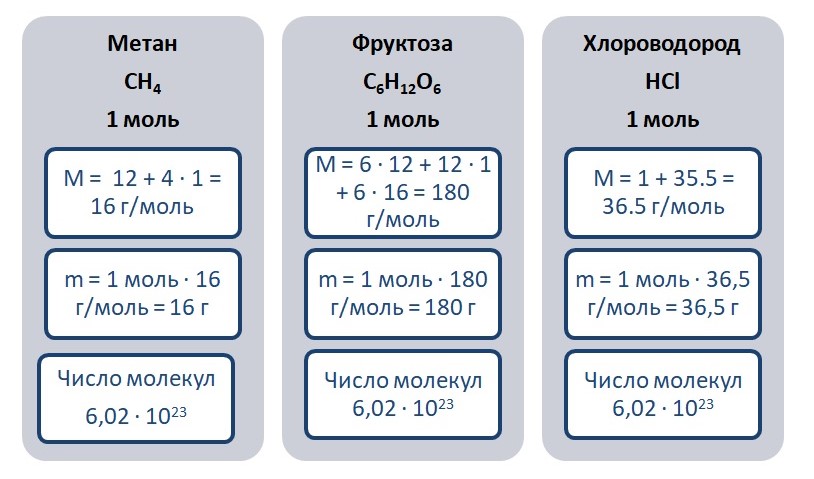
С расчётов делаем вывод, что масса 1 моль фруктозы тяжелее, в её состав входит большее количество атомов.
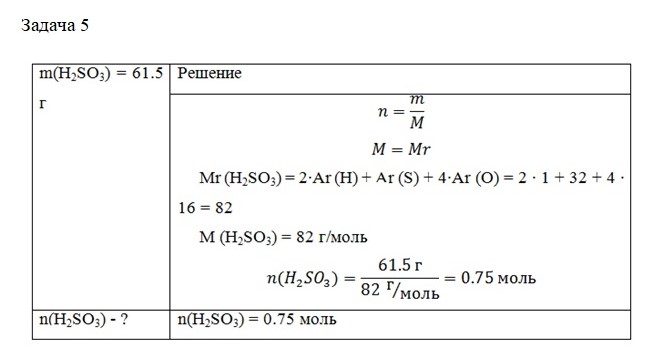
Задача 5. Какое количество вещества содержится в 61.5 г сернистой кислоты (H2SO3)?
Молярный объём газов
Вещества в газообразном состоянии, в отличие от жидких и твёрдых веществ, при одинаковых условиях (одинаковые давление и температура) будут занимать одинаковый объём.
Допустим, что имеем газ количеством вещества 1 моль. Как известно 1 моль любого соединения содержит 6,02 ∙ 1023 структурных единиц.
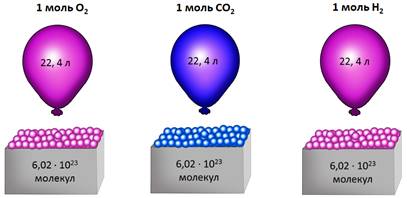
(Источник)
Опытным путём установлено, что 1 моль любого газа при н. у. занимает объём равный 22,4 л/моль.
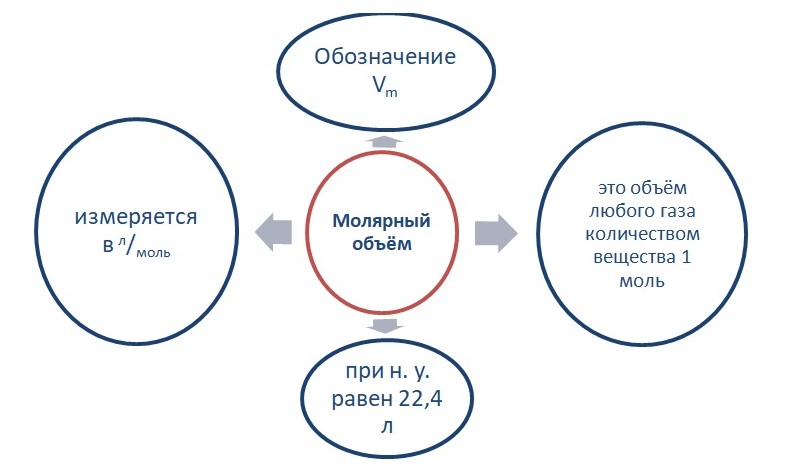
Связь количества вещества и объёма выражается в следующем виде:
V = n * Vm
Задача 6. Какой объём (н. у.) будет занимать 0,25 моль ацетилена (С2Н2)?

Как можно увидеть, количество вещества связывает три величины:
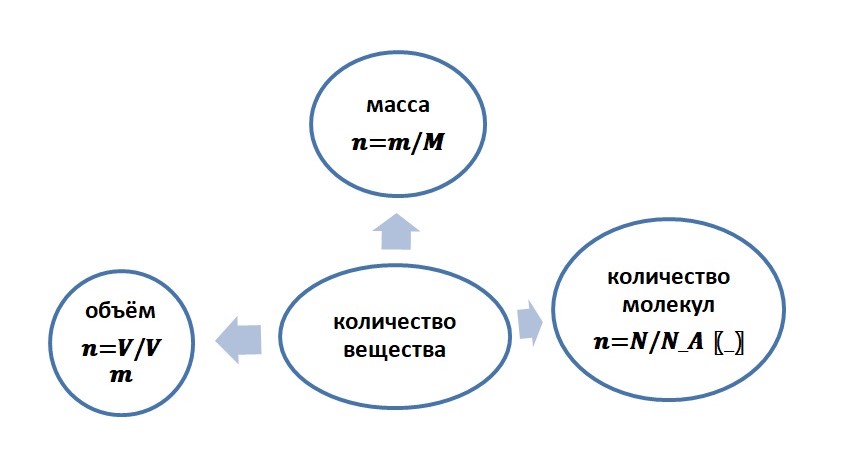
Приравняв между собой три выражения, а именно:
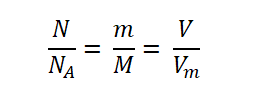
Получаем следующую взаимосвязь
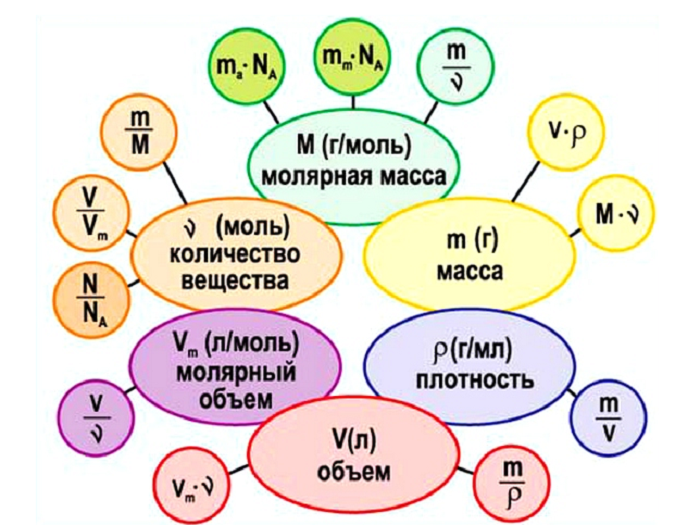
(Источник)
Задача 7. Какую массу составляют 18.06 ∙1023 молекул аммиака (NH3)?

Задача 8. Какой объём (н. у.) будет занимать 51 г сероводорода (H2S)?

Закон Авогадро и его следствия
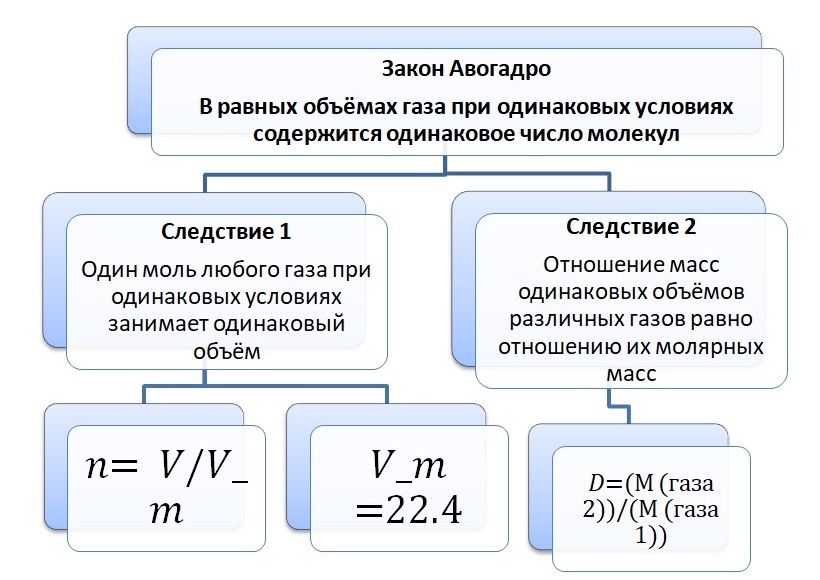
Величина D – это относительная плотность газов. Зная Mr, легко вычислить относительную плотность газов. Приведём пример с шариками. Если один шарик наполнить гелием, а второй углекислым газом. Как вы думаете, какой полетит высоко в небо, а какой упадёт на пол? С детства вы знаете, что гелиевые шарики взлетают в небо, но почему так происходит? Это связано с относительной молекулярной массой.
Mr(He) = 4
Mr(CO2) = 12 + 2 ∙ 16 = 44
Воздух это смесь газов, его Mr = 29
Гелий легче воздуха, поэтому шарик, наполненный этим газом, взлетает высоко в небо. Шарик с углекислым газом остаётся лежать на земле, так как углекислый газ тяжелее воздуха.
