Какое количество газообразного вещества содержится в этом сосуде
Урок физики 10 класс.
Решение задач по теме
«Уравнение состояния идеального газа»
к §63 (А1- А5) стр. 211 и к §64 (С1-С5)стр.213
Цель урока: научить учащихся решать задачи по изученной теме инаучить решать задачи по графикам.
А 1. Уравнение Менделеева—Клапейрона
1) связывает между собой макропараметры газа
2) связывает между собой микропараметры газа
3) связывает макропараметры газа с его микропараметрами
4) не связано ни с микропараметрами, ни с макропараметрами
Решение.
Уравнение Менделеева—Клапейрона
связывает между собой макропараметры газа (Р, V, T)
Ответ: 1)
А 2. Кислород находится в сосуде вместимостью 0,4 м3 под давлением
8,3 ∙ 105 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода 0,032 кг/моль.
1) 2 кг2) 0,4 кг3) 4 кг4) 2 • 10-23 кг
Дано:
V =0, 4м3
P =8, 3∙105 Па
T = 320 К
M = 32∙10-3
R =8, 31
Решение:
- PV = RT
- m =
- m =)
Ответ:3) 4кг
m =?
m=?
A3. Азот массой 0,3 кг при температуре 280 К оказывает давление на стенки сосуда, равное 8,3 • 104 Па. Чему равен объём газа? Молярная масса азота 0,028 кг/моль.
1) 0,3 м3 2) 3,3 м3 3) 0,6 м3 4) 60 м3
Решение:
- PV = RT
- V =
- V =(м3)
Ответ:1) 0,3 м3
Дано:
m =0, 3кг
P =8, 3∙104 Па
T = 280 К
M = 28∙10-3
R =8,31
V=?
А 4. В сосуде находится жидкий азот N2 массой 10 кг. Какой объём займёт этот газ при нормальных условиях (273 К; 100 кПа)? Молярная масса азота 0,028 кг/моль.
1) 4,05 м32) 8,1 м33) 16,2 м3 4) 24,3 м3
Решение:
- PV = RT
- V =
- V =(м3)
Ответ:2) 8,1 м3
Дано:
m =10 кг
P =1∙105 Па
T = 273 К
M = 28∙10-3
R =8,31
V=?
А5. В баллоне вместимостью 1,66 м3 находится азот массой 2 кг при давлении 100 кПа. Чему равна температура этого газа? Молярная масса азота 0,028 кг/моль.
1) 280 °С 2) 140 °С 3) 7 °С 4) -13 °С
Дано:
Решение:
- PV = RT
- T =
- T =
- T = ( t +273) K ; t = (T-273) 0C
T = 280- 273= 7 0C
Ответ: 3) 7°С
m =2 кг
P =1∙105 Па
V= 1,66 м3
M = 28∙10-3
R =8,31
V=?
С1. При температуре 240 К и давлении 166 кПа плотность газа равна 2 кг/м3. Чему равна молярная масса этого газа?
Дано:
P =1,66∙105 Па
Т =240 К
R =8,31
Решение:
- PV = RT
- М =
- M = (кг/моль)
Ответ: М = 0, 024 кг/моль
M =?
С2.Плотность идеального газа меняется с течением времени так, как показано на рисунке. Температура газа при этом постоянна. Во сколько раз давление газа при максимальной плотности больше, чем при минимальной?
Решение:
1.По графику определим ρmaxи ρmin
ρmax =3,9 кг/м3
ρmin = 1,3 кг/м3
2.Используя уравнение Менделеева—Клапейрона находим Pmaxи Pmin
Pmax= ;Pmin=; Находим отношение давлений
= = = 3
Ответ: в 3 раза больше
С 3. Газ находится в баллоне вместимостью 8,31 л при температуре 127 °С и давлении 100 кПа. Какое количество вещества содержится в газе?
Дано:
V = 8,31 л = 8,31∙10-3 м3
T = 400 К
P= 105 Па
Решение:
1.υ =
2.PV =∙RT
3.υ =
4.Производим вычисления:
υ = (моль)
Ответ:0,25 моль
С 4. На рисунке показан график изменения давления идеального газа при его расширении. Какое количество газообразного вещества (в молях) содержится в этом сосуде, если температура газа постоянна и равна 300 К?
Решение:
По графику находимобъём и давление используя уравнение Менделеева—Клапейрона находим количества вещества.
V = 0,1м3,P = 50ПаилиV =0,5м3,P= 10Па
υ = υ = (моль)
Ответ: моль
С5. На рисунке показан график зависимости давления газа в запаянном сосуде от его температуры. Объём сосуда равен 0,4 м3. Сколько молей газа содержится в этом сосуде?
Решение:
По графику находимтемператураи давление используя уравнение Менделеева—Клапейрона находим количества вещества.
T =300 K,P = 10 5 ПаилиT =330 K, P= 1,1∙10 5Па
V =0,4 м3
υ = ;υ = (моль) или υ = (моль)
Ответ: моль
Глава 10. Уравнение состояния идеального газа. Газовые законы
При решении задач по данной теме надо чётко представлять себе начальное состояние системы и какой процесс переводит её в конечное состояние. Одна из типичных задач на использование уравнения состояния идеального газа: требуется определить параметры системы в конечном состоянии по известным макроскопическим параметрам в её начальном состоянии.
Задача1. Воздух состоит из смеси газов (азота, кислорода и т. д.). Плотность воздуха ρ0 при нормальных условиях (температура t0 = 0 °С и атмосферное давление р0 = 101 325 Па) равна 1,29 кг/м3. Определите среднюю (эффективную) молярную массу М воздуха.
Р е ш е н и е. Уравнение состояния идеального газа при нормальных условиях имеет вид 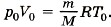 Здесь R = 8,31 Дж/(моль • К) и Т0 = 0 °С + 273 °С = 273 К, М — эффективная молярная масса воздуха. Эффективная молярная масса смеси газов — это молярная масса такого воображаемого газа, который в том же объёме и при той же температуре оказывает на стенки сосуда то же давление, что и смесь газов, в данном случае воздух. Отсюда
Здесь R = 8,31 Дж/(моль • К) и Т0 = 0 °С + 273 °С = 273 К, М — эффективная молярная масса воздуха. Эффективная молярная масса смеси газов — это молярная масса такого воображаемого газа, который в том же объёме и при той же температуре оказывает на стенки сосуда то же давление, что и смесь газов, в данном случае воздух. Отсюда
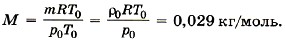
Задача2. Определите температуру кислорода массой 64 г, находящегося в сосуде объёмом 1 л при давлении 5 • 106 Па. Молярная масса кислорода М = 0,032 кг/моль.
Р е ш е н и е. Согласно уравнению Менделеева—Клапейрона 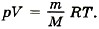
Отсюда температура кислорода 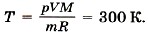
Задача3. Определите плотность азота при температуре 300 К и давлении 2 атм. Молярная масса азота М = 0,028 кг/моль.
Р е ш е н и е. Запишем уравнение Менделеева—Клапейрона: 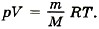
Разделив на объём левую и правую части равенства, получим
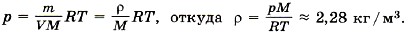
Задача4. Определите, на сколько масса воздуха в комнате объёмом 60 м3 зимой при температуре 290 К больше, чем летом при температуре 27 °С. Давление зимой и летом равно 105 Па.
Р е ш е н и е. Запишем уравнение Менделеева—Клапейрона: 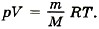
Из этого уравнения выразим массу газа: 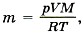 где T принимает значения Т1 и Т2 — температуры воздуха зимой и летом. Молярная масса воздуха М = 0,029 кг/моль. Температура воздуха летом Т2 = 27 °С + 273 °С = 300 К.
где T принимает значения Т1 и Т2 — температуры воздуха зимой и летом. Молярная масса воздуха М = 0,029 кг/моль. Температура воздуха летом Т2 = 27 °С + 273 °С = 300 К.
Таким образом,
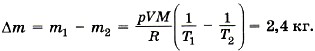
Задачи для самостоятельного решения
1. Чему равен объём идеального газа в количестве одного моля при нормальных условиях?
2. Определите массу воздуха в классе размером 6x8x3 м при температуре 20 °С и нормальном атмосферном давлении. Молярную массу воздуха примите равной 0,029 кг/моль.
3. В баллоне вместимостью 0,03 м3 находится газ под давлением 1,35 • 106 Па при температуре 455 °С. Какой объём занимал бы этот газ при нормальных условиях (t0 = 0 °С, р — 101 325 Па)?
4. Выразите среднюю квадратичную скорость молекулы через универсальную газовую постоянную и молярную массу.
5. При переходе газа определённой массы из одного состояния в другое его давление уменьшается, а температура увеличивается. Как изменяется его объём?
Образцы заданий ЕГЭ
С1. При температуре 240 К и давлении 166 кПа плотность газа равна 2 кг/м3. Чему равна молярная масса этого газа?

С2. Плотность идеального газа меняется с течением времени так, как показано на рисунке. Температура газа при этом постоянна. Во сколько раз давление газа при максимальной плотности больше, чем при минимальной?
С3. Газ находится в баллоне вместимостью 8,31 л при температуре 127 °С и давлении 100 кПа. Какое количество вещества содержится в газе?
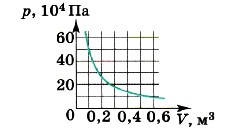
С4. На рисунке показан график изменения давления идеального газа при его расширении. Какое количество газообразного вещества (в молях) содержится в этом сосуде, если температура газа постоянна и равна 300 К?

С5. На рисунке показан график зависимости давления газа в запаянном сосуде от его температуры. Объём сосуда равен 0,4 м3. Сколько молей газа содержится в этом сосуде?
1 | В баллоне находится 20 кг азота при температуре 300 К и давлении 100 кПа. Каков объём баллона? Молярная масса азота 0,028 кг/моль. Ответ округлите до целых. |
2 | В баллоне объёмом 1,66 м3 находится 2 кг газа при давлении 100 кПа и температуре 47 оС. Какова молярная масса газа? Ответ выразить в г/моль. |
3 | В колбе объемом 1 л находится воздух при атмосферном давлении 100 кПа и температуре 300 К. На сколько уменьшится массы колбы с воздухом, если воздух из неё откачать. Ответ выразить в граммах и округлить до сотых. Молярная масса воздуха 0,029 кг/моль. |
4 | В колбе объемом 2 л находится аргон при нормальном атмосферном давлении 100 кПа и температуре 300 К. На сколько уменьшится масса колбы с газом, если газ из нее откачать. Ответ выразить в граммах и округлить до десятых. Молярная масса аргона 0,04 кг/моль. |
5 | В колбах одинакового объема находятся аргон и воздух при нормальном атмосферном давлении и комнатной температуре. Каково отношение массы аргона в первой колбе к массе воздуха по второй? Ответ округлите до десятых. Молярная масса аргона 0,04 кг/моль, а воздуха 0,029 кг/моль. |
6 | В 1 л колбу с воздухом при нормальном атмосферном давлении 100 кПа налили 1 г жидкого азота и закрыли плотной крышкой. Во сколько раз возросло давление в колбе после полного испарения азота и прогрева колбы до комнатной температуры (300 К). Ответ округлите до десятых. Молярная масса азота 0,028 кг/моль. |
7 | На рисунке показан график изотермического расширения водорода. Масса водорода 40 г. Определите его температуру. Молярная масса водорода 0,002 кг/моль. Ответ округлите до целого числа. |
8 | Стоящий вертикально цилиндрический закрытый сосуд высотой 0,8 м разделен на две части невесомым, скользящим без трения тонким поршнем. На какой высоте установится поршень, если в верхней части сосуда находится гелий (молярная масса кг/моль), а в нижней – азот (молярная масса кг/моль)? Массы газов и температуры в обеих частях равны. |
9 | Атмосфера Венеры состоит из двуокиси углерода с молярной массой , имеет температуру (у поверхности) 700 К и давление 90 земных атмосфер. Для атмосферы Земли температура у поверхности близка к 300 К. Каково отношение плотностей атмосфер у поверхностей Венеры и Земли? Ответ округлите до целых. Молярная масса воздуха 0,029 кг/моль. |
10 | На рисунке показан график изменения давления идеального газа при его расширении. Какое количество газообразного вещества (в моль) содержится в этом сосуде, если температура газа равна 300 К? Ответ округлите до целого числа. |
11 | На рисунке показан график изотермического сжатия газа при температуре 150 К. Какое количество газообразного вещества (в моль) содержится в этом сосуде? Ответ округлите до целого числа. |
12 | На рисунке показан график зависимости давления газа в запаянном сосуде от его температуры. Объем сосуда равен 0,4 м3. Сколько моль газа содержится в этом сосуде? Ответ округлите до целого числа. |
13 | На рисунке показан график изохорного нагревания газа в сосуде объемом 10-2 м3. Какое количество газообразного вещества содержится в этом сосуде? Ответ округлите до десятых. |
14 | В баллоне с воздухом объемом 5 л давление газа упало от 100 кПа до 50 кПа. Какова масса вытекшего из баллона воздуха, если баллон находится в комнате с температурой 27 °С. Ответ выразите в граммах и округлите до целых. Молярная масса воздуха 0,029 кг/моль. |
15 | Идеальный газ изохорно нагревают так, что его температура изменяется на DТ = 240 К, а давление – в 1,8 раза. Масса газа постоянна. Найдите начальную температуру газа по шкале Кельвина. |
16 | С идеальным газом происходит изобарный процесс, в котором для увеличения объема газа на 150 дм3 его температуру увеличивают в 2 раза. Масса газа постоянна. Каким был первоначальный объем газа? Ответ выразите в. |
17 | Идеальный одноатомный газ в количестве 0,09 моль находится в равновесии в вертикальном цилиндре под поршнем массой 5 кг. Трение между поршнем и стенками цилиндра отсутствует. Внешнее атмосферное давление равно =100 кПа. В результате нагревания газа поршень поднялся на высоту 4 см, а температура газа поднялась на 16 К. Чему равна площадь поршня? Ответ выразите в см2 и округлите до целых. |
18 | Идеальный одноатомный газ в количестве 0,09 моль находится в равновесии в вертикальном цилиндре под поршнем массой 5 кг и площадью 25 см2. Трение между поршнем и стенками цилиндра отсутствует. Внешнее атмосферное давление равно =100 кПа. В результате нагревания температура газа поднялась на 16 К. На какое расстояние поднялся поршень? Ответ выразите в см и округлите до целых. |
19 | Идеальный одноатомный газ в количестве ν = 0,09 моль находится в равновесии в вертикальном цилиндре под поршнем массой m = 5 кг и площадью S = 25 см2. Трение между поршнем и стенками цилиндра отсутствует. Внешнее атмосферное давление р0 = 105 Па. В результате нагревания газа поршень поднялся на высоту Δh = 4 см. На сколько увеличилась температура газа? Ответ в кельвинах округлите до целых. |
20 | С идеальным газом происходит изотермический процесс, в котором в результате уменьшения объема газа на 150 дм3 давление газа возросло в 2 раза. Каким был первоначальный объём газа (в дм3)? |
Раздел №4 «Термодинамика»
1 | Идеальный одноатомный газ находится в сосуде объёмом 0,6 м3 под давлением 2 кПа. Определите внутреннюю энергию этого газа. |
2 | Идеальный одноатомный газ находится в сосуде объёмом 0,6 м3. Его внутренняя энергия равна 1,8 кДж. Определите давление газа. |
3 | Объём постоянной массы идеального одноатомного газа увеличился при постоянном давлении 500 кПа на 0,03 м3. На сколько увеличилась внутренняя энергия газа? Ответ выразите в кДж и округлите до десятых. |
4 | Идеальный одноатомный газ находится в сосуде с жесткими стенками объёмом 0,5 м3. При нагревании его давление возросло на 4 кПа. На сколько увеличилась внутренняя энергия газа? |
5 | Идеальный одноатомный газ находится в сосуде с жесткими стенками объёмом 0,6 м3. При нагревании его давление возросло на 3 кПа. На сколько увеличилась внутренняя энергия газа? |
6 | В цилиндре, закрытом подвижным поршнем, находится воздух, который может просачиваться сквозь зазор вокруг поршня. В опыте по изобарному расширению воздуха его объём увеличился в пять раз, а абсолютная температура возросла в 1,2 раза. Во сколько раз изменилась внутренняя энергия воздуха в цилиндре? (Воздух считать идеальным газом). |
7 | В цилиндре, закрытом подвижным поршнем, находится воздух. Во время опыта и объём воздуха в цилиндре, и его абсолютную температуру увеличили в 2 раза. Оказалось, однако, что воздух мог просачиваться сквозь зазор вокруг поршня, и за время опыта его давление в цилиндре не изменилось. Во сколько раз изменилась внутренняя энергия воздуха в цилиндре? (Воздух считать идеальным газом). |
8 | В сосуде с небольшой трещиной находится воздух, который может просачиваться сквозь трещину. Во время опыта давление воздуха в сосуде возросло в 2 раза, а его абсолютная температура уменьшилась в 4 раза при неизменном объёме. Во сколько раз изменилась внутренняя энергия воздуха в цилиндре? (Воздух считать идеальным газом). |
9 | В цилиндре, закрытом подвижным поршнем, находится газ, который может просачиваться сквозь зазор вокруг поршня. В опыте по сжатию его объём уменьшился в 6 раз, а абсолютная температура уменьшилась вдвое при неизменном давлении. Во сколько раз изменилась внутренняя энергия газа в цилиндре? (Газ считать идеальным газом). |
10 | В цилиндре, закрытом подвижным поршнем, находится газ, который может просачиваться сквозь зазор вокруг поршня. В опыте по изотермическому сжатию газа его объём уменьшился в 2 раз, а давление газа упало в 3 раза. Во сколько раз изменилась внутренняя энергия газа в цилиндре? (Газ считать идеальным газом). |
11 | В цилиндре, закрытом подвижным поршнем, находится газ. Во время опыта газ сжали и охладили так, что его объём, уменьшился в 4 раза. Оказалось, однако, что газ мог просачиваться сквозь зазор вокруг поршня, и за время опыта давление газа снизилось в 1,5 раза. Во сколько раз изменилась внутренняя энергия газа в цилиндре? (Газ считать идеальным газом). |
12 | В сосуде с небольшой трещиной находится газ, который может просачиваться сквозь трещину. Во время опыта давление газа уменьшилось в 8 раз, а его абсолютная температура уменьшилась в 4 раза при неизменном объеме. Во сколько раз изменилась внутренняя энергия газа в сосуде? (Газ считать идеальным.) |
13 | Один моль инертного газа сжали, совершив работу 600 Дж. В результате сжатия температура газа повысилась на 40°С. Какое количество теплоты отдал газ? Ответ округлите до десятых. |
14 | В сосуде находится 1 моль одноатомного идеального газа. Какое количество теплоты получил газ в процессе, изображенном на рV-диаграмме (см. рисунок)? Ответ выразите в килоджоулях (кДж) и округлите до целых. |
15 | На рисунке изображено изменение состояния 1 моль идеального одноатомного газа. Начальная температура газа 27°С. Какое количество теплоты сообщено газу в этом процессе? |
16 | Чему равно изменение внутренней энергии газа, если ему передано количество теплоты 500 Дж, а газ при постоянном давлении 105 Па расширился на 3×10–3 м3? |
17 | Идеальному одноатомному газу сообщили количество теплоты, равное 1000 Дж. Какая работа будет совершена газом при изобарном расширении? |
18 | Нагреваемый при постоянном давлении идеальный одноатомный газ совершил работу 400 Дж. Какое количество теплоты было передано газу? |
19 | Какое количество теплоты выделится при изобарном охлаждении 80 г гелия с 200 ºС до 100 ºС? Молярная масса гелия 0,004 кг/моль. Ответ выразите в килоджоулях (кДж) и округлите до целых. |
20 | В цилиндре под поршнем находится идеальный одноатомный газ. Какое количество теплоты получил газ, если при давлении 120 кПа он изобарно расширился с 0,12 м3 до 0,14 м3? |
Раздел №5 «Электростатика»
| Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 |
11. МКТ и Термодинамика (объяснение явлений)
1. Вспоминай формулы по каждой теме
2. Решай новые задачи каждый день
3. Вдумчиво разбирай решения
В цилиндрическом сосуде под поршнем находится газ. Поршень может перемещаться в сосуде без трения. На дне сосуда лежит стальной шарик (см. рисунок). Газ нагревают.
Выберите из предложенного перечня два верных утверждения, верно описывающие данный процесс, и укажите их номера.
1) Объём газа в этом процессе остаётся неизменным.
2) Давление газа в сосуде остаётся неизменным.
3) Плотность газа в этом процессе увеличивается.
4) Сила Архимеда, действующая на шарик, уменьшается.
5) Концентрация молекул газа в сосуде увеличивается.
1) Так как поршень подвижный (не закреплен), то процесс будет происходить при постоянном давлениии.
Уравнение состояния газа: [pV=nu RT] где (nu) — количество вещества, (T) — температура в Кельвинах, (p) — давление газа, (V) — объем, занимаемый газом, (R) — универсальная газовая постоянная. Выразим объем [V=dfrac{nu RT}{p}] При нагревании газа объем увеличивается.
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Утверждение 2 — (color{green}{smalltext{Верно }})
3) Плотность газа: [rho=dfrac{m}{V}] При нагревании объем увеличивается, значит плотность уменьшается.
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) Сила Архимеда: [F_{text{Арх}}=rho gV] где (rho) — плотность газа, (V) — объем шарика, (g) — ускорение свободного падения. Плотность уменьшается, значит, сила Архимеда уменьшается.
Утверждение 4 — (color{green}{smalltext{Верно }})
5) Концентрация: [n=dfrac{N}{V}] При нагревании газа объем увеличивается, концентрация уменьшается.
Утверждение 5 — (color{red}{smalltext{Неверно }})
Ответ: 24
На (pV)—диаграмме отображена последовательность трёх процессов (1 — 2 — 3) изменения состояния 2 моль идеального газа. 
Из предложенного перечня утверждений выберите два правильных и укажите их номера.
1) В процессе 1 газ отдаёт положительное количество теплоты.
2) Процесс 2 является изотермическим.
3) В процессе 3 газ совершает работу.
4) В процессе 2 происходит расширение газа при постоянной температуре.
5) В процессе 1 происходит сжатие газа при постоянной температуре.
Работа газа находится как площадь под графиком 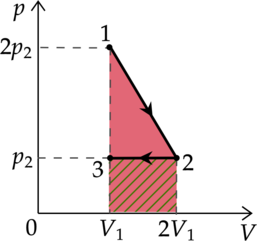
1) Первое начало термодинамики: [Q=Delta U+A] где (Delta U) — изменение внутренней энергии, (A) — работа газа, (Q) — количество теплоты, полученное газом. (Delta U=0), так как температура в процессе 1 не изменяется. При увеличении давления в изотермическом процессе объём уменьшается. (Delta V<0), следоватлеьно, (A<0). Таким образом, (Q<0), то есть газ отдает кол-во теплоты в данном процессе.
Утверждение 1 — (color{green}{smalltext{Верно }})
2) В процессе 2 температура увеличивается.
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) (p=const), следовательно (Vsim T)
Температура уменьшается, то есть объем тоже уменьшается, (Delta V<0), (A<0)
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) В процессе 2 температура увеличивается.
Утверждение 4 — (color{red}{smalltext{Неверно }})
5) Температура в процессе 1 не изменяется. По закону Бойля-Мариотта (p V=const) так как давление увеличивается объём уменьшается.
Утверждение 5 —(color{green}{smalltext{Верно }})
Ответ: 15
На рисунке показан график циклического процесса, проведённого с одноатомным идеальным газом, в координатах (V-T), где (V) — объём газа, (T) — абсолютная температура газа. Количество вещества газа постоянно. 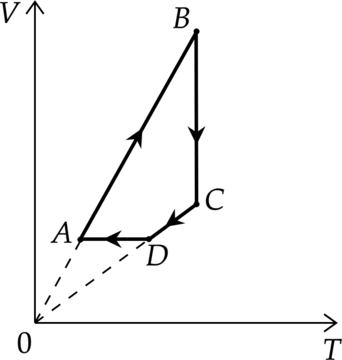
Из приведённого ниже списка выберите два правильных утверждения, характеризующие процессы на графике, и укажите их номера.
1) В состоянии (B) концентрация газа максимальна.
2) В процессе (AB) газ отдаёт некоторое количество теплоты.
3) В процессе (BC) внутренняя энергия газа увеличивается.
4) Давление газа в процессе (CD) постоянно, при этом внешние силы совершают над газом положительную работу.
5) В процессе (DA) давление газа изохорно уменьшается.
1) В точке (B) объем максимален, а концентрация минимальна:
Утверждение 1 —(color{red}{smalltext{Неверно }})
2) Первое начало термодинамики: [Q=Delta U+A] где (Delta U) — изменение внутренней энергии, (A) — работа газа, (Q) — количество теплоты, полученное газом. В процессе (AB) работа равна (0), температура увеличивается, то есть (Delta U>0), значит (Q>0), то есть газ получает тепло
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Процесс (BC) — изотермический. Внутренняя энергия не меняется.
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) Процесс (СD) — изобарное сжатие. При уменьшении объема внешние силы совершают положительную работу.
Утверждение 4 — (color{green}{smalltext{Верно }})
5) Процесс (DA) — изохорное охлаждение ((psim T)). Следовательно, при уменьшении температуры давление уменьшается.
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 45
Идеальный газ перевели из состояния 1 в состояние 3 так, как показано на графике зависимости давления р газа от объёма V. Количество вещества газа при этом не менялось. 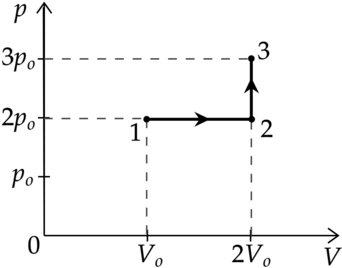
Из приведённого ниже списка выберите два правильных утверждения, характеризующие процессы на графике.
1)Абсолютная температура газа минимальна в состоянии 2.
2)В процессе 1-2 абсолютная температура газа уменьшилась в 2 раза.
3)В процессе 2-3 абсолютная температура газа уменьшилась в 1,5 раза.
4)Плотность газа максимальна в состоянии 1.
5)В ходе процесса 1-2-3 средняя квадратичная скорость теплового движения молекул газа увеличилась в (sqrt{3}) раза.
1) Уравнение состояния газа: [pV=nu RT] где (p) — давление газа, (V) — объем, занимаемый газом, (nu) — количество вещеста, (R) — универасальная газовая постоянная, (T) — температура. Температура максимальна там, где максимально произведение (pV), поэтому из графика видно, что (T_1 — min), (T_3 — max), (T_1<T_2<T_3)
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Процесс 1-2 — изобарное расширение ((Vsim T)). Объем увеличился в 2 раза, то есть температура тоже увеличилась в 2 раза.
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Процесс 2-3 — изохорное нагревание. (V=const), следовательно (psim T) Давление увеличивается в 1,5 раза, то есть температура тоже увеличивается в 1,5 раза.
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) В точке 1 — объем минимален, следовательно, плотность там максимальна.
Утверждение 4 — (color{green}{smalltext{Верно }})
5) [E_{k}=dfrac{3}{2}kT] [dfrac{m_0 v^2}{2}=dfrac{3}{2}kT] где (m_0) — масса газа, (v^2) средняя квадратичная скорость [v^2sim T] [vsim sqrt{T}] Температура в процессе 1-2-3 увеличилась в 3 раза, значит средняя квадратичная скорость увеличилась в (sqrt{3}) раз
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 45
Сосуд разделён на две равные по объёму части пористой неподвижной перегородкой. В левой части сосуда содержится 40 г неона, в правой — 2 моль гелия. Перегородка может пропускать молекулы гелия и является непроницаемой для молекул неона. Температура газов одинакова и остаётся постоянной.
Выберите два верных утверждения, описывающих состояние газов после установления равновесия в системе.
1) Внутренняя энергия гелия в сосуде меньше, чем внутренняя энергия неона.
2) Концентрация гелия в левой части сосуда в 2 раза больше концентрации неона.
3) В левой части сосуда общее число молекул газов в 3 раза больше, чем в правой части.
4) Внутренняя энергия гелия в сосуде в конечном состоянии меньше, чем в начальном.
5) В конечном состоянии давление в левой части сосуда в 3 раза больше, чем в правой.
1) Молярная масса неона (M=20) г/моль. Количество неона: [nu=dfrac{m}{M}=dfrac{40text{ г}}{20text{ г/моль}}=2 text{ моль}] Гелий займет все пространство сосуда, значит в левой части будет 3 моля вещества (1 моль гелия и 2 моль неона).
В правой части будет тоже 1 моль гелия.
Внутренняя энергия газа: [U=dfrac{i}{2}nu RT] Газы находятся при одинаковой температуре, количество гелия равно количеству неона. Внутренняя энергия гелия равна внутренней энергии неона
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) В левой части сосуда количество гелия в два раза меньше количества неона. Следовательно, концентрация гелия в два раза меньше концентрации неона.
Утверждение 2 — (color{red}{smalltext{Неверно }})
3) Так как количество вещества в левой части сосуда больше в 3 раза, чем в правой, то и количество молекул также больше в 3 раза.
Утверждение 3 — (color{green}{smalltext{Верно }})
4) Так как температура гелия и общее количество гелия в сосуде не изменилось, то и внутреннняяя энергия не поменялась.
Утверждение 4 — (color{red}{smalltext{Неверно }})
5) Давление газа: [p=nkT] Так как кол-во вещества в левой части сосуда больше в 3 раза, чем в правой, температуры одинаковые, то давление в конечном состоянии больше в левой части в 3 раза, чем в правой.
Утверждение 5 — (color{green}{smalltext{Верно }})
Ответ: 35
Объём сосуда с идеальным газом увеличили вдвое и добавили в сосуд такое же количество того же газа. Температура в сосуде поддерживается постоянной.
Выберите два верных утверждения, описывающих этот процесс.
1) Давление газа в этом процессе увеличилось в 4 раза.
2) Внутренняя энергия газа в сосуде увеличилась.
3) Концентрация молекул газа в сосуде уменьшилась.
4) Давление газа в результате этого процесса не изменилось.
5) Плотность газа в сосуде увеличилась.
1) Уравнение состояния газа: [pV=nu RT] [p=dfrac{nu RT}{V}] где (nu) — количество вещества, (T) — температура в Кельвинах, (p) — давление газа, (V) — объем, занимаемый газом, (R) — универсальная газовая постоянная. Так как и числитель, и знаменатель увеличился в 2 раза, то давление газа не изменится.
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Внутренняя энергия газа: [U=dfrac{i}{2}nu RT] Температура не изменилась, количество газа увеличилось, следовательно, внутренняя энергия газа увеличилась.
Утверждение 2 — (color{green}{smalltext{Верно }})
3) (p=nkT) где (n) — концентрация молекул. Из этой формулы видно, что концентрация не изменилась.
Утверждение 3 — (color{red}{smalltext{Неверно }})
4) По пункту 1, утверждение 4 — (color{green}{smalltext{Верно }})
5) Плотность газа: [rho=dfrac{pmu}{RT}] где (mu) — молярная масса газа. Давление, молярная масса и температура газа не изменились, поэтому плотность тоже не изменится.
Утверждение 5 — (color{red}{smalltext{Неверно }})
Ответ: 24
Идеальный газ переводят из состояния 1 в состояние 3 так, как показано на графике зависимости давления (р) газа от объёма (V). Количество вещества газа при этом не меняется. 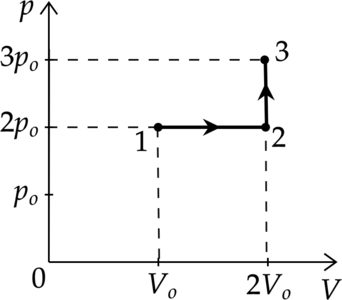
Из приведённого ниже списка выберите два правильных утверждения, характеризующие процессы на графике, и укажите их номера.
1) Абсолютная температура газа максимальна в состоянии 1.
2) В процессе 1-2 абсолютная температура газа изобарно увеличилась в 2 раза.
3) В процессе 2-3 абсолютная температура газа изохорно увеличилась в 1,5 раза.
4) Плотность газа минимальна в состоянии 1.
5) В ходе процесса 1-2-3 средняя квадратическая скорость теплового движения молекул газа увеличивается в 6 раз.
1) Уравнение состояния газа: [pV=nu RT] где (nu) — количество вещества, (T) — температура в Кельвинах, (p) — давление газа, (V) — объем, занимаемый газом, (R) — универсальная газовая постоянная. Температура максимальна там, где максимально произведение (pV), поэтому из графика видно, что (T_1 — min), (T_3 — max)
Утверждение 1 — (color{red}{smalltext{Неверно }})
2) Процесс 1-2 — изобарное расширение ((Vsim T)). Объем увеличился в 2 раза, то есть температура тоже увеличилась в 2 раза.
Утверждение 2 — (color{green}{smalltext{Верно }})
3) Процесс 2-3 — изохорное нагревание. (V=const), следовательно (psim T) Давление увеличивается в 1,5 раза, то есть температура тоже увеличивается в 1,5 раза.
Утверждение 3 — (color{green}{smalltext{Верно }})
4) В точке 1 — объем минимален, следоваельно, плотность там максимальна. Утверждение 4 — (color{red}{smalltext{Неверно }})
5) [E_{k}=dfrac{3}{2}kT] [dfrac{m_0 v^2}{2}=dfrac{3}{2}kT] [v^2sim T] [vsim sqrt{T}] Температура в процессе 1-2-3 увеличилась в 3 раза, значит средняя квадратичная скорость увеличилась в (sqrt{3}) раз
Утверждение 5 —(color{red}{smalltext{Неверно }})
Ответ: 23

