Какое из веществ проявляет как свойства кислот так и свойства альдегидов
Карбоновые кислоты — органические вещества, молекулы которых содержат одну или несколько карбоксильных групп.
Карбоксильная группа (сокращенно —COOH) — функциональная группа карбоновых кислот — состоит из карбонильной группы и связанной с ней гидроксильной группы.
По числу карбоксильных групп карбоновые кислоты делятся на одноосновные, двухосновные и т.д.
Общая формула одноосновных карбоновых кислот R—COOH. Пример двухосновной кислоты — щавелевая кислота HOOC—COOH.
По типу радикала карбоновые кислоты делятся на предельные (например, уксусная кислота CH3COOH), непредельные [например, акриловая кислота
CH2=CH—COOH
, олеиновая
CH3—(CH2)7—CH=CH—(CH2)7—COOH]
и ароматические (например, бензойная
C6H5—COOH).
Изомеры и гомологи
Одноосновные предельные карбоновые кислоты R—COOH являются изомерами сложных эфиров (сокращенно R’—COOR») с тем же числом атомов углерода. Общая формула и тех, и других CnH2nO2.
| г о м о л о г и | HCOOH метановая (муравьиная) | ||||
| CH3COOH этановая (уксусная) | HCOOCH3 метиловый эфир муравьиной кислоты | ||||
| CH3CH2COOH пропановая (пропионовая) | HCOOCH2CH3 этиловый эфир муравьиной кислоты | CH3COOCH3 метиловый эфир уксусной кислоты | |||
| CH3(CH2)2COOH бутановая (масляная) | 2-метилпропановая | HCOOCH2CH2CH3 пропиловый эфир муравьиной кислоты | CH3COOCH2CH3 этиловый эфир уксусной кислоты | CH3CH2COOCH3 метиловый эфир пропионовой кислоты | |
| и з о м е р ы | |||||
Алгоритм составления названий карбоновых кислот
- Найдите главную углеродную цепь — это самая длинная цепь атомов углерода, включающая атом углерода карбоксильной группы.
- Пронумеруйте атомы углерода в главной цепи, начиная с атома углерода карбоксильной группы.
- Назовите соединение по алгоритму для углеводородов.
- В конце названия допишите суффикс «-ов», окончание «-ая» и слово «кислота».
В молекулах карбоновых кислот p-электроны атомов кислорода гидроксильной группы взаимодействуют с электронами -связи карбонильной группы, в результате чего возрастает полярность связи O—H, упрочняется -связь в карбонильной группе, уменьшается частичный заряд (+) на атоме углерода и увеличивается частичный заряд (+) на атоме водорода.
Последнее способствует образованию прочных водородных связей между молекулами карбоновых кислот.
Физические свойства предельных одноосновных карбоновых кислот в значительной степени обусловлены наличием между молекулами прочных водородных связей (более прочных, чем между молекулами спиртов). Поэтому температуры кипения и растворимость в воде у кислот больше, чем у соответствующих спиртов.
Химические свойства кислот
Упрочнение -связи в карбонильной группе приводит к тому, что реакции присоединения для карбоновых кислот нехарактерны.
- Горение:
CH3COOH + 2O2 2CO2 + 2H2O
- Кислотные свойства.
Из-за высокой полярности связи O-H карбоновые кислоты в водном растворе заметно диссоциируют (точнее, обратимо с ней реагируют):HCOOH HCOO- + H+ (точнее HCOOH + H2O HCOO- + H3O+)
Все карбоновые кислоты — слабые электролиты. С увеличением числа атомов углерода сила кислот убывает (из-за снижения полярности связи O-H); напротив, введение атомов галогена в углеводородный радикал приводит к возрастанию силы кислоты. Так, в ряду
HCOOH CH3COOH C2H5COOH
сила кислот снижается, а в ряду
— возрастает.Карбоновые кислоты проявляют все свойства, присущие слабым кислотам:
Mg + 2CH3COOH (CH3COO)2Mg + H2
CaO + 2CH3COOH (CH3COO)2Ca + H2O
NaOH + CH3COOH CH3COONa + H2O
K2CO3 + 2CH3COOH 2CH3COOK + H2O + CO2 - Этерификация (реакция карбоновых кислот со спиртами, приводящая к образованию сложного эфира):
В реакцию этерификации могут вступать и многоатомные спирты, например, глицерин. Сложные эфиры, образованные глицерином и высшими карбоновыми кислотами (жирными кислотами) — это жиры.
Жиры представляют собой смеси триглицеридов. Предельные жирные кислоты (пальмитиновая C15H31COOH, стеариновая C17H35COOH) образуют твердые жиры животного происхождения, а непредельные (олеиновая C17H33COOH, линолевая C17H31COOH и др.) — жидкие жиры (масла) растительного происхождения.
- Замещение в углеводородном радикале:
Замещение протекает в -положение.
Особенность муравьиной кислоты HCOOH состоит в том, что это вещество — двуфункциональное соединение, оно одновременно является и карбоновой кислотой, и альдегидом:
Поэтому муравьиная кислота кроме всего прочего реагирует и с аммиачным раствором оксида серебра (реакция серебряного зеркала; качественная реакция):
HCOOH + Ag2O(аммиачный раствор) CO2 + H2O + 2Ag
Получение карбоновых кислот
- Окисление альдегидов.
В промышленности: 2RCHO + O2 2RCOOHЛабораторные окислители: Ag2O, Cu(OH)2, KMnO4, K2Cr2O7 и др.
- Окисление спиртов: RCH2OH + O2 RCOOH + H2O
- Окисление углеводородов: 2C4H10 + 5O2 4CH3COOH + 2H2O
- Из солей (лабораторный способ): CH3COONaкр. + H2SO4 конц. CH3COOH + NaHSO4
Задачи и тесты по теме «Тема 6. «Карбоновые кислоты».»
Рекомендации к теме
Изучив тему 6, Вы должны усвоить понятия: карбоксильная группа, карбоновые кислоты, предельные карбоновые кислоты, непредельные карбоновые кислоты, одноосновные карбоновые кислоты, многоосновные карбоновые кислоты.
Проверьте, знаете ли вы следующие формулы: общую формулу одноосновных предельных карбоновых кислот и предельных сложных эфиров, общую формулу одноосновных карбоновых кислот, общую формулу сложных эфиров, формулы муравьиной и уксусной кислот.
Проверьте, знаете ли вы, что такое реакция этерификации. Проверьте знаете ли вы правила номенклатуры карбоновых кислот.
Проверьте, умеете ли Вы решать задачи на избыток и недостаток.
Пример. Определите массу сложного эфира, который можно получить при взаимодействии 8 г метилового спирта и 23 г муравьиной кислоты.
Ответ: m(HCOOCH3) = 15 г
Убедившись, что все необходимые понятия усвоены, переходите к выполнению заданий. Желаем успеха.
Рекомендованная литература:
- О. С. Габриелян и др. Химия 10 кл. М., Дрофа, 2002;
- Л. С. Гузей, Р. П. Суровцева, Г. Г. Лысова. Химия 11 кл. Дрофа, 1999.
- Г. Г. Лысова. Опорные конспекты и тесты по органической химии. М., ООО «Глик плюс», 1999.
В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. В то же время температура кипения альдегидов выше, чем у соответствующих по молекулярной массе углеводородов, что связано с высокой полярностью альдегидов.
Температуры кипения кетонов несколько выше, чем у изомерных им альдегидов.
Метаналь (формальдегид) — газ, альдегиды С2–C5 и кетоны С3–С4 — жидкости, высшие карбонильные соединения — твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает. Ароматические карбонильные соединения в воде плохо растворимы.
Отличительной чертой многих альдегидов является их запах.
Низшие альдегиды имеют резкий запах (хотя при сильном разведении запах становится приятным и напоминает аромат плодов), у альдегидов, содержащих С4-С6 – неприятный запах, высшие альдегиды и кетоны обладают цветочными запахами. Альдегиды и кетоны хорошо растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
С увеличением числа атомов углерода в молекуле раздражающее действие ослабевает. Ненасыщенные альдегиды обладают более сильным раздражающим действием, чем насыщенные.
Альдегиды в природе
Альдегиды широко распространены в природе. Высшие альдегиды, особенно непредельные и ароматические входят в состав эфирных масел и содержатся в фруктах, плодах, цветах, душистых и пряных растениях. Их используют в пищевой промышленности и парфюмерии.
Человек давно использует лечебные свойства некоторых альдегидов. Пиродоксаль является одной из форм витамина В6.
В эфирных маслах аниса, акации, укропа, боярышника доминирует среди других «пахнущих» компонентов анисовый альдегид C8H8O2.
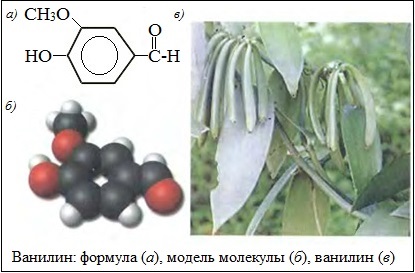
В плодах тропического растения ванили содержится ароматический альдегид ванилин (4-гидрокси-3-метоксибензальдегид) C8H8O3, который придает им характерный запах. Ванилин — кристаллическое вещество, хорошо растворяется в спирте, эфире, мало растворяется в воде.
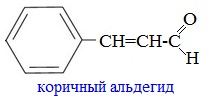 Коричный альдегид С6Н5СН=СНСНО содержится в масле корицы, его получают при обработке перегретым паром коры дерева корицы. Он обусловливает запах корицы, гвоздики.
Коричный альдегид С6Н5СН=СНСНО содержится в масле корицы, его получают при обработке перегретым паром коры дерева корицы. Он обусловливает запах корицы, гвоздики.
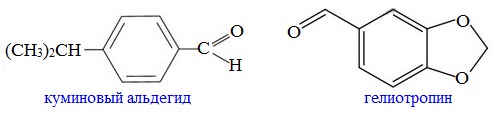
Куминовый альдегид С10Н12О содержится в масле тмина, гелиотропин (пиперональ) C8H6O3 – содержится в цветках гелиотропа и сирени.
 Пеларгоновый альдегид (нониловый альдегид, нонаналь) СН3(СН2)7СНО содержится в розовом и лимонном масле, в эфирных маслах цитрусовых растений. Пеларгоновый альдегид обладает запахом апельсина, его используют как пищевой ароматизатор.
Пеларгоновый альдегид (нониловый альдегид, нонаналь) СН3(СН2)7СНО содержится в розовом и лимонном масле, в эфирных маслах цитрусовых растений. Пеларгоновый альдегид обладает запахом апельсина, его используют как пищевой ароматизатор.
Альдегиды в природе

Физические свойства некоторых альдегидов
Формальдегид (муравьиный альдегид, метаналь) НСН=О – бесцветный газ с резким запахом, хорошо растворяется в воде, спиртах и полярных раствориелях. Иритант, токсичен!
Ирританты – группа веществ (слезоточивого или раздражающего действия), вызывающих раздражительные реакции при попадании на слизистые и кожу, и воздействии на дыхательные пути (респираторный эффект).
Формальдегид опасен для здоровья! 
Попадая в кровь, он уплотняет клеточную мембрану эритроцитов (красных кровяных клеток) настолько, что она теряет свои свойства, а ведь именно эритроциты снабжают клетки кислородом.
Водный 40%-ный раствор формальдегида называется формалином. Он обладает сильным дезинфицирующим действием и используется для хранения биологических препаратов.
Ацетальдегид (уксусный альдегид, этаналь) СН3СН=О – бесцветная легкокипящая жидкость, с резким запахом зеленой листвы. Хорошо растворяется в спирте, эфире, в воде растворяется неограниченно. Из-за очень низкой температуры кипения (210С) хранят и перевозят ацетальдегид в виде тримера – паральдегида.
Ирритант, очень токсичен! Он способен соединяться с белками и другими органическими соединениями в организме, подавляет дыхательные процессы в клетках.
Он является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Образуется при термической обработке полимеров и пластиков.
Акролеин (акриловый альдегид, пропеналь) СН2=CHCH=O – жидкость с резким неприятным запахом. Вследствие своей высокой реакционной способности акролеин является токсичным, сильно раздражающим слизистые оболочки глаз и дыхательных путей.
Он является одним из продуктов термического разложения глицерина и жиров-глицеридов, чем объясняется раздражающие слизистые оболочки свойства дыма горелых жиров. Подобный процесс наблюдается при пригорании жиров.
Он проявляет реакции, характерные для этиленовых углеводородов и альдегидов.
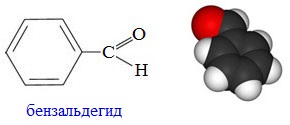
Бензальдегид(бензойный альдегид) C6H5CH=O – бесцветная маслянистая жидкость с запахом горького миндаля, плохо растворимая в воде, но хорошо растворимая в этаноле. Он содержится в миндале, листьях черемухи, косточках персиков, абрикосов, слив, в листьях лавровишен, в маслах нероли, цветов акации, апельсина, гиацинта, в эфирном масле эвкалипта. Бензальдегид легко окисляется на воздухе, образуя бензойную кислоту.
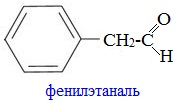
Фенилэтаналь (фенилуксусный альдегид) C6H5CH2CHO — бесцветная жидкость с сильным запахом гиацинта. По сравнению с бензальдегидом лучше соответствует рецептору цветочного запаха.
Кетоны в природе
Гептанон-2 С7Н14О представляет собой жидкость с гвоздичным запахом, обуславливает запах многих плодов и молочных продуктов.
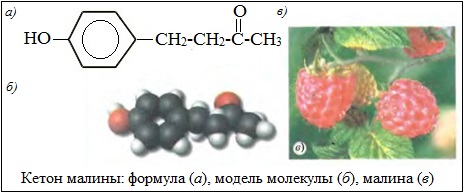
Гидроксифенилбутанон-2 (кетон малины) С10Н12О2 содержится в спелых ягодах малины. Его используют для придания вкуса и аромата в пищевой промышленности и включают в состав синтетических душистых композиций. Это один из самых дорогих компонентов, используемых в пищевой промышленности.

Физические свойства некоторых кетонов
Ацетофенон (метилфенилкетон) C6H5COCH3 — кристаллическое вещество, растворяется в спирте, эфире, бензоле, не растворяется в воде.
Бензофенон (дифенилкетон) (С6Н5)2С=О — кристаллическое вещество, растворимое в эфире, спирте, бензоле, нерастворимое в воде.
Физические характеристики альдегидов и кетонов
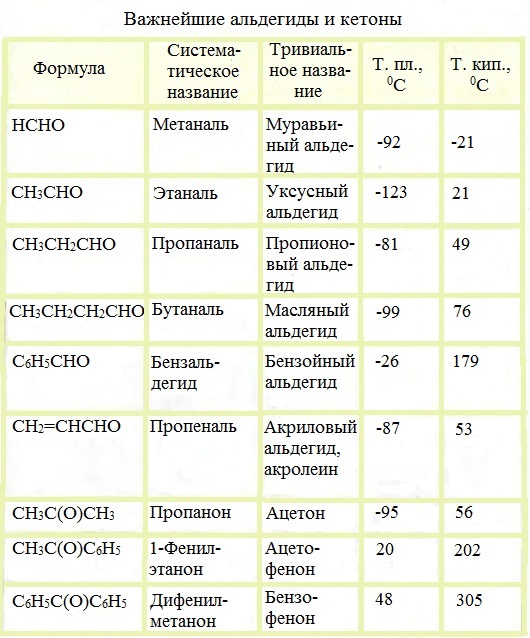
Альдегиды и кетоны
