Какое число электронов и протонов содержится в атоме изотопа фосфора
Главная
- 0
30 Баллов.
Определите число протонов, электронов и нейтронов в атомах элементов: натрия, фосфора, золота.
Екатерина Асятулина
Вопрос задан 3 октября 2019 в
5 — 9 классы,  
Химия.
Комментариев (0)
Добавить
Отмена
2 Ответ (-а, -ов)
- По голосам
- По дате
- 0
1.Натрий: протоны — 11, электроны — 11, нейтроны = атомная масса — протоны = 12.
2.Фосфор: протоны — 15, электроны — 15, нейтроны — 16.
3.Золото: протоны — 79, электроны — 79, нейтроны — 118.
Отмена
Эрик Чюлков
Отвечено 3 октября 2019
Комментариев (0)
Добавить
Отмена
- 0
В атоме натрия число протонов p = 11, а число нейтронов n = 23 – 11 = 12, электронов=11
Фосфор. протонов= 15, нейтронов = 31-15=16 электронов= 15
Золото. протонов= 79 нейтронов= 197-79=118 электронов = 79
Отмена
Аксинья Разумцова
Отвечено 3 октября 2019
Комментариев (0)
Добавить
Отмена
Ваш ответ
Задача 206.
Символ одного из изотопов элемента 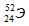 . Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
. Указать: а) название элемента; б) число протонов и нейтронов в ядре; в) число электронов в электронной оболочке атома.
Решение:
Заряд ядра атома искомого элемента 24 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №24 – хром (Cr).
Число нейтронов в ядре данного элемента равно 28:
N = A — Z = 28, где
N — число нейтронов в ядре, A — массовое число элемента (округленная масса атома), Z — заряд ядра.
Число электронов равно заряду ядра; в данном случае число электронов равно 24.
Ответ: Cr
Задача 207.
Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома — 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
Решение:
Количество электронов в атоме численно равно заряду атома. В данном случае заряд ядра атома равен +15. Заряд ядра атома искомого элемента 15 численно совпадает с номером элемента в периодической системе химических элементов. Элемент №15 – фосфор — символ – Р.
Массовое число данного изотопа фосфора равно:
A = N + Z = 16 + 15 + 31
Символ изотопа фосфора будет иметь вид: 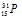
Ответ: 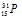 .
.
Задача 208.
Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
Решение:
Количество электронов в атоме равно количеству протонов. В данном случае число протонов равно 73. Число нейтронов в данном ядре равно 108:
N = A — Z = 181 — 73 = 108, где
N — число нейтронов, A — массовое число атома, Z — заряд ядра.
Заряд ядра атома искомого элемента 73 численно совпадает с порядковым номером элемента в периодической системе химических элементов. Элемент №73 –тантал, символ – +73Ta.
Ответ: +73Та.
Задача 209.
В природных соединениях хлор находится в виде изотопов 35Cl [75,5% (масс.)] и 37Cl [24,5% (масс.)]. Вычислить среднюю атомную массу природного хлора.
Решение:
Рассчитаем содержание 35Cl в природном хлоре, т.е. долю его в атомной массе из пропорции:
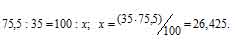
Теперь рассчитаем массу 37Cl, содержащуюся в природном хлоре из пропорции:
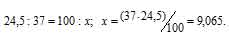
Вычисляем среднюю массу природного хлора, состоящего из двух изотопов
214,5 + 9,065 = 35,49.
Ответ: 35,49.
Задача. 210.
Природный магний состоит из изотопов: 24Mg, 25Mg, 26Mg. Вычислить среднюю атомную массу природного магния, если содержание отдельных изотопов в атомных процентах соответственно равно 78,6, 10,1 и 11,3.
Решение:
Вычислим атомную массу изотопов, содержащихся в природном магнии
а) (24 . 78,6)/100 = 18,864;
б) (25 .10,1)/100 = 2,525;
в) (26 . 11,3)/100 = 2,938.
Находим среднюю массу атома магния:
18,864 + 2,525 + 2,938 = 24, 327.
Ответ: Ar(Mg) = 24,327.
Задача 211.
Природный галлий состоит из изотопов 71Ga, 69Ga. В каком количественном соотношении находятся между собой числа атомов этих изотопов, если средняя атомная масса галлия равна 69,72.
Решение:
Для решения задач применим алгебраический метод расчёта:
Обозначим процентное содержание изотопа 69Ga через x. Тогда процентное содержание изотопа 71Ga будет равно 100 – x. масса изотопа 69Ga в атоме будет составлять 69 . (x/100). Масса изотопа 71Ga будет составлять 71 . (x/100).
В сумме масса обоих изотопов будет равняться атомной массе галлия:
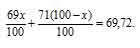
Освобождаемся от знаменателя и получим уравнение:
69x — 71x + 7100 = 69,72
Решаем его и, получаем:
-2x = -128x; x = 64
Значит, процент изотопа 69Ga составляет 64%, а процент изотопа 71Ga – 36% (100 – 64 = 100).
Теперь находим, в каком количественном соотношении находятся эти изотопы в природном галлии:
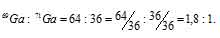
Ответ: 1,8 : 1.
Задача 212.
Найти массу изотопа 81Sr(T1/2 = 8,5ч), оставшуюся через 25,5 ч хранения, если первоначальная масса его составляла 200 мг.
Решение:
За время хранения радиоактивного изотопа прошло 3 периода полураспада (25,5/8,5 = 32). Массу нераспавшегося изотопа, оставшаяся после 25,5ч хранения, рассчитаем из уравнения:
mi = 2-n – m0, где
mi — масса изотопа, оставшаяся после хранения, m0 — исходная масса изотопа, n — период полураспада.
Тогда
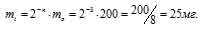
Ответ: 25мг.
Задача 213.
Вычислить процент атомов изотопа 128I(T1/2 = 25ч), оставшихся не распавшимися после его хранения в течение 2,5 ч.
Решение:
За время хранения радиоактивного изотопа прошло 6 периодов полураспада [(2,5 . 60)/25 = 6)]. Тогда процент атомов изотопа, оставшихся после распада, находим из формулы:
N% = 2-n. N0. 100%, где
N% — процент атомов изотопа, N0 — первоначальное число ядер изотопа, n — число периодов полураспада.
Отсюда
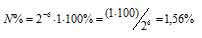
Ответ: 1,56%.
Задача 214.
Период полураспада 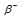 — радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
— радиоактивного изотопа 24Na равен 14,8 ч. Написать уравнение реакции распада и вычислить, сколько граммов дочернего продукта образуется из 24г 24Na за 29,6 ч.
Решение: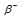 — распаду предшествует процесс
— распаду предшествует процесс 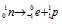 , протекающий в ядре; таким образом,
, протекающий в ядре; таким образом,
при испускании электрона заряд ядра увеличивается на единицу, а массовое число не изменяется. Дочернее ядро – изобар исходного — принадлежит элементу, стоящему следующим после исходного в таблице периодической системы химических элементов:
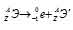
Уравнение радиоактивного распада должны удовлетворять правилу равенства сумм индексов.
Запишем уравнение реакции распада:
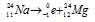
За время хранения 24Na прошло 2 периода полураспада (29,6/14,2 = 2). Массу не распавшегося изотопа, оставшуюся после 14,8ч хранения находим по формуле:
mi = 2-n – m0, где
mi — масса изотопа, оставшаяся после хранения, m0 — исходная масса изотопа, n — период полураспада.
Тогда
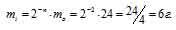
Таким образом, радиоактивному распаду подверглось 18г 24Na и столько же образовалось 24Mg (24 – 6 = 18).
Ответ: 18г.
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1] Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2] На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
Как найти чисто протонов, электронов и нейтронов
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5] Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
4
Определите количество электронов. Протоны — это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]. Атомная масса указана под символом элемента.
- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер — это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Расчет электронов с присутствующими ионами
1
Определите число ионов. Ион — это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8] Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.
- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Об этой статье
Эту страницу просматривали 665 233 раза.
Была ли эта статья полезной?
1. Химический элемент — это совокупность атомов с одинаковым зарядом ядра и числом протонов.
2. Физический смысл порядкового номера элементов.
Заряд ядра численно совпадает с порядковым номером элемента, а также с количеством протонов и электронов.
3. Найдите в Периодической таблице: а) водород, б) гелий, в) азот, г) хлор, д) олово, е) цирконий. Сколько протонов с ядрах атомов этих элементов? Каковы заряды их ядер? Сколько в этих атомов электронов?

4. В состав атомных ядер кроме протонов входят нейтроны. Для вычисления числа нейтронов нужно из атомной массы (Аr) вычесть порядковый номер атома.
Определите число нейтронов в ядрах атомов изотопов водорода, изотопов хлора, калия.
![]()
5. Изотопы — это разновидность атомов одного и того же химического жлемента, имеющие одинаковое число протонов, но разное число нейтронов в ядре.
6. Определите массовое число (относительную атомную массу) одного из изотопов меди, в ядре которого находится 36 нейтронов.

7. Определите порядковый номер элемента 41Э, если в его ядре находится 20 нейтронов.
41-20=21.
4121Sе
8. Массовое число изотопа элемента равно 130, а в атоме 54 электрона. Число протонов и нейтронов в ядре атома соответственно равно
протоны=электроны=54
нейтроны: 130-54=76
13054Хе
9. Хлор представляет смесь изотопов с массовыми числами 35 и 37. Вычислите долю (в %) атомов 35С1 в природной смеси изотопов, если средняя относительная атомная масса элемента хлора равна 35,485.

10. Определите состав атома (число электронов, протонов, нейтронов) и высшую валентность по следующим данным:

11. Почему первый период состоит только из двух химических элементов?
Потому что только водород и гелий имеют один энергетический уровень.
12. Почему второй период включает в себя восемь химических элементов?
Потому что только эти элементы два энергетических уровня.
13. Что показывает номер периода?
Количество энергетических уровней.
14. Определите число заполняемых энергетических уровней и число электронов на внешнем уровне атомов:
а) натрия 3, 1
б) серы 3, 5.
в) брома 4, 7.
г) теллура 5, 6.
д) висмута 6, 5.
е) таллия 6, 3.
15. Как определить число электронов во внешнем уровне атомов химических элементов главных подгрупп?
Равно номеру группы.
16. Определите число валентных электронов в атомах:
а) натрия 1
б) магния 2
в) кислорода 6
г) фосфора 5
д) хлора 7
е) селена 6
17. Составьте схему распределения электронов по энергетическим уровням для следующих элементов:

18. Какому элементу принадлежит схема распределения электронов по энергетическим уровням:

19. По электронной схеме строения атома определите химический знак элемента, формулу его высшего оксида и соединения с водородом:

20. Составьте формулы высшего оксида и летучего водородного соединения для:

21. Расположите химические элементы в порядке увеличения атомного радиуса. ПРиведите последовательность цифр.

22. Определите формулы и характер оксида и гидроксида химического элемента по положению в Периодической системе образующего их элемента:

23. Расположите химические элементы в порядке уменьшения энергии ионизации (увеличения способности отдавать электроны):

24. Сформулируйте Периодический закон.
Свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса.
25. В чем проявляется сущность явления периодичности? Покажите на конкретных примерах.

Сохраните или поделитесь с одноклассниками:
