Какими свойствами отличаются металлы от неметаллов

В повседневной жизни человек взаимодействует с множеством веществ. Все элементы можно классифицировать по физическим и химическим качествам. В статье рассмотрим, чем отличаются металлы от неметаллов, их свойства и понятие.
Определение металла и его свойства
Каждый день мы имеем дело с металлами и это неспроста. Большинство элементов таблицы Менделеева являются ими. Все они имеют свои характеристики и свойства.
Как правило, металлы — это такие элементы, которые хорошо проводят тепло и электричество. Также металлы очень пластичны, что позволяет изменять их форму путем ковки, еще они имеют высокий коэффициент твердости. Отличительной особенностью этого элемента является блеск, который называется металлическим. Свойства металла делятся на две основные фракции, такие как:
- Физические свойства.
- Химические свойства.
Чем металлы отличаются от металлов по физическим характеристикам? К физическим свойствам относится:
- Цвет. Металлы, как правило, имеют плотную структуру, которая не пропускает сквозь себя свет. А их цвет определяется отражением света от его поверхности. Так, металлы в большинстве случаев имеют расцветку от серого до серебристого. Но есть и исключения, как, например, медь, которая имеет красный цвет, и золото, имеющее желтый окрас.
- Состояние формы, твердость и плотность. Сами по себе металлы имеют твердое агрегатное состояние, но способны переходить в жидкое при высоких температурах. Так, металлы плавятся при температуре от 40 до 3400 градусов по Цельсию. Но встречаются металлы, чье основное агрегатное состояние — жидкое. К таким элементам относят ртуть.
- Электропроводимость. Особенностью является ее снижение при повышении температуры вещества.
- Теплопроводность и температура кипения/плавления.
Чем металлы отличаются от металлов по химическим свойствам? В этой группе выделяют:
- Окисляемость. Также металлы окисляются, и оксидная пленка на поверхности может придать им другой оттенок.
- Вступление в реакцию с неметаллами, кислотами, водой, солями.

Чем металлы отличаются друг от друга
Многие не знают, чем металлы отличаются от металлов. Их различия можно классифицировать:
- Металлы между собой отличаются по цвету, как, например, золото и медь.
- Также металлы плавятся при разных температурах. Некоторые металлы, например, олово и свинец, можно расплавить в домашних условиях, а вот для остальных нужна более высокая температура.
- Между собой металлы делятся на две группы: тяжелые и легкие. К тяжелым металлам относятся те, чья плотность составляет от 5 г/см3, легкие металлы имеют плотность меньше 5 г/см3. К легким металлам относится литий, который имеет плотность 0.2 г/см3, место самого тяжелого металла делят между собой осмий и иридий. Их плотность составляет 22.6 г/см3.
- Металлы отличаются друг от друга пластичностью и электропроводность. Некоторые из них очень пластичны. К примеру, из всего лишь 1 грамма золота можно сделать тонкую проволоку в 3.5 километра. Она будет гибкой и не сломается. Повторить такое с менее пластичным металлом не получится.
- Также часть металлов проводит ток лучше, чем другие. Самыми электропроводными металлами признаны медь, серебро и алюминий. Их наиболее часто применяют в качестве проводящих элементов.
Чем неметаллы отличаются от металлов
Неметаллами принято называть элементы, которые имеют неметаллические свойства. Чем отличаются металлы от неметаллов? Рассмотрим подробнее:
- Форма. Так неметаллы имеют три агрегатных состояния: жидкое, твердое и газообразное.
- Электропроводимость. Неметаллы не проводят ток как металлы, имеют более низкую теплопроводность.
- Зрительные отличия. Металл легко отличить визуально от неметалла, так как первый имеет металлический блеск. К неметаллам относятся такие элементы как бром, сера и водород.
- Химическое строение. Также легко отличить их и по строению. Металлы имеют четкую кристаллическую решетку. У неметаллов строение ионное.
- Вступление в реакции. Неметаллы имеют большее число незанятых электронов, находящихся на внешних уровнях. Именно это позволяет им иметь высокую окислительную способность по сравнению с металлами.

Чем дерево похоже на металл и в чем их отличия
Дерево — это растительное сырье. Металл же это результат природного химического соединения. Чем отличается дерево от металла:
- Древесина не проводит электричество и возгорается при довольно низкой температуре по сравнению с металлами.
- Древесина не плавится при воздействии высоких температур.
- Также дерево плохо проводит тепло, в отличие от металлов.
- Древесина упругая, но не гибкая. Металлы же имеют более низкий коэффициент упругости, но они более пластичны. Так сложить пополам проволоку и не сломать ее можно легко, древесина при таком воздействии сломается пополам.
- Также отличительной чертой древесины от металла является то, что она не покрывается коррозией. Есть породы дерева, которые могут долгое время находиться в воде и не гнить. Металлы же при таких условиях покрываются ржавчиной.
- Плотность древесины достаточно низкая по сравнению с металлами. Хотя некоторые металлы имеют плотность ниже дерева, они относятся к легким металлам.

Чем отличаются полупроводники от металлов
Полупроводниками называются неметаллы, которые имеют некоторые металлические свойства. Металлы и полупроводники имеют схожесть в том, что и те, и другие способны проводить ток.
Но полупроводники имеют отличительную особенность, которая заключается в том, что их электропроводность может возрастать в несколько раз в зависимости от внешних факторов. Таким образом, полупроводник проводит ток лучше при повышении температуры. У металлов электропроводность с повышением температуры уменьшается. Также на электропроводность может повлиять наличие посторонних примесей. Так, в металлах примеси понижают электропроводность, а в полупроводниках повышают.
Полупроводники в отличие от металлов могут обладать позитивной и негативной электропроводимостью. Сами по себе полупроводники по способности пропускать сквозь себя ток стоят между металлом и элементами, которые не проводят ток совсем.

Отличие металла от стали
Ошибочно считать, что металл и сталь — это совершенно разные элементы. На самом деле сталь — это тоже металл. Чем отличается металл от стали?
Дело в том, что металлами называют целую группу элементов, которые имеют металлические свойства. В эту группу входит и железо. Сталь не что иное, как сплав железа с элементами, входящими в группу металлов.
Чаще всего в состав стали помимо железа входят такие элементы таблицы Менделеева как молибден, хром и ванадий. Также в состав стали входит и углерод. С помощью него повышают прочность железа.
Таким образом, варьируя количеством углерода в сплаве можно получить очень прочный материал. Но чем прочнее сталь, тем больше она становится хрупкой. Так, при длительной динамической нагрузке сталь легко ломается. Добавление других примесей к ней помогает добиться устойчивости к каким-либо воздействиям.

Итак, в статье было рассмотрено, чем металлы отличаются от металлов и неметаллов. Характеристики всех элементов можно сравнивать по химическим и физическим свойствам. Ежедневно человек пользуется такими элементами и создает новые вещества для улучшения качества жизни.
С физической точки зрения металлы отличаются от неметаллов:
— металлическим блеском (который имеют также и некоторые неметаллы: йод и углерод в виде графита) ;
— хорошей электропроводностью;
— возможностью лёгкой механической обработки;
— высокой плотностью (обычно металлы тяжелее неметаллов) ;
— высокой температурой плавления (исключения: ртуть, галлий и щелочные металлы) ;
— большой теплопроводностью
Все металлы, кроме ртути и франция находятся при нормальных условиях в твёрдом состоянии.
Металлы не отличаются разнообразной цветовой окраской: в основном, все они серые, за исключением красноватой меди и желтоватого золота. Неметаллы гораздо больше разнообразны по цвету.
Металлов намного больше, чем неметаллов, при том, их количество с открытием новых элементов в конце Периодической системы возрастает.
В технике металлы применяются, как констрункциооные материалы, их используют в качестве рабочей части инструментов (также используют алмаз, нитрид бора, керамику) , из металлов изотавливают электрические провода, в то же время их используют и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.) .
При обычных условиях неметаллы существуют в разных агрегатных состояниях. Из-за отсутствия в кристаллической решётке неметаллов свободных электронов, они плохо проводят тепло и электричество. Большинство из неметаллов не имеет металлического блеска.
С химической точки зрения на внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны) . Валентные электроны металлов как правило слабо связаны с ядром, причём с увеличением заряда ядра эта связь ослабевает вследствие большего радиуса атома. Металлы, как правило, реагируют с кислотами (реакция замещения) , причём в зависимости от разбавленности кислоты могут выделяться различные продукты с различной степенью окисления неметаллов в них.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и амфотерных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют ковалентную природу строения.
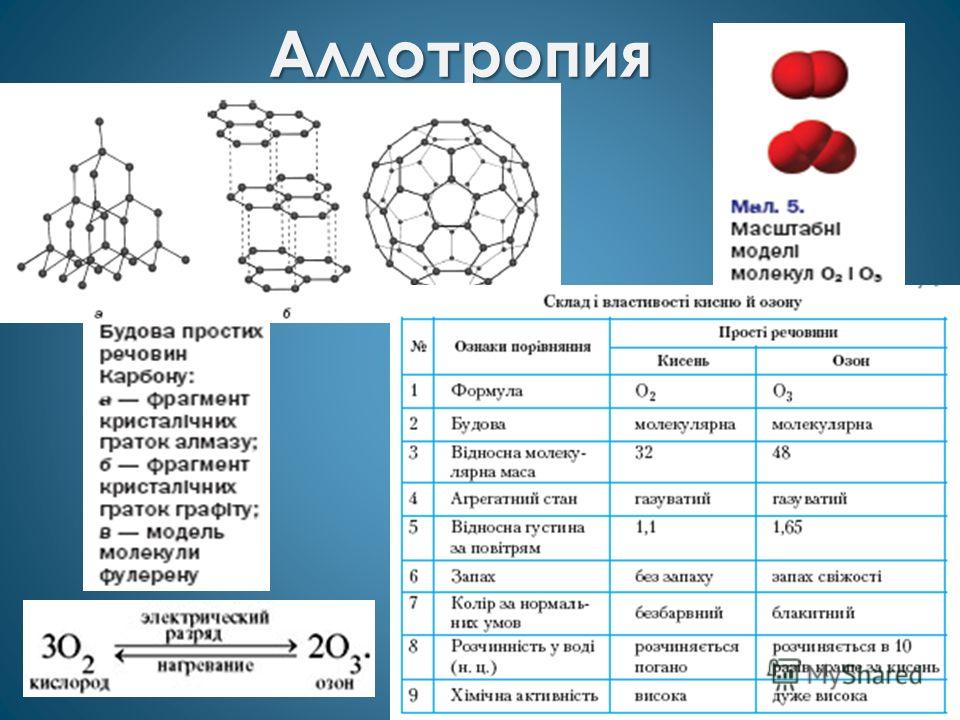
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графан, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера.
Все инертные газы также встречаются в природе в основном в свободном виде.
Но чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются. Наиболее распространёнными являются кислород, кремний, водород; наиболее редкими — мышьяк, селен, иод.
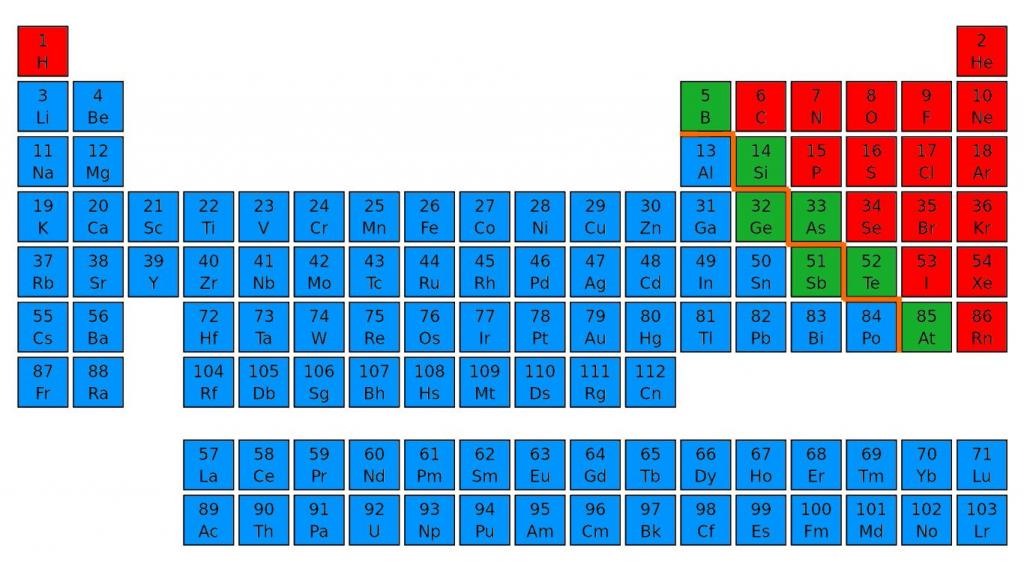
Все химические элементы условно можно разделить на неметаллы и металлы. Знаете ли вы, по каким признакам они отличаются? Как определить их положение в таблице химических элементов? На эти и другие вопросы вы найдете ответы в нашей статье.
Положение неметаллов и металлов: таблица Менделеева
По внешним признакам и физическим свойствам не всегда можно выяснить, к какой группе относится химический элемент. Свойства металлов и неметаллов можно определить по расположению в периодической таблице.
Для этого нужно зрительно провести диагональ от бора до астата, от 5 до 85 номера. В правом верхнем углу будут преимущественно находиться неметаллы. Их в таблице меньшинство, всего 22 элемента. Металлы находятся в правой части периодической таблицы наверху — в основном в I, II и III группах.
Энергетический уровень
Отличия неметаллов и металлов первоначально обусловлены строением их атомов. Начнем с количества электронов на внешнем энергетическом уровне. У атомов металлов оно варьирует от одного до трех. Как правило, они обладают большим радиусом, поэтому атомы металлов достаточно легко отдают наружные электроны, так как имеют сильные восстановительные свойства.
У неметаллов число электронов на внешнем уровне больше. Это объясняет их окислительную активность. Неметаллы присоединяют недостающие электроны, полностью заполняя энергетический уровень. Самые сильные окислительные свойства проявляют неметаллы второго и третьего периода VI-VII групп.
Заполненный энергетический уровень содержит 8 электронов. Самой большой окислительной способностью обладают галогены с валентностью I. Среди них лидирует фтор, так как у этого элемента нет свободных орбиталей.

Строение металлов и неметаллов: кристаллические решетки
Физические свойства веществ определяются порядком расположения элементарных частиц. Если условно соединить их воображаемыми линиями, то получится структура, которая называется кристаллической решеткой. В ее узлах могут находиться разные структуры: атомы, молекулы или заряженные частицы — ионы.
У некоторых неметаллов формируется атомная кристаллическая решетка, частицы которой соединены ковалентными связями. Вещества с таким строением твердые и нелетучие. К примеру, фосфор, кремний и графит.
В молекулярной кристаллической решетке связь между элементарными частицами слабее. Обычно подобные неметаллы находятся в жидком или газообразном агрегатном состоянии, но в некоторых случаях — это твердые легкоплавкие неметаллы.
В любом образце металла часть атомов теряет наружные электроны. При этом они превращаются в положительно заряженные частицы — катионы. Последние снова соединяются с электронами, образуя нейтрально заряженные частицы — в металлической решетке одновременно находятся катионы, электроны и атомы.

Физические свойства
Начнем с агрегатного состояния. Традиционно принято считать, что все металлы — твердые вещества. Исключением является только ртуть, тягучая жидкость серебристого цвета. Ее пары являются контаминантом — токсичным веществом, вызывающим отравление организма.
Еще одна характерная черта — металлический блеск, который объясняется тем, что поверхность металла отражает световые лучи. Еще одна важная особенность — электро- и теплопроводность. Это свойство обусловлено наличием в металлических решетках свободных электронов, которые в электрическом поле начинают двигаться направленно. Лучше всех проводит тепло и ток ртуть, наименьшими показателями обладает серебро.
Металлическая связь обусловливает ковкость и пластичность. По этим показателям лидирует золото, из которого можно раскатать лист толщиной в человеческий волос.
Чаще всего физические свойства металлов и неметаллов противоположны. Так, последние характеризуются невысокими показателями электро- и теплопроводности, отсутствием металлического блеска. При обычных условиях неметаллы находятся в газообразном или жидком состоянии, а твердые всегда хрупкие и легкоплавкие, что объясняется молекулярным строением неметаллов. Алмаз, красный фосфор и кремний — тугоплавкие и нелетучие, это вещества с немолекулярным строением.

Что такое полуметаллы
В периодической таблице между металлами и неметаллами находится ряд химических элементов, которые занимают промежуточное положение. Их называют полуметаллами. Атомы полуметаллов связаны ковалентной химической связью.
Эти вещества совмещают признаки металлов и неметаллов. К примеру, сурьма является кристаллическим веществом серебристо-белого цвета и вступает в реакцию с кислотами, образуя соли — типичные металлические свойства. С другой стороны, сурьма — очень хрупкое вещество, которое не поддается ковке, а измельчить его можно даже вручную.
Итак, типичные неметаллы и металлы обладают противоположными свойствами, но деление это достаточно условно, поскольку ряд веществ сочетает в себе и те и другие признаки.
Химики разделили все простые вещества на металлы и неметаллы. Они сильно различаются по строению, физическим и химическим свойствам. Многие из них легко отличить визуально, например медь – металл, а бром – неметалл. Однако чтобы не допустить ошибку при классификации элементов, лучше опираться на знание четких признаков, свойственных металлам и неметаллам.
Определение
Элементы, отдающие электроны с внешнего энергетического уровня, называют металлами
. Металлы – это, как правило, твердые вещества (особняком стоит ртуть, которая при нормальных условиях является жидкостью).
Элементы, принимающие электроны на внешний энергетический уровень, являются неметаллами
. Они находятся в различных агрегатных состояниях. Кислород и азот – это газы, бром – жидкость, а к твердым веществам относятся, например, мышьяк, углерод и бор.
Сравнение
Все металлы наделены металлическим блеском, они превосходные проводники электрического тока и тепла. Большинство из них пластичны, при физическом воздействии металлы легко меняют форму. Неметаллы, наоборот, плохие проводники тепла и электрического тока.
Строение металлов и неметаллов – главная отличительная характеристика. Неметаллы – обладатели большего числа неспаренных электронов, размещающихся на внешних уровнях. Металлы имеют металлическую кристаллическую решетку. А неметаллам присущи молекулярные (к примеру, кислороду, хлору и сере) и атомарные (углероду, образующему алмаз) кристаллические решетки.
У металлов маленькая электроотрицательность, а значит и окислительно-восстановительный потенциал невелик. Они, как правило, принимают электроны и окисляются, проявляя восстановительные свойства. Неметаллы, наделенные большой электроотрицательностью и значительным окислительно-восстановительным потенциалом, могут выступать как в качестве окислителей, так и в качестве восстановителей (такое возможно в присутствии наиболее мощного окислителя).
У металлов есть весьма интересное свойство – амфотерность. Амфотерным металлам присущи свойства и металлов, и неметаллов. Например, цинк, находясь в состоянии высшей степени окисления, ведет себя как неметалл.
Выводы сайт
- В физических свойствах.
- В строении атомов.
- В кристаллических решетках.
- В химических свойствах.
- В способности проявлять окислительно-восстановительные свойства.
- В амфотерности металлов.
НЕМЕТАЛЛЫ
природные соединения
применения продуктов их переработки
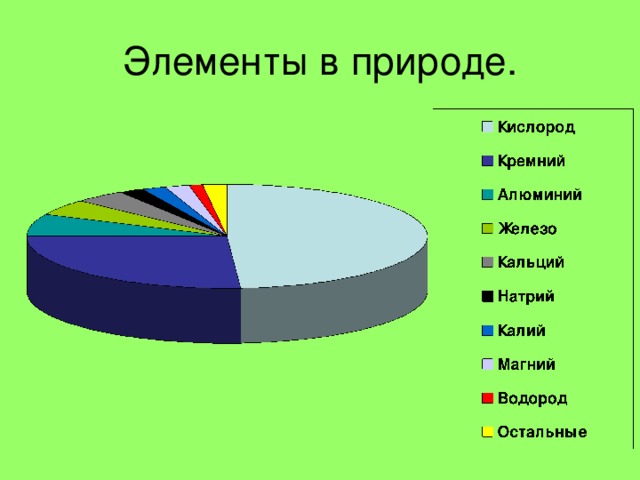

Нахождение в природе
.
Самородные элементы
Азот и кислород, инертные газы в составе воздуха
Сера
Графит С
Алмаз С

Нахождение в природе
←
Апатиты Р
Галит
NaCl →
←
FeS
2
пирит
Кварц
SiO
2
→

Неметаллы
—
это химические элементы, которые могут проявлять свойства как
окислителя
(принимают электроны), так и
восстановителя
(отдают электроны).
НеМ
– элементы с высокой ОЭО (2 — 4)
Исключения:
фтор
– только окислитель,
инертные газы
– могут только отдавать электроны.
Гелий, неон и аргон
– соединений не образуют.
![]()
Соединения неметаллов.
- Оксиды – только
кислотные
SO
3
, SO
2
, CO
2
и другие.
- (кроме
NO
и
CO
–безразличные)
- Гидроксиды – только
кислоты
H
2
SO
4
, H
2
SO
3
,H
2
CO
3
и другие
Образуют летучие соединения с водородом
HCl, NH
3
…
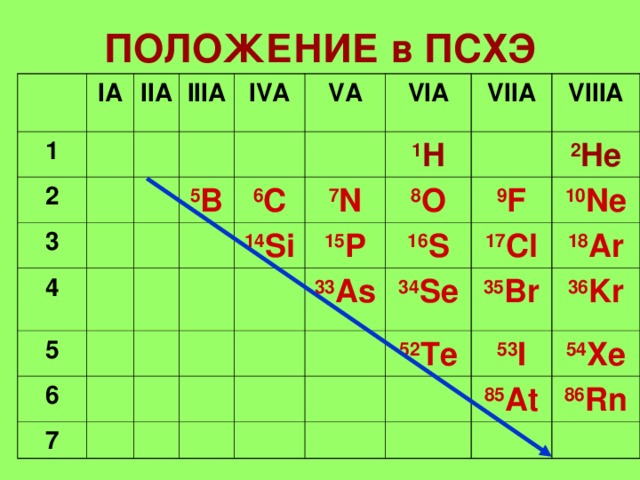
ПОЛОЖЕНИЕ в ПСХЭ
I
А
II
А
III
А
IV
А
V
А
5
B
VI
А
6
C
VII
А
14
Si
1
H
7
N
VIII
А
15
P
8
O
16
S
2
He
9
F
33
As
34
Se
10
Ne
17
Cl
35
Br
52
Te
18
Ar
36
Kr
53
I
54
Xe
85
At
86
Rn

ЭЛЕМЕНТЫ
—
IA,IIIA,IVA

ПНИКТОГЕНЫ
-VA

ХАЛЬКОГЕНЫ —
VIA

ГАЛОГЕНЫ —
VIIA

ИНЕРТНЫЕ ГАЗЫ-
VIIIA

Строение атомов НеМ
1. Элементы расположены в главных подгруппах III –VIII групп (А).
2. На последнем уровне 3 – 7(8) электронов.
3. Радиус атома уменьшается
4. Неметаллические свойства
В периоде – увеличиваются
В группе — уменьшаются

Строение атомов НеМ
- 5. Высокая электроотрицательность.
- 6. Принимают электроны и отдают.
- 7. НеМ → кислотный оксид→кислота
- 8. Летучие водородные соединения
(кислоты, основания и безразличные)

- Агрегатное состояние
.
- Газообразные – азот, кислород, хлор, инертные газы, водород.
- Жидкий – бром,
- Твёрдые – сера, фосфор, углерод…
- Растворимость в воде.
- Нерастворимы.
- Отношение к электрическому току.
- Неэлектропроводные: сера, кислород…
- Проводники: графит
- Полупроводники: кремний

Строение неметаллов
.
- Молекулярное (НеМ), где
- Инертные газы He, Ar, Ne…
- H 2 , Cl 2 , N 2 …
- P 4 белый
- P n красный
- Атомное строение
- (С) n -алмаз, графит;
- (Si) n кремний;
- (B) n бор


Большинство неметаллов имеют твёрдое агрегатное состояние
Сера – кристаллическое вещество жёлтого цвета
Красный фосфор
Углерод (уголь)

Неметаллы малорастворимы в воде
Уголь
Фосфор
Сера не смачивается водой

- 1. Реагируют с металлами.
- 2. С кислородом.
- 3. С водородом.
- 4. С кислотами.
- 5. Со щелочами.
- 6. С солями.
Элементы с неметаллическими свойствами находятся в IIIA-VIIA — группах Периодической системы:
| Период | IIIA | IVA | VA | VIA | VIIA |
| B | C | N | O | F | |
| Si | P | S | Cl | ||
| As | Se | Br | |||
| Te | I | ||||
| At |
Обычно среди неметаллов рассматривают также водород Н, хотя это не совсем точно, поскольку водороду присущи как неметаллические, так и металлические химические свойства.
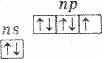
Общая электронная формула
атомов неметаллов ns
2 np
1−5 , этому соответствует большое разнообразие степеней окисления
неметаллов в соединениях.Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению высокой окислительной активности
. Вот почему значения электроотрицательности
у них велики. Отсюда многообразие в химических свойствах и способах получения неметаллов.
Другая характерная особенность неметаллов — стремление образовывать ковалентные связи
с атомами других неметаллов и амфотерных элементов. Поэтому и простые вещества и соединения неметаллов имеют ковалентное строение.
В свободном виде встречаются газообразные
вещества — F 2 , Cl 2 , O 2 , N 2 и Н 2 , твердые
— I 2 , At, S, Te, P, As, C, Si и В, при комнатной температуре известен один жидкий
неметалл — бром Br 2 .
Нередко для неметаллов наблюдается аллотропия
, например у кислорода (О 2 и О 3) и углерода (графит, алмаз, карбин, фуллерен).
В природе встречаются самородные неметаллы
— N 2 и O 2 (в воздухе), сера (в земной коре), но чаще неметаллы в природе находятся в химически связанном виде. В первую очередь это вода
и растворенные в ней соли
, затем — минералы
и горные породы
(например, различные силикаты
, алюмосиликаты
, фосфаты
, бораты
, сульфаты
и карбонаты
).
По распространенности в земной коре неметаллы занимают самые различные места: от трех самых распространенных элементов (O, Si, H) до весьма редких (As, Se, I, Te).
Галогены
В подгруппу галогенов входят фтор, хлор, бром, иод и астат. Первые четыре элемента встречаются в природе в виде различных соединений. Астат получен только искусственным путем, радиоактивен. Это р-элементы VII группы периодической системы Д. И. Менделеева. На внешнем энергетическом уровне их атомы имеют по 7 электронов ns2np5
(см. табл. 1).
Этим объясняется общность их свойств. Они легко присоединяют по одному электрону, проявляя степень окисления -1. Такую степень окисления галогены имеют в соединениях с водородом и металлами. Однако атомы галогенов, кроме фтора, могут проявлять и положительные степени окисления: +1, +3, +5, +7. Возможные значения степеней окисления объясняются электронным строением атомов, которое у атома фтора можно представить схемой:
Таблица 1. Свойства элементов подгруппы галогенов
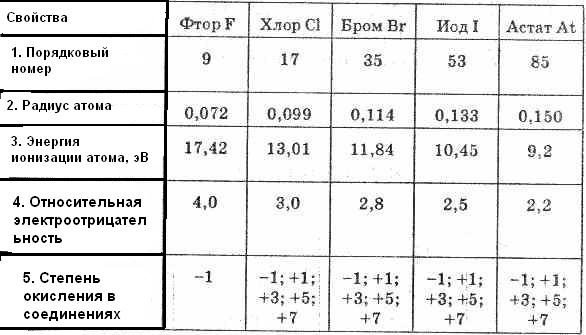
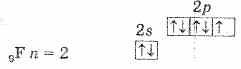
Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р-уровень. У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а его степень окисления всегда -1.
Электронное строение атома хлора выражается схемой:
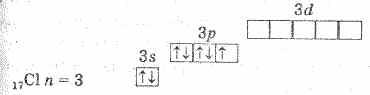
У атома хлора один неспаренный электрон на 3р-подуровне, и в обычном (невозбужденном) состоянии хлор одновалентен. Но поскольку хлор находится в третьем периоде, то у него имеются еще пять орбиталей 3d-подуровня, в которых могут разместиться 10 электронов.
В возбужденном состоянии атома электроны хлора переходят с3p- и3s-подуровней на 3d-подуровень (на схеме показано стрелками). Разъединение (распаривание) электронов, находящихся на одной орбитали, увеличивает валентность на две единицы. Очевидно, что хлор и его аналоги (кроме фтора) могут проявлять лишь нечетную переменную валентность 1,3,5,7 и соответствующие положительные степени окисления. У фтора нет свободных орбиталей, а значит, при химических реакциях не происходит разъединения спаренных электронов в атоме. Поэтому при рассмотрении свойств галогенов всегда надо учитывать особенности фтора.
В пределах каждого периода галогены являются наиболее электроотрицательными элементами, обладающими наибольшим сродством к электрону.
Внутри подгруппы галогенов переход от фтора к иоду сопровождается увеличением радиуса атома.
Элементы Подгруппы относятся к неметаллам; с увеличением заряда ядра от F к At неметаллические признаки ослабевают, o чем свидетельствуют уменьшение потенциалов ионизации и сродство к электрону.
Окислительно-восстановительные свойства и различия в химическом поведении галогенов легко понять, сравнивая эти свойства в зависимости от изменения заряда ядра при переходе от F к I. В ряду F, Cl, Br, I наибольшим радиусом атома (и, следовательно, наименьшим сродством к электрону) обладает I, поэтому он характеризуется менее выраженными окислительными свойствами, чем Br, Cl, F. Следовательно, окислительные свойства нейтральных атомов в подгруппе галогенов уменьшаются от F к I, а восстановительные усиливаются:

Связь Гал-Гал в молекулах простых веществ ковалентная неполярная. Длина связи в молекуле от F 2 к I 2 закономерно увеличивается. Энергия же связи изменяется следующим образом.
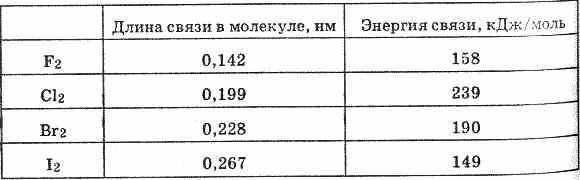
Энергия связи в молекуле F2 менее прочная, чем в молекуле Сl2. Это объясняется образованием в молекуле Сl2 и соответственно Br2 и I2 даттивной связи: когда общее энергетическое облако образуется за счет не только спаривания р-электронов, но и за счет уже имеющихся спаренных р-электронов одного атома и вакантной d-орбитали другого атома.
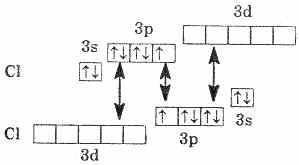
R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: — R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
2
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И НЕМЕТАЛЛОВ АТОМЫ классифицируют на МеталлыНеметаллы имеют Строение атома: — > R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: — R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
title=»ОБЩАЯ ХАРАКТЕРИСТИКА МЕТАЛЛОВ И НЕМЕТАЛЛОВ АТОМЫ классифицируют на МеталлыНеметаллы имеют Строение атома: — > R — от 1 до 3 е на внешнем энергетическом уровне Строение атома: —
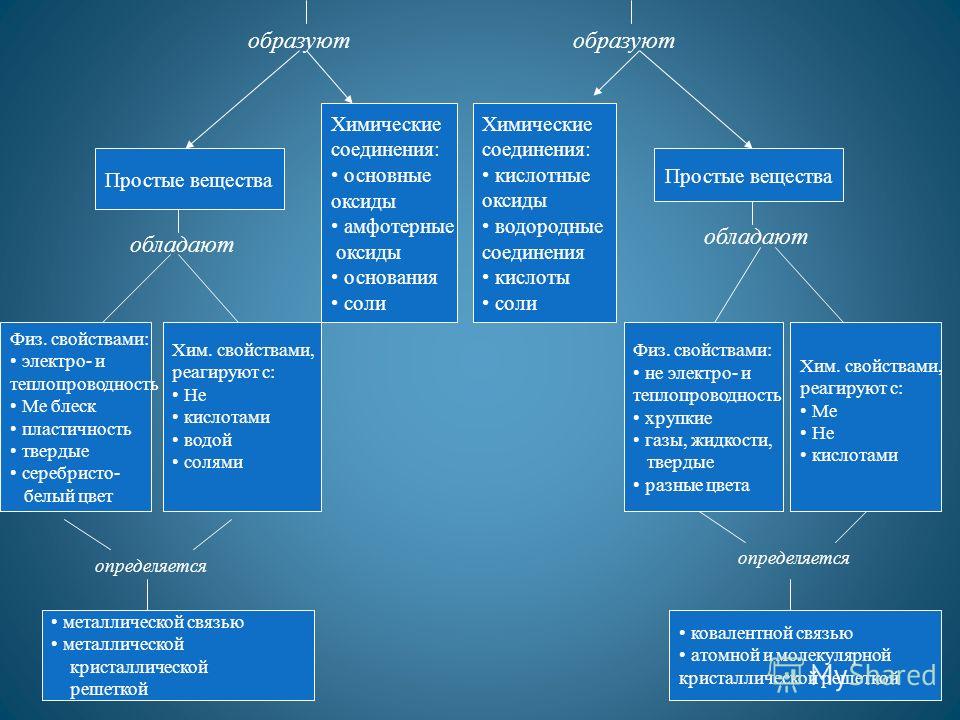
Образуют Простые вещества Химические соединения: основные оксиды амфотерные оксиды основания соли Химические соединения: кислотные оксиды водородные соединения кислоты соли Простые вещества обладают Физ. свойствами: электро- и теплопроводность Ме блеск пластичность твердые серебристо- белый цвет Хим. свойствами, реагируют с: Не кислотами водой солями Физ. свойствами: не электро- и теплопроводность хрупкие газы, жидкости, твердые разные цвета Хим. свойствами, реагируют с: Ме Не кислотами металлической связью металлической кристаллической решеткой ковалентной связью атомной и молекулярной кристаллической решеткой определяется
![]()


Строение: атомное (Si, В), молекулярное (Н 2, N 2, Br 2) Агрегатное состояние: – газы – H 2, O 2, O 3, N 2, F 2, Cl 2 ; – жидкость – Br 2 ; – твердые вещества – модификации серы, фосфора,кремния, углерода и др Большинство неметаллов не электропроводны, имеют низкую теплопроводность, а твердые вещества непластичны.
![]()
Аллотропия

Соотнесите: Среди пар веществ выбери «лишнюю»: а) белый и красный фосфор б) кислород и озон в) кремнезём и кварц г) алмаз и графит Неметаллические свойства наиболее выражены у простого вещества, образованного атомами: а) Фтор б) Кислород в) Кремний г) Азот Простое вещество 1. медь2. сера3. алмаз 4. Белый фосфор Кристаллическ ая решётка А) молекулярная Б) атомнаяВ)металлическ ая

Водородные соединения неметаллов B 2 H 6 диборан CH 4 метан NH 3 аммиак H 2 O вода HF фтороводород SiH 4 силан PH 3 фосфин H 2 S сероводород HCl хлороводород GeH 4 герман AsH 3 арсин H 2 Se селеноводород HBr бромоводород H 2 Te теллуроводород HI йодоводород

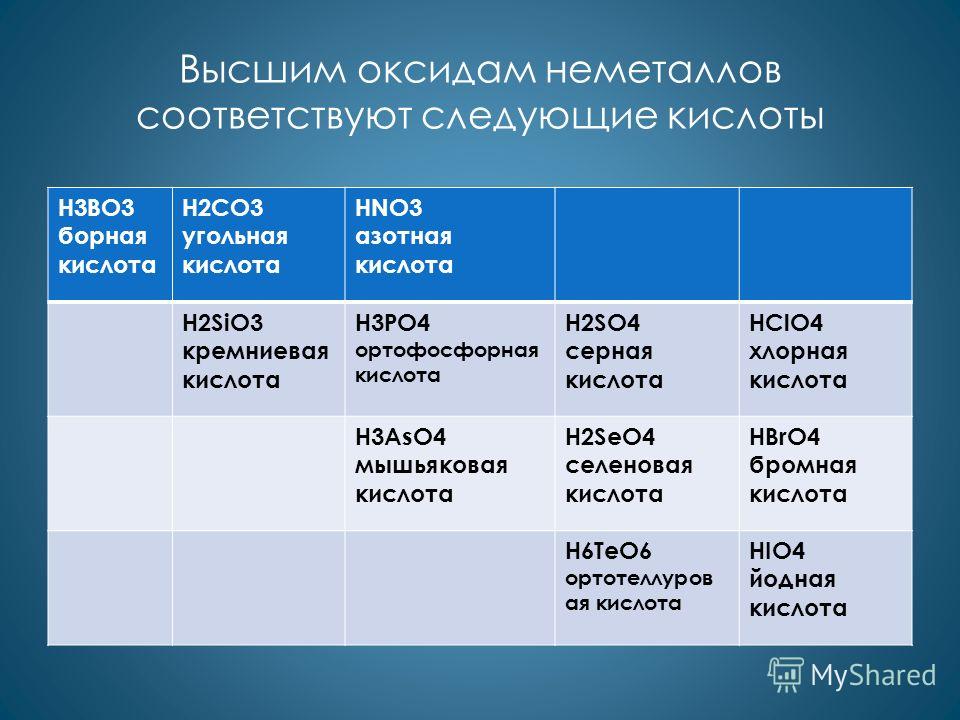
Высшим оксидам неметаллов соответствуют следующие кислоты H3BO3 борная кислота H2CO3 угольная кислота HNO3 азотная кислота H2SiO3 кремниевая кислота H3PO4 ортофосфорная кислота H2SO4 серная кислота HClO4 хлорная кислота H3AsO4 мышьяковая кислота H2SeO4 селеновая кислота HBrO4 бромная кислота H6TeO6 ортотеллуров ая кислота HIO4 йодная кислота

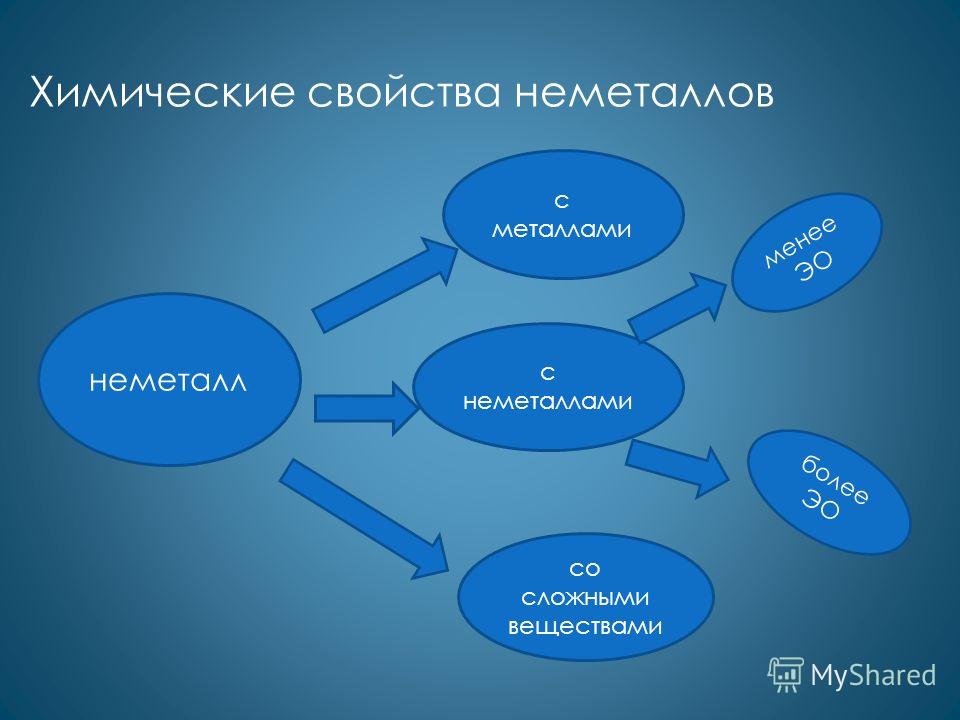
Характерными для большинства неметаллов являются окислительные свойства. Как окислители они реагируют с металлами: Ca + Cl 2 = CaCl 2 4Li + O 2 = 2Li 2 O 2Na + S = Na 2 S с менее электротрицательными неметаллами: H 2 + S = H 2 S P 4 + 5O 2 = 2P 2 O 5 2P + 5Cl 2 = 2PCl 5 со сложными веществами: 2FeCl 2 + Cl 2 = 2FeCl 3 CH 4 + Br 2 = CH 3 Br + HBr

Менее характерны для неметаллов восстановительные свойства. Как восстановители они реагируют с более электротрицательными неметаллами: Si + 2F 2 = SiF 4 C + O 2 = CO 2 C + 2S = CS 2 со сложными веществами: H 2 + HCHO = CH 3 OH 6P + 5KClO 3 = 5KCl + 3P 2 O 5


ВеществаОбщие свойстваОтличительные свойства Простые вещества – неметаллы 1. С металлами 2. С неметаллами 1. Галогены вытесняют друг друга с растворов солей. 2. Кислород реагирует со сложными веществами 3. Углерод реагирует с оксидами металлов 4. Углерод реагирует с углекислым газом 5. Кремний реагирует с растворами щелочей Химические свойства неметаллов и некоторых соединений

ВеществаОбщие свойстваОтличительные свойства Кислотные оксиды 1. С водой (кроме оксида кремния) 2. С основными оксидами 3. Со щелочами 1. Углекислый газ и оксид кремния реагируют с магнием 2. Оксид кремния реагирует с углеродом 3. Оксид кремния реагирует с солями, вытесняя более летучие оксиды Химические свойства неметаллов и некоторых соединений

ВеществаОбщие свойстваОтличительные свойства Кислоты 1. Изменяют окраску индикаторов 2. Реагируют с металлами 3. Реагируют с основными и амфотерными оксидами 4. С основаниями и амфотерными гидроксидами 5. С солями 1. Плавиковая кислота реагирует с оксидом кремния 2. Азотная и концентрированная серная кислоты по особому реагируют с металлами 3. При нагревании разлагаются азотная, угольная, кремниевая кислоты Химические свойства неметаллов и некоторых соединений

ВеществаОбщие свойстваОтличительные свойства Соли 1. С растворами солей 2. С кислотами 3. Со щелочами 1. При нагревании разлагаются нитраты, соли аммония, карбонаты (кроме карбонатов щелочных металлов) Химические свойства неметаллов и некоторых соединений

Урок по химии, 9класс.(О.С.Габриелян)
НЕМЕТАЛЛЫ. ОБ
