Какими свойствами обладают ферменты как белки

В каждой живой клетке происходит множество химических реакций. Ферменты (энзимы) – белки с особыми и крайне важными функциями. Их называют биокатализаторами. Основная функция белков-ферментов в организме заключается в ускорении биохимических реакций. Исходные реагенты, взаимодействие которых катализируется этими молекулами, именуются субстратами, а конечные соединения – продуктами.
В природе белки-ферменты работают только в живых системах. Но в современной биотехнологии, клинической диагностике, фармацевтике и медицине применяются очищенные энзимы или их комплексы, а также дополнительные компоненты, необходимые для работы системы и визуализации данных для исследователя.
Биологическое значение и свойства ферментов
Без этих молекул живой организм не смог бы функционировать. Все процессы жизнедеятельности слажено работают благодаря энзимам. Главная функция белков-ферментов в организме – регулирование обмена веществ. Без них невозможен нормальный метаболизм. Регуляция активности молекул происходит под действием активаторов (индукторов) или ингибиторов. Контроль действует на разных уровнях синтеза белков. Он также «работает» в отношении уже готовой молекулы.
Основное свойства белков-ферментов – специфичность к определенному субстрату. И, соответственно, способность катализировать только одну или реже ряд реакций. Обычно подобные процессы обратимы. За выполнение обоих функций ответственен один фермент. Но это еще не все.
Роль белков-ферментов существенна. Без них не протекают биохимические реакции. За счет действия ферментов появляется возможность реагентам преодолеть активационный барьер без существенных затрат энергии. В организме нет возможности нагреть температуру более 100 °С или использовать агрессивные компоненты наподобие химической лаборатории. Белок-фермент соединяется с субстратом. В связанном состоянии происходит модификация с последующим освобождением последнего. Именно так действуют все катализаторы, применяемые в химическом синтезе.
Какие уровни организации молекулы белка-фермента?
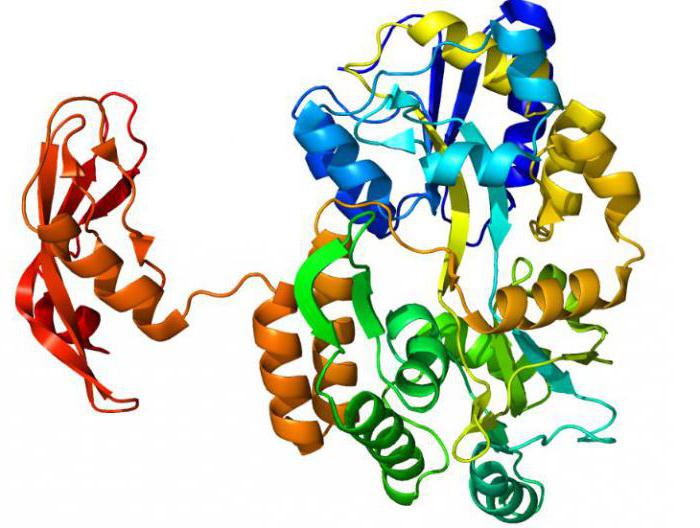
Обычно эти молекулы имеют третичную (глобула) или четвертичную (несколько соединенных глобул) белковую структуру. Сначала они синтезируются в линейном виде. А потом сворачиваются в требуемую структуру. Для обеспечения активности биокатализатору необходимо определенное строение.
Ферменты, как и другие белки, разрушаются при нагреве, экстремальных значениях pH, агрессивных химических соединений.
Дополнительные свойства ферментов
Среди них выделяют следующие особенности компонентов:
- Стереоспецифичность – образование только одного продукта.
- Региоселективность – разрыв химической связи или модификация группы только в одном положении.
- Хемоселективность – катализ только одной реакции.
Особенности работы
Уровень специфичности ферментов варьируется. Но любой энзим всегда активен в отношении конкретного субстрата или группы соединений, аналогичных по структуре. Небелковые катализаторы не обладают таким свойством. Специфичность измеряется константой связывания (моль/л), которая может достигать 10−10 моль/л. Работа активного фермента стремительна. Одна молекула катализирует тысячи-миллионы операций в секунду. Степень ускорения биохимических реакций существенно (в 1000-100000 раз) выше, чем у обычных катализаторов.
Действие ферментов построено на нескольких механизмах. Наиболее простое взаимодействие происходит с одной молекулой субстрата с последующим образованием продукта. Большинство энзимов способны связывать 2-3 разные молекулы, вступающие в реакцию. Например, перенос группы или атома от одного соединения к другому или двойное замещение по принципу «пинг-понг». В данных реакциях обычно соединяется один субстрат, а второй связывается посредством функциональной группы с ферментом.
Изучение механизма действия фермента происходит с помощью методов:
- Определения промежуточных и конечных продуктов.
- Изучения геометрии структуры и функциональных групп, связываемых с субстратом и обеспечивающих высокую скорость реакции.
- Мутации генов фермента и определения изменения в его синтезе и активности.
Активный и связывающий центр
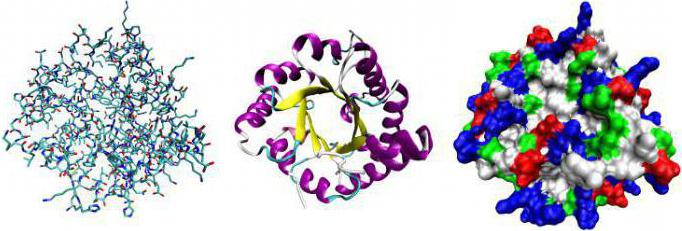
Молекула субстрата значительно меньше по размеру, чем белок-фермент. Поэтому связывание происходит за счет небольшого числа функциональных групп биокатализатора. Они формируют активный центр, состоящий из определенного набора аминокислот. В сложных белках в структуре присутствует простетическая группа небелковой природы, которая также может входить в состав активного центра.
Следует выделить отдельную группу энзимов. У них в состав молекулы входит кофермент, постоянно связывающийся с молекулой и освобождающийся от нее. Полностью сформированный белок-фермент называется холоферментом, а при удалении кофактора – апоферментом. В качестве коферментов часто выступают витамины, металлы, производные азотистых оснований (НАД – никотинамидадениндинуклеотид, ФАД – флавинадениндинуклеотид, ФМН – флавинмононуклеотид).
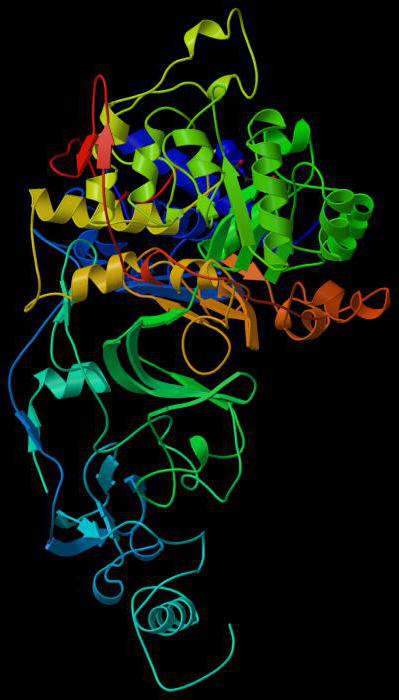
Связывающий центр обеспечивает специфичность сродства к субстрату. За счет него формируется устойчивый субстратно-ферментный комплекс. Структура глобулы построена так, чтобы иметь на поверхности нишу (щель или впадину) определенного размера, обеспечивающего связывание субстрата. Располагается эта зона обычно недалеко от активного центра. У отдельных ферментов есть участки для соединения с кофакторами или ионами металлов.
Заключение
Белок-фермент играет важную роль в организме. Подобные вещества катализируют химические реакции, отвечают за процесс обмена веществ — метаболизм. В любой живой клетке постоянно происходит сотни биохимических процессов, включающих восстановительные реакции, расщепление и синтез соединений. Постоянно происходит окисление веществ с большим выделением энергии. Она в свою очередь тратится на формирование углеводов, белков, жиров и их комплексов. Продукты расщепления являются структурными элементами для синтеза необходимых органических соединений.
В каждой клетке организме постоянно происходят сотни различных биохимических процессов. Все они сопровождаются распадом и окислением питательных веществ, поступающих извне.
Процессы сложные, многосоставные, и об их особенностях можно рассказывать долго. Но все они протекают быстро благодаря катализаторам биохимических реакций, которыми являются белки-ферменты.
Что они собой представляют? Какова их роль, свойства, функции? Об этом сейчас речь и пойдет.
Определение
Итак, белок-фермент – это совокупность сложных молекул белка и рибосом либо их целые комплексы. Именно они ускоряют все происходящие в живых системах химические реакции. Происходит это, разумеется, определенным образом.
Каждый фермент «свернут» в определенную структуру. И он ускоряет конкретную, соответствующую его характеристикам реакцию. Кстати, в таком «тандеме» реагенты именуют субстратами. А получившиеся в результате реакции вещества – продуктами.
Ферменты по отношению к субстратам весьма специфичны. Аденозинтрифосфатазы, например, катализируют исключительно отщепление остатков фосфорной кислоты от аденозинтрифосфорной. Другой пример – киназа фосфорилазы. Она, в свою очередь, переносит к субстрату остатки только фосфорной кислоты.

Регуляция активности
Белки-ферменты могут действовать по-разному. Их активность регулируется двумя типами веществ:
- Активаторы. Вследствие их воздействия активность повышается. При ассоциации с ДНК эти вещества усиливают транскрипцию определенного гена. Яркий пример – Gal8. Он активирует гены, которые ответственны за усвоение дрожжами галактозы.
- Ингибиторы. Они, как можно предположить, активность понижают, задерживая течение физико-химических и физиологических процессов. В качестве примера можно привести гидрохинон. Это ароматическое органическое соединение является ингибитором окисления бензальдегида.
К слову, синтезируются белки-ферменты на рибосомах. Эти органеллы производят их из аминокислот, основываясь на генетическую информацию.

Состав
Есть еще множество вопросов, касающихся белков-ферментов, расщепляющие различные вещества, поступающие в организм. Почему, например, их молекулы больше, чем у субстратов? И каким вообще образом аминокислоты, которые сами не могут ускорять химические реакции, создают мощнейшие каталитические системы, соединяясь в специфические последовательности?
Но зато медицине многое известно об их составе. Каждый фермент представляет собой соединение собственно белковых частей и связанные с ними активные центры. В их молекулах принято отличать активный А-центр – это место в пространственной структуре, с которым контактирует субстрат S. Также есть белковая часть – ее именуют либо апоэнзимом, либо апоферментом.
Можно еще объяснить иначе. Ферменты образованы из полипептидов – это такие вещества, которые состоят из остатков аминокислот. А те, в свою очередь, являются органическими соединениями, содержащие в себя как аминные, так и карбоксильные группы.
Специфика воздействия
Состоящие из остатков аминокислот белки-ферменты обеспечивают одну либо несколько однотипных реакций (каждый).
К примеру, жиры внутри клеток и в пищеварительном тракте расщепляются липазой. Это водорастворимый фермент, не действующий на белки и полисахариды. В то же время вещество, расщепляющее гликоген или крахмал, не оказывает никакого эффекта на жиры.
Интересно, что каждый молекула фермента осуществляет от нескольких тысяч до миллионов действий в минуту. В ходе этих процессов белок не расходуется вообще. Наоборот, он образует симбиоз с реагирующими веществами, ускоряя их превращения. После окончания он выходит из реакции в неизменном виде.
Свойства
Их тоже надо рассмотреть, изучая роль белков-ферментов. Вообще, свойства этих веществ можно выделить в такой список:
- Способность путем высаливания осаждаться из растворов.
- Амфотерность.
- Электрофоретическая подвижность.
- Способность к кристаллизации.
- Высокая специфичность действия.
- Зависимость реакции от рН-среды, активаторов, ингибиторов и температуры.
Последние качества обусловлены регулируемой активностью ферментов. Благодаря этой специфике удается изменять скорость превращения веществ вы зависимости от условий среды, в которых они находятся.
Интересно, что у некоторых белков-ферментов, расщепляющих жиры, углеводы и прочие элементы, есть стереохимическая специфичность. Так называется их способность катализировать превращение лишь одного стереоизомера субстрата. К примеру, фумароза способна расщепить исключительно транс-изомер-фумаровую кислоту. Взаимодействовать с cis-изомером она уже не будет.
Зависимость от температуры
Она довольно весомая. С повышением температуры на каждые десять градусов скорость ферментативной реакции увеличивается примерно в два-три раза.
Но, если сравнивать с минеральными катализаторами, то закономерность эта дает о себе знать только в конкретном температурном интервале, который может варьироваться от 0°C до 37-40 °C.
Когда же фермент начинает работать на максимуме? Наибольшая активность проявляется тогда, когда и температура достигает предела в 40 °C. Если она поднимется еще выше, то начнется денатурация.
Ферменты, подчиняющиеся данной закономерности, принято называть термолабильностью. Это – ключевое качество, отличающие белки от минеральных катализаторов.
Но есть среди ферментов термостабильные соединения, на которые высокие температуры негативно не воздействуют. Более того, некоторые из них их выдерживают, и даже под их влиянием проявлять максимальную активность. К таковым относится миокиназа мышц. Она сохранит активность даже в том случае, если температура достигнет 100 °C.
При 0 °C ферментативная реакция практически прекращается. Но это ингибирование обратимо. При нормальном температурном режиме активность вещества восстановится. Это доказывают ферменты, которые были выделены из туши мамонтов, годами находившихся в условиях ледникового периода. При создании нормальной температуры они проявляли хорошую активность.
А некоторые ферменты и при низкой температуре ее демонстрируют. Например, амилаза картофеля. При -4 °C она действует в разы более активно, чем при плюсовых показателях. Кстати, этим обусловлен сладковатый вкус слегка замерзшей картошки.

Классификация
Рассказывая об особенностях и функциях белков-ферментов, нужно отметить, что на данный момент известно более 2000 их видов. Но количество постоянно увеличивается.
Условно ферменты делятся на 6 групп. В качестве критерия классификации выступает характер реакций, который они вызывают.
Также стоит упомянуть, что процесс синтеза или расщепления какого-либо вещества в клетке обычно делится на ряд химических операций. Каждая из них выполняется отдельным белком-ферментом. Группы таких элементов составляют некий биохимический конвейер.
По сути, каждый фермент – это своеобразная молекулярная машина. Благодаря определенному расположению аминокислот и пространственной структуре своих компонентов, он имеет способность узнавать «свой» субстрат среди остальных. Поэтому присоединение выполняется мгновенно, что и обуславливает скорость химических реакций.
Обратные связи
Всем вышеперечисленным не ограничиваются свойства белков-ферментов. Не был отмечен вниманием еще один немаловажный нюанс.
Дело в том, что в белковых молекулах многих ферментов имеются участки, способные узнавать еще и конечный продукт – тот, который, так сказать, «сходит» с полиферментного биохимического конвейера.
Плохо, если его слишком много. Потому что в таком случае активность начального фермента начинает тормозиться. Ничем не лучше, если конечного продукта мало. Потому что тогда фермент активируется.
Собственно говоря, таким образом множество биохимических процессов и происходит. Это – обратные связи, обеспечивающие саморегуляцию. Если задуматься и провести параллель, то такие же принципы прослеживаются в работе современной технике. В природных механизмах, в живых клетках, все аналогично.
Сходство с минеральными катализаторами
Что же, исходя из вышесказанного, можно понять, какую функцию выполняют белки-ферменты. Теперь нужно немного поговорить об их сходствах с минеральными катализаторами. Можно выделить такой перечень:
- Ферменты проявляют свое действие в крайне небольших концентрациях. Амилаза способна ускорить гидролиз крахмала, будучи разведенной в пропорциях 1:1000000.
- В ходе катализируемой белком реакции он сам не расходуется, покидая ее в неизменном виде (это уже упоминалось ранее).
- Ферменты не смещают химическое равновесие. Эти вещества могут ускорить как обратную, так и прямую реакцию. Направленность определит концентрация исходных субстратов, а также конечных продуктов.
- Ферменты не способны инициировать реакцию. Они только влияют на скорость химических превращений.
- Они уменьшают уровень энергии активации. Ферменты могут обеспечить течение реакции, обойдя так называемый энергетический барьер.
Последний факт особенно интересен. Такая особенность обусловлена тем, что фермент в ходе своей реакции начинает взаимодействовать с субстратом, образуя промежуточное соединение – фермент-субстратный комплекс.
Что же происходит? Конформация субстрата меняется, ковалентные связи напрягаются, а потому энергии, необходимой для разрыва, требуется меньше.
Как можно видеть, казалось бы сложный процесс на самом деле можно очень просто объяснить, если вникнуть в подробности.
Тимоха Змановский · 30 января 2019
1,1 K
Имею естественно научное образование, в юношестве прикипел к литературе, сейчас…
Основные свойства ферментов:
- Каталитические
- Высокая специфичность действия
- Неустойчивость
- Зависимость от температуры
- Зависимость от pH
Чем отличаются детерминизм и фатализм? Каково принципиальное различие?
Закономерность или Судьба? Логика или Вера? Объективность или субъективность?
Детерминизм скорее о развитии, от причин к следствиям, которые в свою очередь, становятся причинами новых следствий и т.д..
Фатализм же скорее о деградации, следствиях, которые стремятся к итогу.
Конструктив и диструктив в оценке одного и того же явления, взимосвязи всего во всех измерениях.
Я бы сказал, принципиальное отличие в ограниченности.
Верят там, где знать не могут. Ведь в то что знаешь, верить уже ненужно.
Прочитать ещё 1 ответ
Откуда в человеческом организме берется АМФ для синтеза АДФ для синтеза АТФ?
АМФ в организме образуется из (парадоксально, но это так!, метаболизм идёт просто по выгодному на данный момент пути) АТФ и аденозина. На аденозин переносится один фосфорный остаток, в результате имеем АМФ (аденозин плюс 1 остаток фосфорной кислоты) и АДФ (аденозинтрифосфат минус 1 остаток фосфорной кислоты).
Однако основной путь синтеза АМФ в организме — de novo, то есть из более простых органических веществ и неорганических молекул. Так, АМФ производится поэтапно разными ферментами из аминокислот аспартата и глицина (поступают в организм с белковой пищей либо синтезируются в организме), глутамина (преобразуется из глицина), двух молекул тетрагидрофолата (с приёмом фолиевой кислоты с пищей), модифицированных разными углеводородными группами, и молекулы углекислого газа, получаемой из воздуха. Постепенно на аминокислотном остове синтезируется молекула ИМФ (инозитол-монофосфат), а из него АМФ. Только АМФ потом идёт на синтез ДНК и РНК, а АТФ синтезируется из АДФ. А АДФ синтезируется из АТФ. Вот так вот.
В каком виде железо лучше усваивается?
Врач-педиатр, диетолог. Работаю в клинике Doc+. Стаж по педиатрии с 2009 года. Дополнител… · health.yandex.ru
Лучше усваиваются препараты трехвалентного железа в форме гидроксид полимальтозного комплекса (мальтофер, феррум лек). Препараты железа лучше усваиваются в присутствии витамина С. То есть можно запивать их лимонным, апельсиновым, черносмородиновый соком или морсом, или другим напитком, с высоким содержанием витамина С. Не рекомендуется запивать препараты железа чаем, кофе, молочными напитками, так как содержащиеся в их составе вещества( танин, кальций) ухудшают усвоение железа.
Прочитать ещё 1 ответ
Какме функции в организме человека выполняет селезенка?
Знаток в области красоты, стиля, здоровья, фитнеса. Увлекаюсь кино и…
Селезенка — это своего рода «фильтр» в нашем организме. Селезенка поглощает и перерабатывает попадающие в кровь бактерии и другие вредные вещества, вырабатывая антибактериальные тела. Поэтому селезенка очень важна для поддержания иммунитета.
Кроме этого, в селезенке содержится «запас» крови, которая при необходимости поступает в системный кровоток организма. Селезенка вместе с этим является хранилищем железа, которое преобразуется в гемоглобин.
Прочитать ещё 3 ответа
Строение белков
Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).

Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Пептидная связь
Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).

Пространственная организация белковых молекул
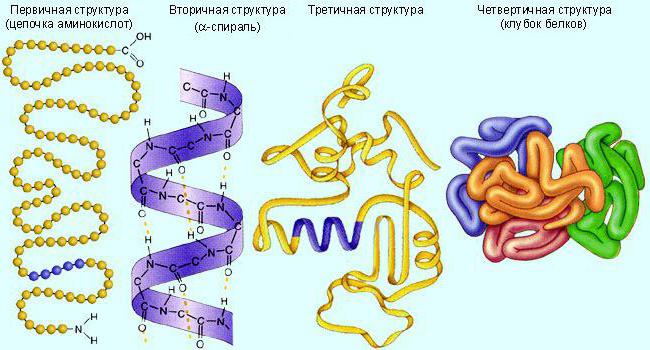
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.

Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).



Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.

Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Свойства белков
Купить проверочные работы
по биологии




Аминокислотный состав, структура белковой молекулы определяют его свойства. Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Функции белков
| Функция | Примеры и пояснения |
|---|---|
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Ферменты
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Скорость ферментативных реакций в десятки тысяч раз (а иногда и в миллионы) выше скорости реакций, идущих с участием неорганических катализаторов. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты — глобулярные белки, по особенностям строения ферменты можно разделить на две группы: простые и сложные. Простые ферменты являются простыми белками, т.е. состоят только из аминокислот. Сложные ферменты являются сложными белками, т.е. в их состав помимо белковой части входит группа небелковой природы — кофактор. У некоторых ферментов в качестве кофакторов выступают витамины. В молекуле фермента выделяют особую часть, называемую активным центром. Активный центр — небольшой участок фермента (от трех до двенадцати аминокислотных остатков), где и происходит связывание субстрата или субстратов с образованием фермент-субстратного комплекса. По завершении реакции фермент-субстратный комплекс распадается на фермент и продукт (продукты) реакции. Некоторые ферменты имеют (кроме активного) аллостерические центры — участки, к которым присоединяются регуляторы скорости работы фермента (аллостерические ферменты).

Для реакций ферментативного катализа характерны: 1) высокая эффективность, 2) строгая избирательность и направленность действия, 3) субстратная специфичность, 4) тонкая и точная регуляция. Субстратную и реакционную специфичность реакций ферментативного катализа объясняют гипотезы Э. Фишера (1890 г.) и Д. Кошланда (1959 г.).
Э. Фишер (гипотеза «ключ-замок») предположил, что пространственные конфигурации активного центра фермента и субстрата должны точно соответствовать друг другу. Субстрат сравнивается с «ключом», фермент — с «замком».
Д. Кошланд (гипотеза «рука-перчатка») предположил, что пространственное соответствие структуры субстрата и активного центра фермента создается лишь в момент их взаимодействия друг с другом. Эту гипотезу еще называют гипотезой индуцированного соответствия.
Скорость ферментативных реакций зависит от: 1) температуры, 2) концентрации фермента, 3) концентрации субстрата, 4) рН. Следует подчеркнуть, что поскольку ферменты являются белками, то их активность наиболее высока при физиологически нормальных условиях.
Большинство ферментов может работать только при температуре от 0 до 40 °С. В этих пределах скорость реакц
