Какими свойствами обладает рубидий

В 1861 году недавно изобретенный физический метод исследования веществ – спектральный анализ – еще раз продемонстрировал свое могущество и надежность, как залог большого будущего в науке и технике. С его помощью был открыт уже второй неизвестный ранее химический элемент – рубидий. Затем, с открытием в 1869 году Д. И. Менделеевым периодического закона, рубидий вместе с другими элементами занял свое место в таблице, которая внесла порядок в химическую науку.
Дальнейшее изучение рубидия показало, что этот элемент обладает целым рядом интересных и ценных свойств. Мы рассмотрим здесь наиболее характерные и важные из них.
Общая характеристика химического элемента
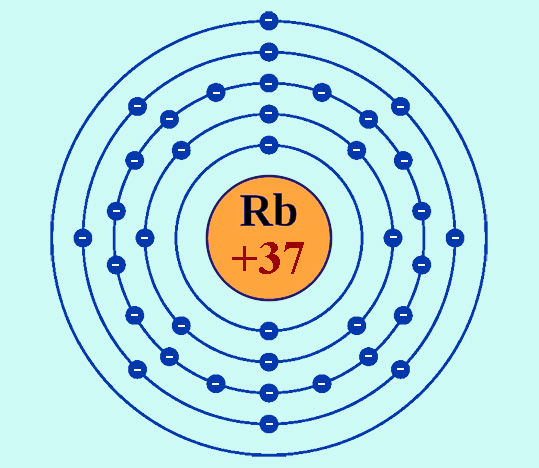
Рубидий имеет атомный номер 37, то есть в атомах его в состав ядер входит именно такое количество положительно заряженных частиц – протонов. Соответственно нейтральный атом обладает 37 электронами.
Символ элемента — Rb. В периодической системе рубидий классифицируется как элемент I группы, период – пятый (в короткопериодном варианте таблицы он относится к главной подгруппе I группы и расположен в шестом ряду). Является щелочным металлом, представляет собой мягкое, очень легкоплавкое кристаллическое вещество серебристо-белого цвета.
История обнаружения
Честь открытия химического элемента рубидий принадлежит двум немецким ученым – химику Роберту Бунзену и физику Густаву Кирхгофу, авторам спектроскопического метода изучения состава вещества. После того, как в 1860 году применение спектрального анализа привело к открытию цезия, ученые продолжили исследования, и уже в следующем году при изучении спектра минерала лепидолита ими были обнаружены две неотождествленные линии темно-красного цвета. Именно благодаря характерному оттенку наиболее сильных спектральных линий, по которым удалось установить существование неизвестного ранее элемента, он и получил свое название: слово rubidus переводится с латыни как «багровый, темно-красный».
В 1863 году Бунзен впервые выделил из воды минерального источника металлический рубидий путем упаривания большого количества раствора, разделения солей калия, цезия и рубидия и, наконец, восстановления металла с использованием сажи. Позднее Н. Бекетов сумел восстановить рубидий из его гидроксида с помощью порошка алюминия.
Физическая характеристика элемента
Рубидий – легкий металл, он имеет плотность 1,53 г/см3 (при нулевой температуре). Образует кристаллы с кубической объемно-центрированной решеткой. Плавится рубидий всего при 39 °C, то есть при комнатной температуре его консистенция уже близка к пастообразной. Металл кипит при 687 °C, пары его имеют зеленовато-синий оттенок.
Рубидий – парамагнетик. По проводимости он более чем в 8 раз превосходит ртуть при 0 °C и почти во столько же раз уступает серебру. Подобно другим щелочным металлам, рубидий отличает очень низкий порог фотоэффекта. Для возбуждения фототока в нем достаточно уже длинноволновых (то есть низкочастотных и несущих меньшую энергию) красных световых лучей. В этом отношении по чувствительности его превосходит лишь цезий.

Изотопы
Рубидий имеет атомный вес 85,468. В природе встречается в виде двух изотопов, различающихся количеством нейтронов в ядре: рубидий-85 составляет наибольшую долю (72,2%), и в значительно меньшем количестве – 27,8% – рубидий-87. Ядра их атомов, помимо 37 протонов, содержат соответственно по 48 и по 50 нейтронов. Более легкий изотоп стабилен, а рубидий-87 имеет огромный по длительности период полураспада – 49 миллиардов лет.
В настоящее время искусственным путем получено несколько десятков радиоактивных изотопов этого химического элемента: от сверхлегкого рубидия-71 до перегруженного нейтронами рубидия-102. Периоды полураспада искусственных изотопов варьируют от нескольких месяцев до 30 наносекунд.

Основные химические свойства
Как было отмечено выше, в ряду химических элементов рубидий (как натрий, калий, литий, цезий и франций) относится к щелочным металлам. Особенность электронной конфигурации их атомов, определяющая химические свойства – это наличие только одного электрона на внешнем энергетическом уровне. Этот электрон легко покидает атом, а ион металла при этом приобретает энергетически выгодную электронную конфигурацию стоящего перед ним в таблице Менделеева инертного элемента. Для рубидия это – конфигурация криптона.
Таким образом, рубидий, как и прочие щелочные металлы, имеет ярко выраженные восстановительные свойства и степень окисления +1. Щелочные свойства сильнее проявляются с увеличением атомного веса, поскольку при этом растет и радиус атома, и, соответственно, ослабляется связь внешнего электрона с ядром, что обусловливает повышение химической активности. Поэтому рубидий активнее лития, натрия и калия, а цезий, в свою очередь, активнее рубидия.
Суммируя все вышесказанное о рубидии, разбор элемента можно произвести, как на иллюстрации, представленной ниже.

Соединения, образуемые рубидием
На воздухе этот металл ввиду своей исключительной реакционной активности окисляется бурно, с воспламенением (пламя имеет фиолетово-розоватый цвет); в ходе реакции образуются надпероксид и пероксид рубидия, проявляющие свойства сильных окислителей:
- Rb + O2 → RbO2.
- 2Rb + O2 → Rb2O2.
Оксид образуется в том случае, если доступ кислорода к реакции ограничен:
- 4Rb + O2 → 2Rb2O.
Это вещество желтого цвета, реагирующее с водой, кислотами и кислотными оксидами. В первом случае образуется одна из наиболее сильных щелочей – гидроксид рубидия, в остальных – соли, например, сульфат рубидия Rb2SO4, большинство которых растворимы.

Еще более бурно, сопровождаясь взрывом (так как мгновенно воспламеняются и рубидий, и освобождаемый водород), протекает реакция металла с водой, в которой образуется гидроксид рубидия, чрезвычайно агрессивное соединение:
- 2Rb + 2H2O → 2RbOH +H2.
Рубидий – химический элемент, способный также непосредственно реагировать со многими неметаллами – с фосфором, водородом, углеродом, кремнием, с галогенами. Галогениды рубидия – RbF, RbCl, RbBr, RbI – хорошо растворимы в воде и в некоторых органических растворителях, например, в этаноле или в муравьиной кислоте. Взаимодействие металла с серой (растирание с серным порошком) происходит взрывообразно и приводит к образованию сульфида.

Существуют и малорастворимые соединения рубидия, такие как перхлорат RbClO4, они находят применение в аналитике для определения этого химического элемента.
Нахождение в природе
Рубидий – элемент, не относящийся к редким. Встречается он практически везде, входит в состав множества минералов и горных пород, а также содержится в океане, в подземных и речных водах. В земной коре содержание рубидия достигает суммарного значения содержания меди, цинка и никеля. Однако, в отличие от многих гораздо более редких металлов, рубидий – чрезвычайно рассеянный элемент, его концентрация в породе очень низка, и он не образует собственных минералов.
В составе полезных ископаемых рубидий повсеместно сопутствует калию. Наибольшей концентрацией рубидия отличаются лепидолиты – минералы, служащие также источником лития и цезия. Так что рубидий в небольших количествах всегда присутствует там, где обнаруживаются другие щелочные металлы.

Немного о применении рубидия
Краткую характеристику хим. элемента рубидия можно дополнить несколькими словами о том, в каких областях используется этот металл и его соединения.
Рубидий находит применение в производстве фотоэлементов, в лазерной технике, входит в состав некоторых специальных сплавов для ракетной техники. В химической промышленности соли рубидия используются благодаря высокой каталитической активности. Один из искусственных изотопов, рубидий-86, применяется в гамма-дефектоскопии и, кроме того, в фармацевтической промышленности для стерилизации лекарственных препаратов.
Еще один изотоп, рубидий-87, используют в геохронологии, где он служит для определения возраста древнейших горных пород благодаря очень большому периоду полураспада (рубидий-стронциевый метод).
Если несколько десятков лет назад считалось, что рубидий – химический элемент, область применения которого едва ли будет расширяться, то в настоящее время для этого металла появляются все новые перспективы, например, в катализе, в высокотемпературных турбоагрегатах, в специальной оптике и в других сферах. Так что в современных технологиях рубидий играет и будет продолжать играть важную роль.
Рубидий – металл, имя которого напоминает название драгоценного камня рубин. Минерал красный. Это оправдывает его имя, переводимое как «алый».
Рубидий же серебристо-серый. В чем подвох? В истории обнаружения металла. Его выделили из минерала лепидолита.

Разложив камень по составным, химики «потеряли» 2,5% массы. Сначала, списали на испарившуюся при реакциях воду.
Потом, решили провести спектральный анализ. Обнаружилась линия темно-красного цвета.
Известные науки элементы такой не обладали. Так, в 1863-ем году и был открыт металл рубидий. Что человечеству удалось узнать о нем за полтора минувших столетия, расскажем далее.
Химические и физические свойства рубидия
Рубидий металлический образует кристаллы. Они напоминают кубы. Характерный для металлов блеск просматривается лишь на срезе агрегатов.
Разрезать их не проблема, — материал мягкий, словно сыр. Это особенность большинства щелочных металлов, к коим относится и рубидий. Формула его характеризуется одним электроном на внешнем уровне.
Всего их 5. Неудивительно, что элемент является мощным восстановителем, активен в химическом плане. Отдаленный от ядра электрон легко замещается.
Так образуются все виды солей, к примеру, хлорид рубидия. Как и остальные соединения, он легко растворим в воде.
В природе выявлено два изотопа 37-го элемента таблицы Менделеева. 85-ый атом рубидия стабилен, а вот 87-ой – радиоактивен, хоть и слабо.
После полного распада 87-ой изотоп преобразуется в стабильную разновидность стронция. В искусственных условиях элемент рубидий дал 20 изотопов.
Все радиоактивные. Номера изотопов равны их атомной массе. Если она меньше 85-ти, испускаются лучи бета+.
Такой рубидий, зачастую, распадается за несколько минут, а порой, и секунд. Наиболее устойчив 81-ый изотоп.
Его полураспад составляет 4 часа. После, выделяется криптон. Это газ, тоже радиоактивный.

Если металл входит в соединения с другими, то всегда одновалентен, то есть образует лишь одну химическую связь с другим атомом.
Степень окисления при этом равна +1. Оксид рубидия образуется лишь в условиях нехватки кислорода.
Если же его достаточно, идет бурная реакция, итогом которой становится пероксид и надпероксид 37-го элемента.
В кислородной среде щелочной металл рубидий загорается. В этом и заключается буйство реакции.
Еще опаснее сочетание с водой. Происходит взрыв. Осторожничать приходится и с карбидом рубидия.
Химический элемент в веществе способен самовоспламениться в углекислой среде. В воде соединение, как и чистый металл, взрывается.
Рубидий, при этом, сгорает. Остается лишь углерод. Он выделяется в виде угля. Так что, это один из способов добычи топлива.
Применение рубидия
Первое применение элементу нашла природа. Она заложила 1 миллиграмм металла в организм каждого человека.
Рубидий есть в костях, легких, головном мозге, женских яичниках, крови. 37-ой элемент выполняет роль антиаллергена, оказывает противовоспалительное действие, слегка затормаживает, успокаивая нервы.
В крови рубидий, цвет спектральной черты которого сливается с тоном эритроцитов, борется со свободными радикалами.
Металл снижает и действие окислителей. Благодаря этому, клетки крови живут дольше и лучше функционируют. Повышается иммунитет, уровень гемоглобина.
Медики прописывают препараты рубидия в качестве болеутоляющих и снотворных.
Кроме этого, 37-ой элемент получают эпилептики. Врачи рассчитывают на тормозящее нервные импульсы действие препарата.
Рубидий выводится из организма вместе с мочой. Поэтому, требуется восполнение. Суточная норма потребления элемента – 1-2 миллиграмма.
Получить их можно, употребляя бобовые, злаки, орехи, белые грибы, почти все фрукты и ягоды, особенно, черную смородину.
Вне организма рубидий присутствует в телевизионных трубках, устройствах, воспроизводящих оптические фонограммы и в фотокатодах.
Причина – фотоэффект. На него 37-ой элемент способен благодаря быстрой потере электронов под действием света.
Аналогично поведение цезия. Рубидий соперничает с ним за место на рынке фотоэлементов.
Фторид рубидия, как и прочие соли элемента, закладывают в топливные элементы. Соединения 37-го металла служит в них электролитом.
Электролитом является, так же, гидроксид рубидия. Он рекомендован для низкотемпературных химически источников тока.
Убыстрить его течение 37-ой элемент способен в качестве добавки к раствору гидроксида калия.
В роли катализатора выступает уже карбонат рубидия. Его закупают для производства синтетической нефти. Ее называют синтолом.
Специальные катализаторы с рубидием запатентованы для синтеза высших спиртов, стирола и бутадеина.

Нитрат рубидия признан средством для калибровки калориметров. Это приборы, замеряющие количество теплоты.
Техника засекает и ее выделение, и поглощение при различных химических, физических, биологических процессах.
Не обходится без рубидия и атомная промышленность. 37-ой элемент числится в составе металлических теплоносителей.
Они заключены в ядерных реакторах. Есть рубидий и в вакуумных радиолампах. Металл формирует положительные ионы на их нитях накаливания.
В космической отрасли металлический рубидий входит в состав смесей для смазки. Обнаружить 37-ой элемент можно даже в термометрах.
Речь не о ртутных образцах, а о моделях для измерения повышенных температур до 400-от градусов Цельсия. В таких термометрах находится смесь хлоридов меди и рубидия.
Электронная отрасль использует пары щелочного металла. С ними, в частности, связано изготовление высокочувствительных магнитометров. Ими пользуются при космических исследованиях и геофизических изыскания.
Добыча рубидия
Рубидий – рассеянный элемент. Это усложняет разработку солидных запасов. По распространенности в земной коре металл занимает 20-е место.
Однако, у него нет собственных минералов и руд, то есть пород, в которых рубидий является основой.
В том же лепидолите, из которого элемент когда-то выделили, он присутствует лишь в качестве примеси.
Искать рубидий приходится попутно с другими щелочными металлами. Можно использовать и морскую воду. В ней растворены соли 37-го элемента. Но, пока, этот ресурс не разрабатывается.
Промышленное получение рубидия – это выделение из электролита, оставшегося после производства магния. Его добывают из карналлита.
Остается осадок из ферроцианидов, железа и никеля. Рубидий скрыт в первых. Ферроцианиды прокаливают, получая карбонат 37-го металла. Он загрязнен цезием и калием. Остается провести очистку.

Немало рубидия извлекают на производстве лития. После его выделения, 37-ой элемент осаждают из маточных растворов.
Итог операции – алюморубидиевые квасцы. После их многократной перекристаллизации удается разделить составляющие.
Поскольку с 50-ых годов прошлого века производство лития резко увеличилось, увеличилось и предложение на рубидий.
Он перестал быть дорогостоящим дефицитом. Узнаем, во сколько оценивают металл современники.
Цена рубидия
В России рубидий производят на Заводе редких металлов. Предприятие находится в Новосибирской области, реализует упаковки по 30 граммов и 1-му килограмму.
За последний объем придется выложить около 400 000 рублей. Частные продавцы предлагают рубидий, разделенный по граммам.
За один просят, как правило, 5-6 долларов США. Вот и посчитайте. При этом, раньше цены на 37-ой элемент были еще выше.
Но, рекордсменом рубидий, все же, не являлся. Передовик – калифорний. Это самый редкий и самый дорогой металл.
Стоимость грамма превышает 6 000 000 долларов. В сравнении с этим ценником, запросы поставщиков за рубидий кажутся незначительными.
Кстати, кроме Новосибирского завода 37-ым элементом торгует и Сервермед из Мурманской области.
| Рубидий | |
|---|---|
| Мягкий, серебристо-белый металл | |
 Образец рубидия | |
| Название, символ, номер | Рубидий / Rubidium (Rb), 37 |
| Атомная масса (молярная масса) | 85,4678(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 5s1 |
| Радиус атома | 248 пм |
| Ковалентный радиус | 216 пм |
| Радиус иона | (+1e)147 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Электродный потенциал | −2,925 |
| Степени окисления | 0; +1 |
| Энергия ионизации (первый электрон) | 402,8 (4,17) кДж/моль (эВ) |
| Плотность (при н. у.) | 1,532 г/см³ |
| Температура плавления | 39,05 °C |
| Температура кипения | 688 °C |
| Уд. теплота плавления | 2,20 кДж/моль |
| Уд. теплота испарения | 75,8 кДж/моль |
| Молярная теплоёмкость | 31,1 Дж/(K·моль) |
| Молярный объём | 55,9 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 5,710 Å |
| Температура Дебая | 56 K |
| Теплопроводность | (300 K) 58,2 Вт/(м·К) |
| Номер CAS | 7440-17-7 |
Рубидий — элемент главной подгруппы первой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 37. Обозначается символом Rb (лат. Rubidium). Простое вещество рубидий — мягкий легкоплавкий щелочной металл серебристо-белого цвета.
Металлический рубидий имеет сходство с металлическим калием и металлическим цезием по внешнему виду, мягкости и проводимости. Рубидий нельзя хранить на открытом воздухе, так как будет происходить сильно экзотермическая реакция, иногда даже приводящая к воспламенению металла. Рубидий является первым щелочным металлом в группе, плотность которого выше, чем у воды, поэтому он тонет, в отличие от металлов над ним в группе.
История
В 1861 году немецкие учёные Роберт Вильгельм Бунзен и Густав Роберт Кирхгоф, изучая с помощью спектрального анализа природные алюмосиликаты, обнаружили в них новый элемент, впоследствии названный рубидием по цвету наиболее сильных линий спектра. Название, которое происходит от латинского слова rubidus, что означает «насыщенно красный».
Рубидий имел минимальную промышленную ценность до 1920-х годов. С тех пор наиболее важным применением рубидия являются исследования и разработки, главным образом в области химии и электроники. В 1995 году рубидий-87 был использован для получения конденсата Бозе-Эйнштейна, за который первооткрыватели Эрик Аллин Корнелл, Карл Виман и Вольфганг Кеттерле получили в 2001 году Нобелевскую премию по физике.
Обнаружение радиоактивности рубидия
Природная радиоактивность рубидия была открыта Кемпбеллом и Вудом в 1906 году с помощью ионизационного метода и подтверждена В. Стронгом в 1909 году с помощью фотоэмульсии. В 1930 году Л. В. Мысовский и Р. А. Эйхельбергер с помощью камеры Вильсона показали, что эта радиоактивность сопровождается испусканием бета-частиц. Позже было показано, что она обусловлена бета-распадом природного изотопа 87Rb.
Происхождение названия
Название дано по цвету наиболее характерных красных линий спектра (от лат. rubidus — красный, тёмно-красный).
Нахождение в природе
Мировые ресурсы рубидия
Содержание рубидия в земной коре составляет 7,8⋅10−3 %, что примерно равно суммарному содержанию никеля, меди и цинка. По распространённости в земной коре рубидий находится примерно на 23-м месте, примерно также распространённым как цинк, и более распространенным, чем медь. Однако, в природе он находится в рассеянном состоянии, рубидий — типичный рассеянный элемент. Собственные минералы рубидия неизвестны. Рубидий встречается вместе с другими щелочными элементами, он всегда сопутствует калию. Обнаружен в очень многих горных породах и минералах, найденных, в частности, в Северной Америке, Южной Африке и России, но его концентрация там крайне низка. Только лепидолиты содержат несколько больше рубидия, иногда 0,3 %, а изредка и до 3,5 % (в пересчете на Rb2O).
Соли рубидия растворены в воде морей, океанов и озёр. Концентрация их и здесь очень невелика, в среднем порядка 125 мкг/л, что меньше чем значение для калия — 408 мкг/л. В отдельных случаях содержание рубидия в воде выше: в Одесских лиманах оно оказалось равным 670 мкг/л, а в Каспийском море — 5700 мкг/л. Повышенное содержание рубидия обнаружено и в некоторых минеральных источниках Бразилии.
Из морской воды рубидий перешёл в калийные соляные отложения, главным образом, в карналлиты. В страссфуртских и соликамских карналлитах содержание рубидия колеблется в пределах от 0,037 до 0,15 %. Минерал карналлит — сложное химическое соединение, образованное хлоридами калия и магния с водой; его формула — KCl·MgCl2·6H2O. Рубидий даёт соль аналогичного состава RbCl·MgCl2·6H2O, причём обе соли — калиевая и рубидиевая — имеют одинаковое строение и образуют непрерывный ряд твёрдых растворов, кристаллизуясь совместно. Карналлит хорошо растворим в воде, потому вскрытие минерала не составляет большого труда. Сейчас разработаны и описаны в литературе рациональные и экономичные методы извлечения рубидия из карналлита, попутно с другими элементами.
Месторождения
Минералы, содержащие рубидий (лепидолит, циннвальдит, поллуцит, амазонит), находятся на территории Германии, Чехии, Словакии, Намибии, Зимбабве, Туркмении и других странах.
В космосе
Аномально высокое содержание рубидия наблюдается в объектах Торна — Житков (состоящих из красного гиганта или сверхгиганта, внутри которого находится нейтронная звезда).
Получение
Большую часть добываемого рубидия получают как побочный продукт при производстве лития из лепидолита. После выделения лития в виде карбоната или гидроксида рубидий осаждают из маточных растворов в виде смеси алюморубидиевых, алюмокалиевых и алюмоцезиевых квасцов RbAl(SO4)2·12H2O, KAl(SO4)2·12H2O, CsAl(SO4)2·12H2O. Смесь разделяют многократной перекристаллизацией.
Рубидий также выделяют и из отработанного электролита, получающегося при получении магния из карналлита. Из него рубидий выделяют сорбцией на осадках ферроцианидов железа или никеля. Затем ферроцианиды прокаливают и получают карбонат рубидия с примесями калия и цезия. При получении цезия из поллуцита рубидий извлекают из маточных растворов после осаждения Cs3[Sb2Cl9]. Можно извлекать рубидий и из технологических растворов, образующихся при получении глинозёма из нефелина.
Для извлечения рубидия используют методы экстракции и ионообменной хроматографии. Соединения рубидия высокой чистоты получают с использованием полигалогенидов.
Значительную часть производимого рубидия выделяют в ходе получения лития, поэтому появление большого интереса к литию для использования его в термоядерных процессах в 1950-х и в аккумуляторах в 2000-x привело к увеличению добычи лития, а, следовательно, и рубидия. Именно поэтому соединения рубидия стали более доступными.
Физические свойства
Рубидий образует серебристо-белые мягкие кристаллы, имеющие на свежем срезе металлический блеск. Твёрдость по Бринеллю 0,2 МН/м² (0,02 кгс/мм²).
Кристаллическая решётка рубидия кубическая объёмно-центрированная, а = 5,71 Å (при комнатной температуре).
Атомный радиус 2,48 Å, радиус иона Rb+ 1,49 Å.
Плотность 1,525 г/см³ (0 °C), температура плавления 38,9 °C, температура кипения 703 °C.
Удельная теплоемкость 335,2 Дж/(кг·К) [0,08 кал/(г·°С)], термический коэффициент линейного расширения 9,0⋅10−5 K−1 (при 0—38 °C), модуль упругости 2,4 ГН/м² (240 кгс/мм²), удельное объёмное электрическое сопротивление 11,29⋅10−6 ом·см (при 20 °C); рубидий парамагнитен.
Химические свойства
Щелочной металл, крайне неустойчив на воздухе (реагирует с воздухом в присутствии следов воды с воспламенением). Образует все виды солей — большей частью легкорастворимые.
Соединения рубидия
Гидроксид рубидия RbOH — весьма агрессивное вещество к стеклу и другим конструкционным и контейнерным материалам, а расплавленный RbOH разрушает большинство металлов.
Применение
Хотя в ряде областей применения рубидий уступает цезию, этот редкий щелочной металл играет важную роль в современных технологиях. Можно отметить следующие основные области применения рубидия: катализ, электронная промышленность, специальная оптика, атомная промышленность, медицина (его соединения обладают нормотимическими свойствами).
Рубидий используется не только в чистом виде, но и в виде ряда сплавов и химических соединений. Он образует амальгамы с ртутью и сплавы с золотом, железом, цезием, натрием и калием, но не литием (хотя рубидий и литий находятся в одной группе). Рубидий имеет хорошую сырьевую базу, более благоприятную, чем для цезия. Область применения рубидия в связи с ростом его доступности расширяется.
Изотоп рубидий-86 широко используется в гамма-дефектоскопии, измерительной технике, а также при стерилизации лекарств и пищевых продуктов. Рубидий и его сплавы с цезием — это весьма перспективный теплоноситель и рабочая среда для высокотемпературных турбоагрегатов (в этой связи рубидий и цезий в последние годы приобрели важное значение, и чрезвычайная дороговизна металлов уходит на второй план по отношению к возможностям резко увеличить КПД турбоагрегатов, а значит, и снизить расходы топлива и загрязнение окружающей среды). Применяемые наиболее широко в качестве теплоносителей системы на основе рубидия — это тройные сплавы: натрий-калий-рубидий, и натрий-рубидий-цезий.
В катализе рубидий используется как в органическом, так и неорганическом синтезе. Каталитическая активность рубидия используется в основном для переработки нефти на ряд важных продуктов. Ацетат рубидия, например, используется для синтеза метанола и целого ряда высших спиртов из водяного газа, что актуально в связи с подземной газификацией угля и в производстве искусственного жидкого топлива для автомобилей и реактивного топлива. Ряд сплавов рубидия с теллуром обладают более высокой чувствительностью в ультрафиолетовой области спектра, чем соединения цезия, и в связи с этим он способен в этом случае составить конкуренцию цезию как материал для фотопреобразователей. В составе специальных смазочных композиций (сплавов) рубидий применяется как высокоэффективная смазка в вакууме (ракетная и космическая техника).
Гидроксид рубидия применяется для приготовления электролита для низкотемпературных химических источников тока, а также в качестве добавки к раствору гидроксида калия для улучшения его работоспособности при низких температурах и повышения электропроводности электролита. В гидридных топливных элементах находит применение металлический рубидий.
Хлорид рубидия в сплаве с хлоридом меди находит применение для измерения высоких температур (до 400 °C).
Пары рубидия используются как рабочее тело в лазерах, в частности, в рубидиевых атомных часах.
Хлорид рубидия применяется в топливных элементах в качестве электролита, то же можно сказать и о гидроксиде рубидия, который очень эффективен как электролит в топливных элементах, использующих прямое окисление угля.
Соединения рубидия иногда используются в фейерверках, чтобы придать им фиолетовый цвет.
Биологическая роль
Рубидий относится к элементам с недостаточно изученной биологической ролью. Обычно рубидий рассматривают совместно с цезием, поэтому их роль в организме человека изучается параллельно.
Рубидий в качестве микроэлемента
Рубидий постоянно присутствует в тканях растений и животных. В земных растениях содержится всего около 0,000064% рубидия, а в морских — ещё меньше. Однако рубидий способен накапливаться в растениях, а также в мышцах и мягких тканях актиний, ракообразных, червей, рыб и иглокожих, причём величина коэффициента накопления составляет от 8 до 26. Наибольший коэффициент накопления (2600) искусственного радиоактивного изотопа 86Rb обнаружен у ряски Lemna polyrrhiza, а среди пресноводных беспозвоночных — Galba palustris. Физиологическая роль рубидия заключается в его способности ингибировать простагландины PGE1 и PGE2, PGE2-альфа и в наличии антигистаминных свойств.
Метаболизм рубидия
Обмен рубидия в организме человека ещё не до конца изучен. Ежедневно в организм человека с пищей поступает до 1,5-4,0 мг рубидия. Через 60-90 минут при пероральном поступлении рубидия в организм, его можно обнаружить в крови. Средний уровень рубидия в крови составляет 2,3-2,7 мг/л.
Основные проявления дефицита рубидия в организме
Недостаточность рубидия изучена плохо. Его содержание ниже 250 мкг/л в корме у подопытных животных может привести к сокращению продолжительности жизни, снижению аппетита, задержан роста и развития, преждевременным родам, выкидышам.
Избыток рубидия
Избыток этого микроэлемента более вреден для организма, он может вызвать опасные осложнения по той простой причине, что рубидий относится к той же категории ядовитых веществ, что и мышьяк As и серная кислота H2SO4. Основные проявления избытка рубидия в организме — протеинурия, локальное раздражение кожи и слизистых оболочек, головные боли, нарушение сна, учащённое сердцебиение.
Меры предосторожности
Элементарный рубидий относится к потенциально токсичным химическим веществам. Опасен в обращении. Его, как правило, хранят в ампулах из стекла пирекс в атмосфере аргона или в стальных герметичных сосудах под слоем обезвоженного масла (вазелинового, парафинового). Утилизируют рубидий обработкой остатков металла пентанолом.
Изотопы
Основная статья: Изотопы рубидия
В природе существуют два изотопа рубидия: стабильный 85Rb (содержание в натуральной смеси: 72,2 %) и бета-радиоактивный 87Rb (27,8 %). Период полураспада последнего равен 49,23 млрд лет (в 3 раза больше возраста Земли). Продукт распада — стабильный изотоп стронций-87. Постепенное накопление радиогенного стронция в минералах, содержащих рубидий, позволяет определять возраст этих минералов, измеряя содержание в них рубидия и стронция (см. Рубидий-стронциевый метод в геохронометрии). Благодаря радиоактивности 87Rb природный рубидий обладает удельной активностью около 670 кБк/кг.
Искусственным путём получены 30 радиоактивных изотопов рубидия (в диапазоне массовых чисел от 71 до 102), не считая 16 возбуждённых изомерных состояний.
Периодическая система химических элементов Д. И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, | |
Щелочные металлы | ||||||
|---|---|---|---|---|---|---|
| ||||||
Соединения рубидия | |
|---|---|
Азид рубидия (RbN3)Амид рубидия (RbNH2)Ацетат рубидия (RbCH3COO)Бихромат рубидия (Rb2Cr2O7)Бромат рубидия (RbBrO3)Бромид рубидия (RbBr)Гексафторогерманат рубидия (Rb2[GeF6])Гексахлороплатинат (IV) рубидия (Rb2[PtCl6])Гидрид рубидия (RbH)Гидроксид рубидия (RbOH)Гидроортофосфат рубидия (Rb2HPO4)Гидрофторид рубидия (RbHF2)Дигидроортофосфат рубидия (RbH | |
