Какими свойствами обладает полипептид
Подпишись на наш Instagram, если хочешь сдать экзамены на отлично!
@shpory_2020_
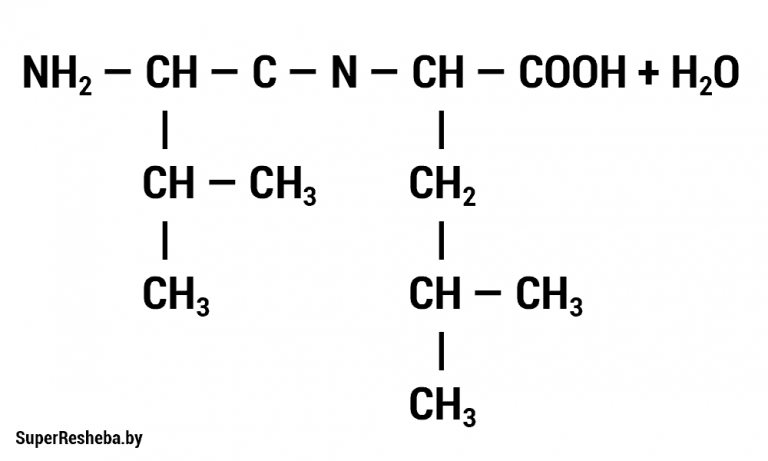
1. Запишите формулу дипептида, образованного двумя молекулами аминокислот.

2. В состав полипептида входят следующие аминокислоты: аланин, лизин, глутаминовая кислота. Какими свойствами будет обладать полипептид — гидрофильными или гидрофобными? Ответ поясните. Формулы данных аминокислот приведены в учебнике (с. 19, рис. 6).
Полипептид будет гидрофильным.
3. Альбумин сыворотки крови человека имеет относительную молекулярную массу 68 400. Определите количество аминокислотных остатков в молекуле этого белка, принимая во внимание, что средняя относительная молекулярная масса одной аминокислоты равна 120.
$dfrac{68400}{120} = 570$ (аминокислотных остатков).
4. Определите, сколько остатков глюкозы содержится в моле- куле гликогена, если его относительная молекулярная масса составляет примерно $1.62 · 10^6.$
$1.62 · dfrac{10^6}{162} = 10 000$ (остатков глюкозы).
5. Рассчитайте, сколько граммов глицерина было израсходовано клетками организма на синтез жира, если известно, что при этом было затрачено 21 моль высших карбоновых кислот.
На 1 моль глицерина приходится 3 моль кислот. Было использовано 7 моль глицерина. $M(mathrm{C_3H_8O_3}) = 92$ г/моль.
6. В молекуле ДНК на долю цитидиловых нуклеотидов приходится 20 %. Определите процентное содержание остальных нуклеотидов в этой ДНК.
Гуаниловых кислот — 20 %; адениловых — 30 %; тимидиловых — 30 %.
7. Фрагмент молекулы ДНК содержит 280 остатков цитидиловых нуклеотидов, что составляет 14 % от общего количества нуклеотидов. Определите длину данного фрагмента молекулы ДНК.
Ц + Г = $560;$ А + Т = $72 % = 1440;$ $dfrac{560 + 1440}{2} = 1000;$ длина фрагмента равна $340$ нм.
8. Фрагмент молекулы ДНК состоит из 5760 нуклеотидов, из них 1125 тимидиловых нуклеотидов. Определите количество адениловых, гуаниловых и цитидиловых нуклеотидов в данном фрагменте молекулы ДНК.
А = Т = $1125;$ $5760 — 1125 — 1125 = 3510;$ Г = Ц = $dfrac{3510}{2} = 1755.$
9. Длина фрагмента молекулы ДНК равна 68 нм, что составляет 10 % от длины всей молекулы. На долю адениловых нуклеотидов в данной молекуле ДНК приходится 12 %. Определите относительную молекулярную массу фрагмента молекулы ДНК, принимая во внимание, что относительная молекулярная масса одного нуклеотида равна 354, и число всех видов нуклеотидов в данной молекуле ДНК.
$dfrac{68,нм}{0.34,нм} = 200;$ $200 · 354 = 70 800.$
10. У исследователя есть три молекулы ДНК одинаковой длины. Известно, что содержание тимидиловых нуклеотидов (Т) в первом образце составляет 20 % от общего числа нуклеотидов, во втором — 36 %, в третьем — 8 %. Исследователь начал нагревать данные молекулы ДНК, постепенно повышая температуру. При этом происходило отделение комплементарных цепей друг от друга — так называемое плавление ДНК. Какой образец начал плавиться первым, а какой расплавился в последнюю очередь? Почему?
Поскольку во втором образце содержится меньше Г–Ц (потому как больше тимидиловых нуклеотидов), он начал плавится первым, а в последнюю очередь расплавился третий, где содержание Г–Ц наибольшее (тимидиловых нуклеотидов наименьшее).
Что такое пептиды и для чего они нужны?
Вещества, молекулы которых состоят из остатков двух или более аминокислот, называются пептидами. Цепочки из 10-20 аминокислот формируют олигопептиды, а в том случае, когда их количество увеличивается до 50 и более, образуется белок. Аминокислотные остатки связаны особым видом связи, которая называется пептидной. Уже сто лет назад стало известен метод синтезирования белков в лабораторных условиях.
Именно белки являются основным строительным материалом для всех живых организмов. Пептиды, являющиеся «кирпичиками» для строительства, могут быть получены из клеток растений, животных, человека. Для пептидов выделяют первичную структуру – это непосредственно последовательность аминокислотных остатков, а вот строение молекулы и ее пространственная конфигурация определяют их вторичную структуру.
Какие бывают пептиды
Основные виды пептидов в организме:
Пептидные гормоны – гормоны гипоталамуса, гипофиза, соматотропин, пролактин, адренокортикотропный гормон, меланоцитостимулирующий гормон, гормоны поджелудочной и щитовидной железы, глюкагон;
Нейропептиды – гормоны, которые образуются в центральной и периферической нервной системе, регулируют физиологические процессы в организме;
Иммунологические гормоны, имеющие защитную функцию;
Пептидные биорегуляторы, контролирующие работу клеток.
Пептид Окситоцин
Для чего нужны пептиды
Являясь звеньями для строительства белковых молекул, пептиды сами становятся строительным материалом тела. В том случае, когда в организме нарушена выработка белковых молекул, тело человека подвергается влиянию негативных внешних факторов, приводящих к развитию болезней, изнашиванию и старению организма. При нарушении контрольной функции, в клетках происходит сбой в работе, влекущий за собой расстройство жизнедеятельности и функционирования органа. А так как все органы в организме взаимосвязаны, происходит нарушение деятельности целой системы органов. Именно пептиды препятствуют:
Развитию нарушений в работе сердечно-сосудистой системы;
Расстройствам пищеварительной системы;
Возникновению онкологических заболеваний;
Ожирению;
Появлению сахарного диабета.
Пептиды также способствуют выведению из организма радионуклидов и солей тяжелых металлов.
«Информационная система» организма
Вся генетическая информация организма записана на матрице – ДНК. Синтез новых белковых молекул происходит благодаря «считыванию» этой информации при помощи пептидов. Пептиды переносят «списанную» информацию до клеток, где происходит синтез белковых молекул.
Все пептиды имеют узкую рабочую специализацию, и для каждого органа и ткани имеются свои личные пептиды. И в то же время, пептиды определенной специализации имеют одинаковое строение у разных видов млекопитающих. Это открытие сделало возможным создание лекарственных средств на основе животных пептидов.
Практическое применение пептидов
Учеными было выяснено влияние использования внешних пептидных биорегуляторов (БАДов) на состояние здоровья и продолжительность жизни человека. После проведенных исследований было сделано заявление о том, что в основе старения, а также возникновения смертельных заболеваний, в том числе, онкологических, лежит нарушение регуляции синтеза белка. При искусственном введении в организм соответствующих пептидов, начинаются восстановительные процессы в клетках и тканях, поэтому вы можете пептиды купить и помочь своему телу. Клетки получают возможность дополнительно делиться, а старые клетки, с трудом выполняющие свои функции, заменяются новыми, молодыми, здоровыми. Таким образом, приостанавливается процесс старения организма, увеличивается продолжительность жизни. Пептиды защищают наш организм от вредного воздействия токсинов, насыщают их питательными веществами. В отличие от лекарств, которые избавляют орган от симптомов заболевания, но не устраняют их причину, пептиды побуждают восстановить рабочие функции клетки, приводят ее к первоначальному состоянию.
Пептиды для спортсменов и бодибилдеров
Для спортсменов поступление пептидов в организм играет огромную роль, связанную, в первую очередь, с тем, что профессиональные занятия спортом и большие физические нагрузки приводят организм к стрессу, отрицательно сказывающемуся на выработке пептидов клетками. Кроме того, пептиды способствуют:
росту мышечной массы;
дополнительному сжиганию жиров;
ускорению обменных процессов.
Синтезированные пептиды: польза или вред?
Если организм не справляется с выработкой пептидов своими силами, то необходимо ему помочь. Многолетние научные исследования дали возможность синтезировать пептиды и вводить их в организм, стимулируя и регулируя работу клеток. Пептиды воздействуют на организм на генном уровне, контролируя синтез белков. Прием пептидных биорегуляторов позволяет в значительной мере продлить длительность жизни человека, но, помимо этого, необходимо соблюдать правила здорового образа жизни:
соблюдать режим дня, рано вставать и ложиться. Работа в ночную смену крайне негативно сказывается на состоянии здоровья.
разнообразно и сбалансировано питаться, отдавая предпочтение продуктам, произрастающим в вашем регионе. Пожилым людям полезны молочные продукты, богатые кальцием, особенно творог, а вот потребление мяса лучше сократить. Контролировать потребление сладкого и мучного.
выпивать один-два литра воды в день. Желательно набирать воду из источника или приобрести качественный фильтр.
активные физические нагрузки: ходьба, плавание, велосипед. Не стоит перегружать организм, но и расслабляться ему тоже давать не следует.
проходить периодический медицинский осмотр, чтобы знать слабые места организма и своевременно оказывать ему поддержку в виде биорегуляторов.
Долгожительство – не миф, оно подвластно каждому, нужно лишь приложить для этого некоторые усилия. Не стоит ожидать от приема биорегуляторов мгновенного эффекта, ведь волшебной таблетки от старости нет, но продлить жизнь и поддержать здоровье организма можно. Этот процесс длительный, и важен комплексный подход, но результат того стоит – не так ли?
Полиэлектролиты. Если звенья макромолекулы содержат боковые ионогенные группы, то полимеры проявляют своеобразные-электрические, конфигурационные и гидродинамические свойства. Такие полимеры называют полиэлектролитами. К ним относятся поликислоты (полиметакриловая, нуклеиновые кислоты и др.) полиоснования полиамфолиты. Полиамфолиты содержат кислотные-и основные группы в одной макромолекуле. Это белки и синтетические полипептиды. Они построены из аминокислот и содержат основные (ЫНзОН) и кислотные (—СООН) группы, которые располагаются не только на концах цепей, но и в боковых ответвлениях. Раствор каждого полиамфолита в зависнмости от его состава имеет определенное значение pH, при котором сумма положительных и отрицательных зарядов в цепи равны. Это значение pH называется изоэлектрической точкой (ИЭТ). При pH ниже ИЭТ в цепи преобладают положительные заряды из-за подавления диссоциации СООН-групп. При достаточно низком pH полиамфолит превращается в полиоснование. При pH выще ИЭТ полиамфолит постепенно переходит в поликислоту. [c.287]
Кодирующие эффекты сначала обнаруживаются в том, что цепь м-РНК узнает частицы т-РНК. Несомненно, что если этот эффект имеет место, сборка агрегата протекает легче. Как только синтезированный полипептид случайно окажется обладающим каталитическими свойствами РНК — репликазы, начнется автокатализ образования РНК и соответственно синтез определенного бел- [c.385]
О конформации молекул полипептидов и ее значении для биологических свойств известно еще очень мало. Исследование осложняется тем, что пространственное строение полипептида в значительной мере [c.381]
Точность воспроизведения данного полипептида (т. е. собственно белка) при таком механизме невелика, хотя продукт и обладает большим разнообразием каталитических функций. Гораздо большая точность достигается в цепях нуклеиновых кислот, если представить себе их образование по аналогичному способу. Нуклеиновая кислота обладает слабо выраженными каталитическими свойствами, но воспроизводит только сама себя и ошибки при этом бывают относительно редкими. [c.382]
Как и в случае полипептидов, свойства спектров поглощения полинуклеотидов отражают спектральные свойства их компонентов. На рис. 13-11 и 13-12 приведены спектры поглощения пуриновых и пири- [c.22]
Пептидная связь играет особую роль в полипептидах и белковых веществах. На свойстве многоосновных кислот реагировать с диаминами и образовывать высокомолекулярные цепные полимеры с пептидными связями основано получение полиамидной смолы найлона, успешно конкурирующего с натуральным и искусственным шелком. [c.502]
Позднее американский биохимик Фокс описал экспериментальные условия, в которых термическая конденсация смеси аминокислот приводила к образованию полимеров. Такие смеси полипептидов образовывали в соленой воде проте-ноидные микросферы и проявляли в присутствии АТР многие черты поведения, характерного для клеток. Фактически капли Опарина и Фокса вели себя как термодинамически открытые системы. Это составляет одно из фундаментальных свойств живой материи. [c.188]
Типичным примером жидкости, для которой структурные особенности выступают на передний план, является жидкая вода. Сейчас предложено множество моделей структуры жидкой воды, начиная с простейших ассоциатов, льдоподобной модели и кончая образованиями, характерными для полипептидов и полинуклеотидов бесконечно н беспорядочно разветвленный гель с быстро возникающими и исчезающими водородными связями. Выбор определенной модели жидкой воды зависит от изучаемых свойств. [c.136]
Главными продуктами полного гидролиза белков являются смеси а-аминокислот, но процесс протекает ступенчато в определенных условиях, особенно при действии ферментов, белки, расщепляясь, вначале образуют более простые, но близкие к ним по свойствам вещества — пептоны. Они являются продуктами неполного гидролиза белков и, как оказалось, представляют собой смеси различных по сложности полипептидов (стр. 285). При дальнейшем гидролизе из пептонов образуются еще более простые полипептиды, дипептиды и, наконец, а-аминокислоты. [c.289]
Если каждую составную часть сложной системы заменить на ее зеркальный образ, то получится зеркальное изображение всей первоначальной системы. Однако если только некоторые части сложной системы заменяются на их зеркальные двойники, то в результате возникает хаос. Химические системы, являющиеся точными зеркальными двойниками, ведут себя идентично, а системы только с частичной заменой имеют совершенно различные химические свойства. Если, например, в природе существует фермент, состоящий из Е-аминокислот и синтезирующий О-нуклеотид, то соответствующий искусственный фермент, полученный из О-аминокислот, будет синтезировать Ь-нуклеотид. В то же время соответствующий полипептид, содержащий как 0-, так и Е-аминокислоты, видимо, не будет обладать ферментативной активностью. [c.77]
Подобно фактору роста нервов, существует эпидермальный фактор роста, также синтезирующийся в подчелюстной железе мышей-самцов это полипептид, который состоит из 53 аминокислотных остатков [156, 157]. Выделена свойственная человеку форма этого фактора [157], идентичная, видимо, урогастрону [158]. Последний обладает свойством предотвращать развитие язвы желудка и находится в относительно больших количествах в моче беременных женщин (у которых обычно не развиваются язвы). [c.358]
Были изучены сополимеры бутадиена и у-бензилнЬ-глутамата (Б-Г), стирола и у-бензил-Ь-глутамата (С-Г), бутадиена и карбо-бензокси-Ь-лизина (Б-КК), стирола и карбобензокси-Ь-лизина (С-КК), бутадиена и Ы -оксипроиилглутамина (Б-ОГ). Эти сополимеры исследовали в сухом состоянии и в различных растворителях методами дифракции рентгеновских лучей и электронной микроскопии, инфракрасной спектроскопии и кругового дихроизма. В сополимере Б-ОГ цепи поли-М -оксипронилглутамина растворимы в полярных и неполярных растворителях, но даже в растворе в акриловой кислоте их конформация такая же, как и у гидрофобных полипептидов. Свойства сополимера Б-ОГ описаны в следующих разделах. [c.244]
Вторая часть пособия включает описание особенностей структуры, физических и химических свойств функциональных производных углеводородов различных классов, содержащих кислород, азот, серу, фосфор, к-ремний, металльг. Рассматртается характер строения и свойства гетероциклических соединений, включающих атомы кислорода, серы и азота. Особый класс представляют полифункциональные соединения, содержа1цие несколько различных функциональных гр тт. Приведены также принципиальные особенности строения, методов получения и свойств основных классов биохимических веществ — полисахаридов, полипептидов и белков. [c.13]
По-аидимому, в природе наиболее часто встречаются двр конформации полипептидов 1 -спираль и складчатый слой антипараллельно наирал.тепиых пептидных цепе . Возможность их существования теоретически предсказали Полинг и Кори, исходя 13 рассмотренных выше свойств пептндиой связи. [c.382]
Стратегические проблемы синтеза полипептидов и полинуклеотидов носят существенно иной характер. Здесь также требуется последовательное построение необходимых межмономерных связей и, следовательно, применение эффективных и общих методов создания амидной и фосфодиэфирной связей соответственно. Однако в отличие от типичных полисахаридов эти биополимеры состоят из линейных, но нерегулярных последовательностей не идентичных мономерных звеньев. Именно эта специфическая последовательность определяет уника,тьные химические, физические и биохимические свойства каждого из этих биополимеров. Таким образом, стратегической проблемой в синтезе этих соединений является обеспечение строго определенной последовательности мономерных звеньев в растущей полнпептидной или полинуклеотидной цепи, тогда как задача построения самих межмономерных связей низводится на тактический, рутинный уровень. Очевидно, что для построения таких нерегулярных полимерных цепей реакции типа полимеризации или поликонденсации принципиально неприменимы (в противоположность синтезу регулярных полисахаридов), а присоединение к растущей цепи каждого очередного мономерного звена превращается в самостоятельную операцию, требующую собственного набора реагентов и условий ее проведе- [c.298]
И последняя проблема, о которой здесь уместно упомянуть— это проблема вторичной полимеризации уже заполимеризован-ной цепи, или материализация линейной модели Изинга второго порядка. Наиболее изученный вариант такой материализации — Это переход клубок — спираль в полипептидах, приводящий, разумеется, на всех уровнях к резкому изменению и релаксационных свойств. Однако, так же, как мы говорили о немеханических аналогах релаксационных состояний, можно говорить и о немеханиче- ских аналогах такой вторичной материализации . [c.284]
Отрезки цепи намного меньше сегмента (например, звенья) в основном имеют выпрямленные конфигурации, а отрезки больше сегмента — свернутые конфигурации. Сегмент обладает и теми, и другими свойствами. Он легко принимает выпрямленные состояния и, таким образом, является исходным кинетическим элементом для процесса образования упорядоченных структур полимеров. Сегменты гибкоцепных полимеров (в частности, эластомеров) включают 5—10 звеньев цепи. Сегменты жесткоцепных полимеров, например таких, как спиральные полипептиды, алкилполиизоциа-наты, включают несколько сотен звеньев, а полужесткоцепные полимеры типа поликарбонатов (ПК) занимают промежуточное положение (в сегменте несколько десятков звеньев). [c.16]
Две молекулы хирального вещества, являющиеся зеркальными отражениями друг друга, называются энантиомерами. Поскольку два энантиомера не являются точной копией друг друга, их называют изомерами. Описанный тип изомерии называется конфигурационной, или оптической, изомерией. Для того чтобы различить образующие пару энантиомеры, один из них обозначают символом R (от латинского re tus -правый), а другой символом S (от латинского sm/ster-левый) или соответственно о (от латинского dexter-правый) и l (от латинского /аеми — левый). Энантиомеры любого хирального вещества обладают одинаковыми физическими свойствами, например растворимостью, температурой плавления и т. п. Их химическое поведение по отношению к обычным химическим реагентам также неразличимо. Однако они различаются своей реакционной способностью по отношению к другим хиральным молекулам. Поразительно, что все природные аминокислоты обладают s-, или L-, конфигурацией у углеродного центра (исключение составляет глицин, не относящийся к хиральным соединениям). Только аминокислоты с такой конфигурацией у хирального углеродного центра биологически эффективны в образовании полипептидов и белков в большинстве организмов пептидные связи образуются в клетках при таких специфических условиях, которые неодинаковы для энантиомерных молекул. [c.445]
Изучение мембранных явлений на живых организмах — чрезвычайно сложная экспериментальная задача. В 1962 г. П. Мюллер и сотрудники разработали методику приготовления бимолекулярных фое-фолипидных мембран, что предоставило возможность модельного исследования ионного транспорта через мембраны. Для приготовления искусственной мембраны каплю экстракта мозговых липидов в углеводородах наносят на отверстие в тефлоновом стаканчике (рис. 46, а). Искусственные мембраны имеют более простое строение, чем естественные (ср. рис. 45 и 46, б), но приближаются к последним по таким параметрам, как толщина, электрическая емкость, межфазное натяжение, проницаемость для воды и некоторых органических веществ. Однако электрическое сопротивление искусственных мембран на 4—5 порядков выше. Проводимость мембран увеличивают, добавляя ионофоры жирорастворимые кислоты (2,4-динитрофенол, дикумарол, пентахлорфе-нол и др.) или полипептиды (валиномицин, грамицидины А, В и С, ала-метицин и др.). Мембрана, модифицированная валиномицином, имеет сопротивление порядка 10 Ом/см , а ее проницаемость по К-» в 400 раз выше, чем по Ма+. На модифицированных моделях был изучен механизм селективной проницаемости мембран. В определенных условиях при добавлении белковых компонентов искусственная мембрана позволяет моделировать также свойство возбудимости. [c.140]
Хотя одна водородная связь понижает энергию системы на несколько кДж/моль, коллективное действие огромного числа водородных связей между молекулами полиамидов, полипептидов и других синтетических полимеров обусловливает прочность волокон и другие ценные свойства. Волокнистые белки живых тканей также обязаны своей структурой водородным связям между молекулами полипептидов. Водородные связи между молекулами органических веществ, содержащих ОН-, КН- и СО-группы, играют большую роль в жизни растений и животных. Небольшая энергия Н-связей приводит к тому, что в живом организме они легко возникают и разрушаются, давая начало образованию множества биологически активных кмпонентов важных биохимических процессов. [c.275]
Полученные таким образом полипептиды по свойствам оказались близкими к пептонам, т. е. к продуктам неполного гидролиза белков. Это замечательное достижение в области синтеза белковых веществ явилo J подтверждением правильности представлений полипептидной теории. Однако такие синтетические полипептиды все же были еще очень далеки от белков. [c.294]
Если каталитические свойства образующихся таким образом, скажем, полипептидов будут зависеть от их состава, оптической стереоизомерйи, степени молекулярного уплотнения, очередности аминокислот в полипептидных цепях, а в этом нет сомнения, то естественный отбор неизбежно приведет в течение достаточно большого времени к системам, содержащим вещества такого состава и строения, которые обеспечат максимальную активность каталитической системы. [c.17]
Как известно, все аминокислоты, за исключением глицина, имеют асимметрический атом углерода в а-положении. Все они относятся к /-аминокислотам и обладают одними и теми же заместителями у а-углерода группами —NH2 и —СООН и боковой цепью, характерной для каждой аминокислоты. Долгое время полагали, что оптическое вращение полипептидов и белков является аддитивным свойством и зависит исмючительно от доли, вносимой каждым аминокислотным остатком в отдельности. Однако значительный рост левого вращения белков при денатурации (от —50 до —100°) и при застудневании желатины приводит к выводу, что эти изменения связаны с конформационными изменениями полипептидной цепи. При исследовании эмпирическую величину удельного оптического вращения [а] заменяют на величину эффективного вращения цепи [т [c.362]
ДНК-полимераза I состоит из одного полипептида длиной 911 аминокислотных остатков (а. а.) (Л1г=102 000 D). Этот фермент отличается от прочих ДНК-полимераз Е. oli наличием 5 -экзонуклеазной активности. Фактически ДНК-полимераза I — это два фермента на одной полипептидной цепи ограниченный протеолиз расщепляет эту ДНК-полимеразу на большой и малый фрагменты с разными активностями. Большой субфрагмент ДНК-па имеразы I (называемый также ДНК-полимеразой Кленова или фрагментом Кленова) обладает полимеризующей и З -экзонуклеазной (корректирующей) активностями. Л алый субфрагмент несет 5 -экзонуклеаз-ную активность. 5 -экзонуклеаза ДНК-полимеразы I действует на 5 -конец полинуклеотидной цепи только в составе дуплекса и отщепляет от него как моно-, так и олигонуклеотиды. Направление действия 5 -экзон клеазы совпадает с направлением полимеризации новой цепи ДНК, т. е. в ходе полимеризации экзонуклеаза расчищает дорогу для полимеразы (рис. 29). Подобные свойства ДНК-полимеразы I соответствуют ее функциям в клетке эта полимераза удаляет различного рода дефекты нз ДНК в ходе репарации и служит вспомогательной поли- [c.48]
Таким образом, все выделенные до настоящего времени из яда змей сем. Elapidae токсические полипептиды не обладают энзиматическими свойствами и по механизму действия разделяются на три группы, [c.60]
Это полипептид с молекулярным весом около 7000 п сильно выраженными основными свойствами. ПГФ из яда Н. haema hates состоит из 57 аминокислотных остатков, N-концевой аминокислотой является. тенции, С-кои-цевой — серии, в молекуле содержится 4 дисульфидных мостика (Aloof-Hirs li et al., 1968). [c.94]
Под названием антибиотики , или антибиотические вещества , понимают продукты обмена организмов, способные избирательно подавлять или убивать микроорганизмы (бактерии, дрожжи, грибы, вирусы и др.). На протяжении последних 20 лет антибиотики привлекли к себе внимание в качестве лекарственных средств в связи с их эффективным действием в отношении таких заболеваний, как туберкулез, пневмония и ряд других, против которых ранее не существовало радикальных средств борьбы. Поводом к изучению антибиотиков послужило открытие лечебных свойств тиротроцина в 1939—1940 гг., представляющего собой смесь нескольких полипептидов. Препарат этот оказался эффективным в отношении грамположительных бактерий как in vitro, так и in vivo и получил применение для лечения ран, ожогов и некоторых заболеваний уха, носа и горла. [c.686]
Дальнейшее изучение грамицидина С показало, что указанные аминокислоты (I—V) содержатся в исходной молекуле в равномолекулярныл собой циклический полипептид, в кото-эом только одна аминогруппа (орнитина) не принимает участие в образова-гии пептидной связи. Она и обусловливает основные свойства грамицидина С, пособность образовывать пикрат, реагировать с азотистой кислотой гто типу первичных алифатических аминов и пр. Установлено важное значение )той б-аминогруппы для антибиотической активности грамицидина С с ее (езаминированием или ацилированием действие грамицидина исчезает [c.739]
Сульфат полимиксина М — белый гигроскопичный порошок без запаха, сладковато-горького вкуса, легко растворим в воде (1 3), мало растворим в спирте устойчив в слабокислой и слабощелочной средах, т. пл. 225—228°, (а]д == —48,1 (с = 2,505, вода). В сухом состоянии сохраняет активность в течение двенадцати месяцев. В химическом отношении полимиксины являются полипептидами, обладающими основными свойствами. Они содержат в своем составе первичные аминогруппы, за счет которых образуют соли с кислотами и продукты взаимодействия с альдегидами. Общим для всех полимиксинов является наличие в их составе /-треонина [c.742]
Итоги науки химические науки химия и технология синтетических высокомолекулярных соединений том 7 (1961) — [
c.258
]
Аккумулятор знаний по химии (1977) — [
c.211
]
Аккумулятор знаний по химии (1985) — [
c.211
]
Химия и технология полимеров Том 1 (1965) — [
c.534
]
