Какими свойствами обладает пиридин
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 октября 2019;
проверки требуют 5 правок.
| Пиридин | |||
|---|---|---|---|
| Систематическое наименование | азин, пиридин | ||
| Хим. формула | C5H5N | ||
| Состояние | жидкость | ||
| Молярная масса | 79,101 г/моль | ||
| Плотность | 0,9819 г/см³ | ||
| Динамическая вязкость | 0,94 Па·с | ||
| Энергия ионизации | 9,27 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | −41,6 °C | ||
| • кипения | 115,6 °C | ||
| • вспышки | 68 ± 1 °F[1] | ||
| Пределы взрываемости | 1,8 ± 0,1 об.%[1] | ||
| Давление пара | 16 ± 1 мм рт.ст.[1] | ||
| Рег. номер CAS | 110-86-1 | ||
| PubChem | 1049 | ||
| Рег. номер EINECS | 203-809-9 | ||
| SMILES | c1ncccc1 | ||
| InChI | 1S/C5H5N/c1-2-4-6-5-3-1/h1-5H JUJWROOIHBZHMG-UHFFFAOYSA-N | ||
| RTECS | UR8400000 | ||
| ChEBI | 16227 | ||
| ChemSpider | 1020 | ||
| ЛД50 | 891 мг/кг (мыши, орально) | ||
| Токсичность | Токсичен | ||
| NFPA 704 | 3 3 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
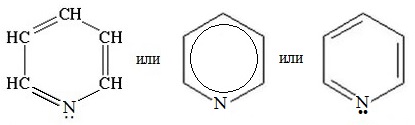
Пиридин (азин, 1-азациклогекса-1,3,5-триен) — шестичленный ароматический гетероцикл с одним атомом азота, бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями. Пиридин — слабое основание, дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения.
История открытия[править | править код]
Пиридин был известен ещё алхимикам, но первое письменное описание этого вещества было сделано шотландским химиком Томасом Андерсоном[en] в 1851 году. Он обнаружил его при исследовании костяного масла, получающегося сухой перегонкой необезжиренных костей, среди прочих веществ, была получена бесцветная жидкость с неприятным запахом. В 1869 году Кернер в частном письме к Канниццаро высказал мысль, что пиридин может быть рассматриваем, как бензол, в котором одна группа СН замещена азотом. По мнению Кернера, подобная формула не только объясняет синтезы пиридина, но, главным образом, указывает, почему простейший член ряда пиридиновых оснований имеет пять атомов углерода. Через год Дьюар (Dewar), независимо от Кернера, пришел к той же формуле, которая затем нашла себе подтверждение и в позднейших работах других химиков. Позже изучением структуры пиридина занимались Томсен, Бамбергер и Пехманн, Чамичан и Деннштедт. В 1879 году А. Вышнеградский высказал мнение, что, может быть, все растительные основания являются производными пиридина или хинолина, а в 1880 году Кенигс предлагал даже именем алкалоидов называть только те растительные основания, которые могут быть рассматриваться, как производные пиридина. Однако на настоящее время границы понятия «алкалоиды» значительно расширились.
Получение[править | править код]
Основным источником для получения пиридина является каменноугольная смола.
Одним из методов промышленного синтеза пиридина и 2-алкилпиридинов, например 2-метилпиридина является циклизация по Бённеманну. Она предполагает образование молекулы пиридина из двух молекул ацетилена и одной молекулы циановодорода или какого-либо нитрила в присутствии катализатора. Катализатором являются соединения кобальта, преимущественно, кобальтоцен:
Химические свойства[править | править код]
Пиридин проявляет свойства, характерные для третичных аминов: образует N-оксиды, соли N-алкилпиридиния, способен выступать в качестве сигма-донорного лиганда.
В то же время пиридин обладает явными ароматическими свойствами. Однако наличие в кольце сопряжения атома азота приводит к серьёзному перераспределению электронной плотности, что приводит к сильному снижению активности пиридина в реакциях электрофильного ароматического замещения по сравнению с бензолом. В таких реакциях реагируют преимущественно мета-положения кольца.
Для пиридина характерны реакции ароматического нуклеофильного замещения, протекающие преимущественно по мета- положениям кольца. Такая реакционная способность свидетельствует о электроннодефицитной природе пиридинового кольца, что может быть обобщено в следующем эмпирическом правиле: реакционная способность пиридина как ароматического соединения примерно соответствует реакционной способности нитробензола.
Применение[править | править код]
Применяют в синтезе красителей, лекарственных веществ, инсектицидов, в аналитической химии, как растворитель многих органических и некоторых неорганических веществ, для денатурирования спирта.
Охрана труда[править | править код]
Пиридин токсичен[2], его ПДК в воздухе рабочей зоны составляет 5 мг/м3[3]. А порог восприятия запаха этого вещества может достигать 39 мг/м3 (среднее значение в группе)
[4]. Причём у отдельных работников порог восприятия запаха может быть значительно выше среднего значения. Поэтому можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками СИЗ органов дыхания) приведёт к чрезмерному воздействию паров пиридина на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от пиридина следует использовать изменение технологии и средства коллективной защиты.
Примечания[править | править код]
Ссылки[править | править код]
- Пиридин — статья из Большой советской энциклопедии.
- Д. А. Хардин. Пиридин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Пиридин С5Н5N – простейший шестичленный ароматический гетероцикл с одним атомом азота. Его можно рассматривать как аналог бензола, в котором одна группа СН заменена на атом азота.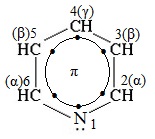
Электронное строение молекулы пиридина
Электронное строение молекулы пиридина сходно со строением бензола. Атомы углерода и азота находятся в состоянии sp2-гибридизации. Все s-связи C–C, C–H и C–N образованы гибридными орбиталями, углы между ними составляют примерно 120°. Поэтому цикл имеет плоское строение. Шесть электронов, находящихся на негибридных р-орбиталях, образуют p-электронную ароматическую систему.
Из трех гибридных орбиталей атома азота две образуют s-связи С–N, а третья содержит неподеленную пару электронов, которая не участвует в образовании p-электронной системы.
Физические свойства
Пиридин – бесцветная жидкость с характерным неприятным запахом, Ткип= 1150С. Хорошо растворяется в воде и органических жидкостях. Ядовит! Вдыхание его паров может привести к тяжелому поражению нервной системы.
Химические свойства
Химические свойства пиридина определяются наличием ароматической системы и атома азота с неподеленной электронной парой.
Основные свойства
Неподеленная электронная пара атома азота в молекуле не участвует в образовании единой π-электронной системы, поэтому пиридин подобно аминам, проявляет свойства основания. Пиридин – более слабое основание, чем алифатические амины.
1. Взаимодействие с водой
Водный раствор пиридина окрашивает лакмус в синий цвет.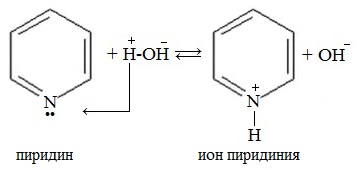
2. Взаимодействие с кислотами
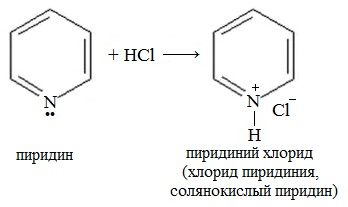
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния.
Ароматические свойства
1. Реакции электрофильного замещения
Наряду с основными свойствами пиридин проявляет свойства ароматического соединения.
Нитрование
Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем у бензола, из-за большой электроотрицательности атома азота. Азот как более электроотрицательный элемент оттягивает электроны на себя и понижает плотность электронного облака в кольце, в особенности в положениях 2, 4 и 6 (орто- и пара- положения), создавая частичный отрицательный заряд в мета-положении.
Атом азота в реакциях электрофильного замещения ведет себя как заместитель II рода, электрофильное замещение идет в положение 3 (мета-положение).
Поэтому реакция нитрования пиридина проходит в более жестких условиях, чем у бензола ( при 3000С) и с низким выходом.
2. Реакции присоединения (гидрирование)
Как и бензол, пиридин может присоединять водород в присутствии катализатора с образованием насыщенного соединения пиперидина.
Пиперидин представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин.
3. Реакции нуклеофильного замещения
Аминирование
В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто-пара-положения по отношению к атому азота обеднены электронами. Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара- аминопиридинов (реакция Чичибабина).
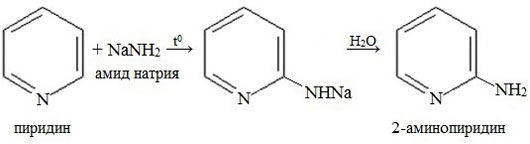
4. Гомологи пиридина по свойствам похожи на гомологи бензола. Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты.
Пиридин, как и бензол, устойчив по отношению к окислителям: он не обесцвечивает раствор перманганата калия даже при нагревании.
Получение
1. Выделение из каменноугольной смолы
Пиридин выделяют из каменноугольной смолы, в которой его содержание составляет 0,08%.
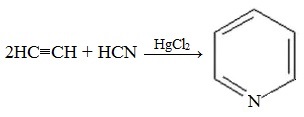
2. Синтез из ацетилена и циановодорода
В лабораторных условиях пиридин можно синтезировать из синильной кислоты (циановодород) и ацетилена:
Биологическая роль
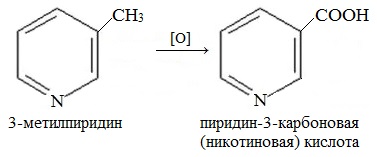
Гомолог пиридина – 3-метилпиридин (β-пиколин) – при окислении образует никотиновую кислоту:
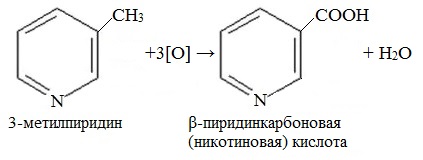
Никотиновая кислота и ее амид – никотинамид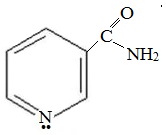
представляют собой две формы витамина РР, который применяется для лечения пеллагры (кожное заболевание).
Многие производные пиридина играют важную роль в природе и жизни человека: они являются витаминами, биологически активными веществами, лекарственными препаратами, красителями и т.п.
Проявляя основные свойства, пиридин и его гомологи известны под общим названием пиридиновые основания.
Гетероциклические соединения
| Пиридин | |
| Общие | |
|---|---|
| Систематическое наименование | Пиридин |
| Хим. формула | C5H5N |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 79,101 г/моль |
| Плотность | 0,9819 г/см³ |
| Динамическая вязкость | 0,94 Па·с |
| Энергия ионизации | 9,27 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | −41,6 °C |
| Т. кип. | 115,6 °C |
| Т. всп. | 68 ± 1 °F[1] |
| Пр. взрв. | 1,8 ± 0,1 об.%[1] |
| Давление пара | 16 ± 1 мм рт.ст.[1] |
| Классификация | |
| Рег. номер CAS | 110-86-1 |
| PubChem | 1049 |
| Рег. номер EINECS | 203-809-9 |
| SMILES | c1ncccc1 |
| InChI | 1S/C5H5N/c1-2-4-6-5-3-1/h1-5H JUJWROOIHBZHMG-UHFFFAOYSA-N |
| RTECS | UR8400000 |
| ChEBI | 16227 |
| ChemSpider | 1020 |
| Безопасность | |
| ЛД50 | 891 мг/кг (мыши, орально) |
| Токсичность | Токсичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Пиридин — шестичленный ароматический гетероцикл с одним атомом азота, бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями. Пиридин — слабое основание, дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения.
История открытия
Пиридин был известен ещё алхимикам, но первое письменное описание этого вещества было сделано шотландским химиком Томасом Андерсоном[en] в 1851 году. Он обнаружил его при исследовании костяного масла, получающегося сухой перегонкой необезжиренных костей, среди прочих веществ, была получена бесцветная жидкость с неприятным запахом. В 1869 году Кернер в частном письме к Канниццаро высказал мысль, что пиридин может быть рассматриваем, как бензол, в котором одна группа СН замещена азотом. По мнению Кернера, подобная формула не только объясняет синтезы пиридина, но, главным образом, указывает, почему простейший член ряда пиридиновых оснований имеет пять атомов углерода. Через год Дьюар (Dewar), независимо от Кернера, пришел к той же формуле, которая затем нашла себе подтверждение и в позднейших работах других химиков. Позже изучением структуры пиридина занимались Томсен, Бамбергер и Пехманн, Чамичан и Деннштедт. В 1879 году А. Вышнеградский высказал мнение, что, может быть, все растительные основания являются производными пиридина или хинолина, а в 1880 году Кенигс предлагал даже именем алкалоидов называть только те растительные основания, которые могут быть рассматриваться, как производные пиридина. Однако на настоящее время границы понятия «алкалоиды» значительно расширились.
Получение
Основным источником для получения пиридина является каменноугольная смола.
Одним из методов промышленного синтеза пиридина и 2-алкилпиридинов, например 2-метилпиридина является циклизация по Бённеманну. Она предполагает образование молекулы пиридина из двух молекул ацетилена и одной молекулы циановодорода или какого-либо нитрила в присутствии катализатора. Катализатором являются соединения кобальта, преимущественно, кобальтоцен:
Химические свойства
Пиридин проявляет свойства, характерные для третичных аминов: образует N-оксиды, соли N-алкилпиридиния, способен выступать в качестве сигма-донорного лиганда.
В то же время пиридин обладает явными ароматическими свойствами. Однако наличие в кольце сопряжения атома азота приводит к серьёзному перераспределению электронной плотности, что приводит к сильному снижению активности пиридина в реакциях электрофильного ароматического замещения по сравнению с бензолом. В таких реакциях реагируют преимущественно мета-положения кольца.
Для пиридина характерны реакции ароматического нуклеофильного замещения, протекающие преимущественно по мета- положениям кольца. Такая реакционная способность свидетельствует о электроннодефицитной природе пиридинового кольца, что может быть обобщено в следующем эмпирическом правиле: реакционная способность пиридина как ароматического соединения примерно соответствует реакционной способности нитробензола.
Применение
Применяют в синтезе красителей, лекарственных веществ, инсектицидов, в аналитической химии, как растворитель многих органических и некоторых неорганических веществ, для денатурирования спирта.
Безопасность
Пиридин токсичен, действует на нервную систему, кожу.
Примечания
Ссылки
- Пиридин — статья из Большой советской энциклопедии.
- Д. А. Хардин. Пиридин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Неподеленная пара электронов атома азота в пиридине находится на sp2-гибридной орбитали и не участвует в сопряжении, поэтому пиридин проявляет основные свойства и с сильными кислотами образует кристаллические пиридиниевые соли.
Соли пиридиния сохраняют ароматический характер, так как протонирование осуществляется за счет неподеленной пары электронов, не участвующей в образовании ароматического секстета. Для замещенных пиридинов в основном соблюдаются общие закономерности: электронодонорные заместители увеличивают основность, а электроноакцепторные понижают ее.
Нуклеофильные свойства пиридина:
Пиридиновый атом азота способен взаимодействовать и со многими электрофильными реагентами, проявляя тем самым и нуклеофильные свойства.
Реакции с электрофильными реагентами. В молекуле пиридина имеется два реакционных центра, способных принимать атаку электрофильными реагентами:
• атом азота с неподеленной парой электронов;
• π-электронная система ароматического кольца.
Присоединение к атому азота. Помимо протона, атом азота может присоединять и другие электрофильные частицы, превращаясь в катион пиридиния.
Алкилирование. Получаемые при этом N-алкилпиридиниевые соли сохраняют ароматическим характер, так как в результате реакции ароматическим секстет электронов не нарушается.
Ацилирование. Образуются N-ацилпиридиниевые соли (они гидролизуются влагой воздуха).
Сульфирование. Образуется пиридиний-1-сульфонат, более известный под названием пиридинсульфотриоксид — весьма реакционноспособное соединение, гидролизующееся горячей водой.
Нитрование. Образующееся при этом N-нитропроизводное применяется в качестве мягкого нитрующего реагента некислотного характера, как показано на примере нитрования бензола:
Замещение по атомам углерода. Хотя электрофильные реагенты атакуют в первую очередь нуклеофильный атом азота, такие реакции часто обратимы и даже в кислых средах присутствует небольшое количество свободного основания. Поэтому реакции электрофильного замещения в ряду пиридина возможны, но протекают в жестких условиях и настолько затруднены, что некоторые из известных реакций этого типа вовсе не идут с пиридинами.
Предпочтительная атака электрофилом β-положения объясняется не только распределением электронной плотности в статическом состоянии, но и большей стабильностью образующегося при β-атаке α-комплекса.
Нитрование. Пиридин нитруется в ядро в очень жестких условиях.
Сульфирование. Пиридин очень устойчив к действию концентрированной серной кислоты и олеума. Сульфирование протекает значительно легче в присутствии каталитических количеств солей ртути(П) или хлорида алюминия.
Галогенирование. Бромирование пиридина успешно осуществляется в присутствии олеума.
Азины. Ненасыщенные шестичленные гетероциклы, содержащие один или более атомов азота, называются азинами. Представители с двумя атомами азота классифицируются как диазины. Изомерные диазины — пиридазин, пиримидин и пиразин — представляют собой устойчивые соединения, однако в свободном виде они в природе не встречаются.
Диазины содержат по два атома азота пиридинового типа и обладают основными свойствами. Однако основность диазинов значительно ниже, чем пиридина, поскольку второй атом азота выступает в роли электроноакцептора по отношению к первому. Протонирование диазинов осуществляется только в очень сильных кислотах, и соли образуются с участием лишь одного атома азота.
Нуклеофильный характер диазинов проявляется в реакции с алкилгалогенидами, которая приводит к образованию четвертичных солей (здесь и далее в качестве примеров использован пиримидин — наиболее значимый и изученный из диазинов). Диазины вступают в эту реакцию труднее, чем пиридин.
Вследствие электроноакцепторного характера атомов азота понижена реакционная способность диазинов и в реакциях электрофильного замещения. Незамещенные диазины еще менее активны, чем пиридин, и не подвергаются сульфированию, нитрованию и многим другим реакциям замещения. Известны лишь некоторые реакции галогенирования. Так, бромирование пиримидина приводит к замещению положения 5, которое равноценно β-положению в ядре пиридина и дезактивировано в меньшей степени, чем положения 2, 4 или 6.
Гидроксипиридины. Для всех трех изомерных гидроксипиридинов характерно явление таутомерии. 2- и 4-Гидроксипиридинам таутомерны их оксоформы, которые называются соответственно пиридон-2 и пиридон-4. В полярных растворителях и в кристаллическом состоянии пиридонные формы, исходя из спектральных данных, явно преобладают, что связано с большим сродством к протону атома азота, нежели атома кислорода.
3-Гидроксипиридин в растворе находится в равновесии со своим диполярным ионом. Несмотря на существенные различия в строении рассмотренных изомеров, их часто объединяют одним названием — гидроксипиридины.
Поскольку пиридон-2 является типичным лактамом (циклическим амидом), а его гидроксиформа включает таутомер амидной группы — лактимную группировку —C(=NR)ОH, то такое равновесие называют лактим-лактамной таутомерией. Этот вид таутомерии характерен не только для 2-гидрокси-пиридина, но и для других гетероциклических систем, содержащих гидроксильную группу у атома углерода, соседнего с пиридиновым атомом азота.
Представители.
Пиридин и его производные — основа пиридиновых алкалоидов, а также многих ЛС. Используют пиридин также в синтезе красителей, инсектицидов, применяют для денатурации спирта. Пиридин — хороший растворитель, в т.ч. для многих неорганических солей. Токсичен, вдыхание его паров приводит к поражению нервной системы.
Хинолин — высококипящий слабоосновный растворитель. Производные хинолина — основа производства многих лекарственных препаратов (энтеросептола, аминохинола, трихомонацида, хиноцида), а также цианиновых красителей. Ядро хинолина входит в состав хинолиновых алкалоидов.
Изохинолин. Изохинолин — исходный продукт при синтезе сенсибилизирующих красителей (изохинолинового красного) и ЛС. Ядро изохинолина входит в состав изохинолиновых алкалоидов.
Шестичленные гетероциклы с одним гетероатомом: реакции электрофильного и нуклеофильного замещения пиридина(муть)и хинолина, условия проведения; 8–гидроксихинолин и его производные, применяемые в медицине.
Одно из существенных отличий пиридина от бензола состоит в проявлении основных свойств с образованием устойчивых солей. Пиридиновый атом азота способен взаимодействовать и со многими электрофильными реагентами, проявляя тем самым и нуклеофильные свойства.
Другое отличие заключается в пониженной активности пиридина и его производных в реакциях электрофильного замещения и одновременно в большей активности в реакциях нуклеофильного замещения, что не свойственно бензолу. Направление атаки обусловлено неравномерным распределением электронной плотности в кольце. Электрофильные реагенты атакуют β-положения (атомы С-3 и С-5), нуклеофильные реагенты — α- и γ-положения (С-2, С-4, С-6).
Электрофильное замещение в пиридине осуществляется с трудом и с невысокими выходами продуктов.
Реакции с электрофильными реагентами. В молекуле пиридина имеется два реакционных центра, способных принимать атаку электрофильными реагентами:
• атом азота с неподеленной парой электронов;
• π-электронная система ароматического кольца.
Реакции с нуклеофильными реагентами. В общем виде:
К реакциям нуклеофильного замещения относятся реакции аминирования, гидроксилирования и алкилирования (арилирования), т. е. непосредственного введения нуклеофильных групп в кольцо пиридина или его гомологов.
Аминирование. Прямое введение аминогруппы в пиридиновое ядро, называемое реакцией Чичибабина, представляет собой наиболее типичный пример нуклеофильного замещения. Реакцию обычно проводят при нагревании пиридина и амида натрия или калия в безводных апротонных растворителях. В обоих случаях с высокой избирательностью атакуется α-положение, а когда оба α-положения заняты, то образуется γ-изомер, но с меньшим выходом.
Реакция аминирования находит широкое применение, поскольку из аминопиридинов могут быть легко получены разнообразные производные пиридина.
Гидроксилирование. Реакция протекает в очень жестких условиях и с низким выходом продукта, поскольку нуклеофильность гидроксид-иона ниже, чем амид-иона. Практическое значение этой реакции невелико.
Алкилирование и арилирование. Такие сильные нуклеофильные реагенты, как литийорганические соединения, легко присоединяются к пиридину, образуя соли 1,2-дигидропиридина, которые иногда даже могут быть выделены в индивидуальном состоянии. Возврат к ароматической системе путем отщепления гидрид-иона достигается термически или действием окислителя.
Как и в реакции Чичибабина, замещение происходит преимущественно в положения 2 или 2,6 (с избытком реагента).
Хинолин и представляют собой изомерные конденсированные системы пиридина и бензола, различающиеся способом сочленения колец. Будучи изоэлектронными нафталину, оба гетероцикла сочетают в себе химические свойства пиридина и нафталина.
Основные и нуклеофильные свойства. Основность и нуклеофильные свойства хинолина и изохинолина, как и пиридина, обусловлены неподеленной парой электронов атома азота, не участвующей в сопряжении. С сильными кислотами хинолин образует соли, а с алкилгалогенидами — четвертичные соли N-алкилхинолиния:
Реакции электрофильного замещения. Из двух ароматических колец хинолина гетероциклическое кольцо является π-недостаточным, следовательно, электрофильной атаке, особенно в сильнокислых средах, подвергается бензольное ядро. По тем же причинам, что и для нафталина, преимущественно атакуются атомы С-5 и С-8, т. е. соседние с местами сочленения циклов.
В целом реакции электрофильного замещения для хинолина протекают значительно легче, чем для пиридина, но гораздо труднее, чем для нафталина.
При действии на хинолин нитрующей смеси с высоким выходом образуются изомерные нитропроизводные:
Галогенирование хинолина представляет собой достаточно сложный процесс, результат которого во многом зависит от условий. Так, при действии брома в концентрированной серной кислоте при нагревании получается смесь 5-бромо- и 8-бромохинолинов в соотношении ~1:1. Неожиданный продукт замещения в пиридиновое кольцо образуется при кипячении хинолина с бромом в отсутствие сильных кислот:
При сульфировании хинолина концентрированной серной кислотой (при температуре 220 °С) или олеумом (при 90 °С) образуется главным образом 8-сульфоновая кислота.
Из последней щелочным плавлением получают 8-гидроксихинолин (оксин). Оксин широко применяется в аналитической химии как реагент, связывающий ионы многих металлов в виде плохо растворимых в воде хелатных соединений. Сам оксин (в виде сульфата — препарат хинозол) и его производное нитроксолин используют в медицине как противомикробные средства. Полагают, что их действие основано на связывании ионов Со2+, необходимых для жизнедеятельности бактерий.
Реакции нуклеофильного замещения. Прямое введение аминогруппы действием амида натрия приводит к продукту замещения преимущественно в положение 2, подобно тому, как это отмечено для пиридина.
Гидроксилирование хинолина достигается нагреванием с расплавленным гидроксидом калия и протекает как 1,2-присоединение. Конечный продукт представляет собой более устойчивую лактамную форму 2-гидроксихинолина.
Шестичленные гетероциклы с одним гетероатомом: гомологи пиридина; a–,β–,g–пиколины и их окисление; никотиновая и изоникотиновая кислоты; амид никотиновой кислоты (витамин РР), гидразид изоникотиновой кислоты (изониазид).
По химическому поведению многие производные пиридина принципиально не отличаются от аналогичных производных бензольного ряда.
Алкилпиридины. Низшие гомологи пиридина имеют тривиальные названия: метилпиридины называются пиколинами (соответственно α-, β- и γ-пиколины).
Характерным свойством алкилпиридинов является подвижность атомов водорода при атоме углерода, непосредственно связанном с циклом, или, иными словами, CH-кислотность в месте присоединения алкильной группы к кольцу. Способность отщеплять протон в ряду изомерных пиколинов падает в ряду: γ > α >> β. При действии сильных оснований 2- и 4-алкилпиридины превращаются в анионы, способные выступать в качестве нуклеофильных реагентов. Реакция с алкилгалогенидами приводит к удлинению боковой цепи пиридина, причем вместе с алкильной группой могут быть введены и некоторые функциональные группы
Окислительное расщепление. Пиридиновое кольцо, подобно бензольному, устойчиво к действию окислителей при обычных температурах. Было показано, что окисление перманганатом в щелочной среде приводит к разрыву пиридинового кольца, а в кислой среде легче разрывается бензольное кольцо.
Боковые цепи алкилпиридинов окисляются легче самого цикла с образованием соответствующих карбоновых кислот, аналогично тому, как это происходит с гомологами бензола. Этим способом в промышленном масштабе из β-пиколина получают никотиновую кислоту, которая, как и ее амид, является Vit PP. Ряд других производных никотиновой кислоты также применяют в медицине, например стимулятор ЦНС кордиамин (N,N-диэтиламид) и желчегонное средство никодин (N-гидроксиметиламид).
Окисление γ-пиколина приводит к образованию изоникотиновой кислоты — промежуточного продукта синтеза противотуберкулезных препаратов изониазида и фтивазида, антидепрессанта ниаламида, представляющих собой гидразид или замещенные гидразиды изоникотиновой кислоты.
Шестичленные кислородсодержащие гетероциклы с одним гетероатомом: неустойчивость a– и g–пиранов; a– и g–пироны, соли пирилия, их ароматичность. Бензопироны: хромон, кумарин, флавон, флавоноиды (лютеолин, кверцетин).
Производные кислородсодержащих гетероциклов — пиранов. К ненасыщенным шестичленным гетероциклам с одним атомом кислорода относятся 2Н-пиран и 4Н-пиран, называемые также α-пираном и γ-пираном соответственно:
Пираны по структурным критериям не относятся к ароматическим соединениям, хотя в их молекулах можно вычленить р,π-сопряженные участки и число электронов, принимающих участие в сопряжении, равно шести (число Хюккеля). В целом же единое сопряжение в молекуле отсутствует, так как один из атомов углерода находится в sp3-гибридном состоянии. Поэтому оба гетероцикла неароматичны, а напротив, являются термодинамически нестабильными и чрезвычайно реакционноспособными ненасыщенными соединениями.
В то же время известны и встречаются в природе устойчивые соединения пиранового ряда, обладающие в некоторой степени ароматическими свойствами. К ним относятся соли пирилия и оксопроизводные пиранов — пироны.
По структурным признакам пирилий-катион отвечает критериям ароматичности. Неподеленная пара электронов атома кислорода занимает sр2-гибридную орбиталь, лежащую в плоскости кольца. Негибридизованная р-орбиталь располагается параллельно р-орбиталям атомов углерода и образует с ними единое делокализованное облако. Можно сказать, что пирилий-катион изоэлектронен пиридину и бензолу.
Среди оксопроизводных пиранов различают α-пирон (2H-пиранон-2) и γ-пирон (4H-пиранон-4). В обеих молекулах все атомы находятся в sp2-гибридном состоянии и, следовательно, можно говорить о сопряжении электронов π-связей цикла с неподеленной парой электронов кислорода кольца и с карбонильной группой. Такой вид делокализации электронного облака системы придает ей частично ароматический характер, поэтому пироны относят иногда к псевдоароматическим соединениям.
Производные бензопирана.
Конденсированная система бензольного и пиранового колец широко представлена в природных соединениях. В настоящее время для таких соединений все чаще используются систематические названия — бензопираны. Это хромены (2Н- и 4Н-изомеры) — ненасыщенные и хроманы —соединения с насыщенным гетероциклом. Оксопроизводное бензопиранов — хромон.
Особую группу бензопиранов составляют флавоноиды. Это производные флавана — 2-фенил-замещенного хромана. Оксопроизводными флавана являются флаванон и его ненасыщенный аналог флавон.
Производные флавона и флаванона составляют основную группу флавоноидов. К их числу относятся кверцетин и лютеолин:
Хромены являются неустойчивыми соединениями, тогда как их многочисленные оксопроизводные и бенз
