Какими свойствами обладает ph3

Фосфин — это ядовитый газ, который в чистом виде не имеет цвета и запаха. С химической точки зрения, является летучим водородным соединениям фосфора. В химии формула фосфина имеет вид — PH3. По своим свойствам имеет некоторые схожести с аммиаком. Вещество очень опасно, так как имеет высокую токсичность и склонность к самовоспламенению.
Получение
Самый хорошо изученный способ получения фосфина — это реакция взаимодействия белого фосфора с раствором сильной щелочи при нагревании. В данном случае фосфор диспропорционирует на метафосфат и фосфин. Побочными продуктами этой реакции является дифосфин (P2H4) и водород, поэтому выход данной реакции небольшой и составляет не более 40 %.
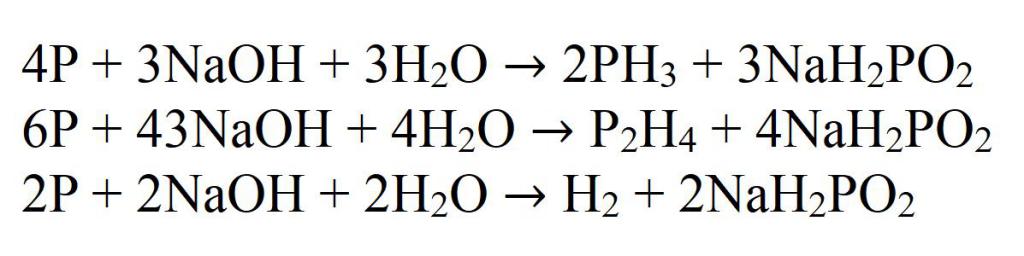
Образующийся дифосфин в реакционной среде вступает во взаимодействие со щелочью, в результате чего образуется фосфин и водород.
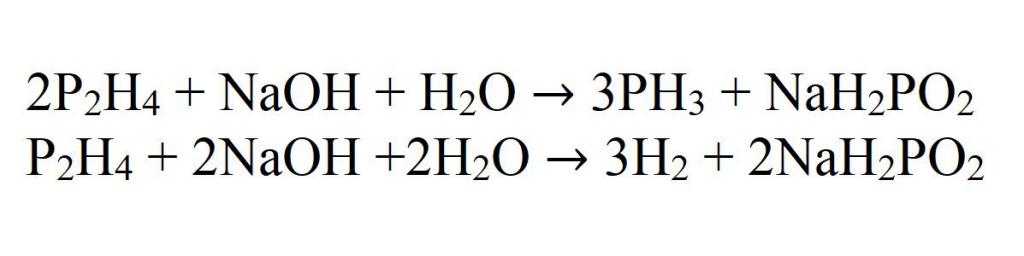
А полученный в этих реакциях гипофосфит, при взаимодействии со щелочью, переходит в фосфат с выделением водорода.
NaH2PO2 + 2NaOH = 2H2 + Na3PO4
После завершения всех реакций, в результате взаимодействия щелочи на фосфор образуется фосфин, водород и фосфат. Данный способ получения можно также провести со щелочными оксидами вместо щелочей. Этот опыт является очень красивым, так как образующийся дифосфин сразу же воспламеняется и сгорает в виде искр, образуя нечто похожее на фейерверк.
При воздействии воды или кислоты на фосфиды металлов также получается фосфин.
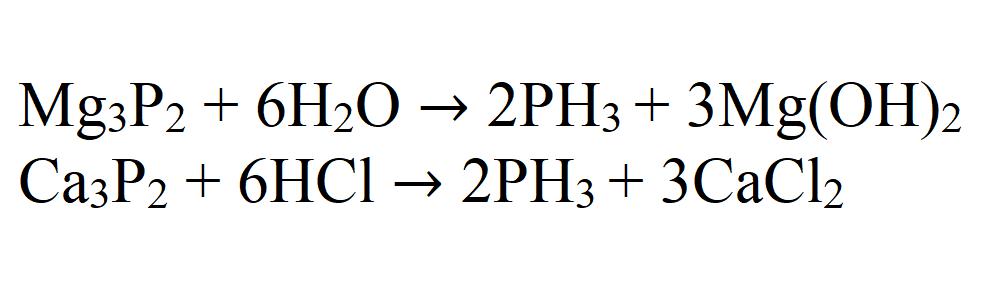
При термическом разложении фосфористой кислоты или ее восстановлении водородом в момент выделения также образуется фосфин.
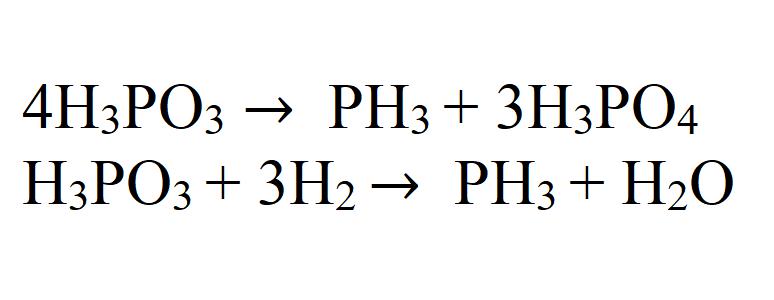
Соли фосфония при разложении или в реакции с некоторыми веществами дают фосфин.
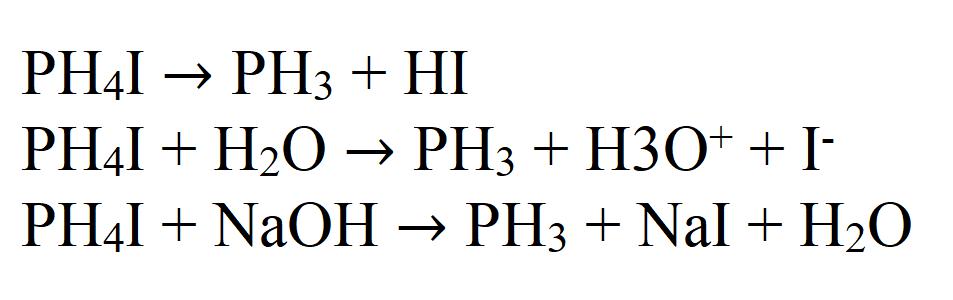
Физические свойства
Фосфин представляет собой бесцветный газ без запаха. Но технический фосфин (с некоторыми примесями) может иметь характерный неприятный запах, который описывают по-разному. Немного тяжелее воздуха, при температуре -87,42 °C сжижается, а при -133,8 °C становится твердым веществом. Такие низкие температуры кипения и плавления обусловлены довольно слабыми водородными связями. Вещество практически нерастворимо в воде, но при определенных условиях образует с водой неустойчивые гидраты. Хорошо растворим в этаноле и диэтиловом эфире. Плотность фосфина при нормальных условиях составляет 0,00153 г/см3.
Химические свойства
Как уже было сказано, химическая формула фосфина — PH3. Хоть фосфин и похож на аммиак, он имеет ряд отличий во взаимодействиях с другими веществами. Эти особенности обусловлены тем, что химические связи в фосфине (по формуле это становится ясно) ковалентные слабополярные. Они менее полярные, чем в аммиаке, и поэтому более прочные.
При сильном нагревании (примерно 450 °C) без доступа кислорода фосфин разлагается на простые вещества.
2PH3 → 2P + 3H2
При температуре свыше 100 °C PH3 самовоспламеняется, вступая в реакцию с кислородом воздуха. Температурный порог можно снизить ультрафиолетовым светом. По этой причине, выделяющийся на болотах фосфин, часто самовоспламеняется, вызывая появление так называемых «блуждающих огней».
PH3 + 2O2 → H3PO4
Но может происходить и простое горение. Тогда образуется фосфорный ангидрид и вода.
2PH3 + 4O2 → P2O5 + 3H2O
Как и аммиак, фосфин может образовывать соли, взаимодействуя с галогеноводородами.
PH3 + HI→ PH4I
PH3 + HCl→ PH4Cl
Исходя из формулы фосфина, можно сказать, что фосфор в нем имеет низшую степень окисления. По этой причине он является хорошим восстановителем.
PH3 + 2I2+ 2H2O → H3PO2 + 4HI
PH3 + 8HNO3→ H3PO4 + 8NO2 + 4H2O
Применение
Ввиду своей высокой токсичности, фосфин нашел применение в фумигации, т. е. уничтожении различного рода вредителей (насекомых, грызунов) при помощи газа. Для этих процедур существуют специальные устройства — машины-фумигаторы, с использованием которых распыляют газ в помещениях. Обычно фосфином или препаратами на его основе обрабатывают склады зерновых культур, готовых пищевых продуктов, мебели, а также библиотеки, заводские помещения, вагоны поездов и другой транспорт. Преимущество такой обработки в том, что фосфин даже в небольших концентрациях легко проникает в труднодоступные места и никак не взаимодействует с металлами, древесиной и тканью.
Помещение обрабатывают фосфином, в герметичном состоянии его держат в течение 5-7 суток. После этого не менее двух суток нужно осуществлять проветривание, иначе находится человеку в нем опасно. После этого фосфин не оставляет никаких следов даже на продуктах, зерне и других товарах.
Еще фосфин используется в синтезе некоторых веществ, особенно органических. Также из него может получаться химически чистый фосфор, с использованием фосфина производят легирование полупроводников.
Токсикология
Фосфин крайне токсичное соединение. Он быстро проходит через дыхательные пути и взаимодействует со слизистыми оболочками организма. Это может вызвать нарушения работы нервной системы, а также обмена веществ в целом. Признаками отравления могут служить головокружение, тошнота, рвота, головная боль, усталость, иногда даже конвульсии. В тяжелых случаях отправления человек может потерять сознание или произойти остановка дыхания и сердцебиения. Предельно допустимая концентрация фосфина в воздухе — 0.1 мг/м3. Концентрация 10 мг/м3 сразу приводит к летальному исходу.
Первое, что необходимо сделать с пострадавшим от отравления фосфина, — вынести на свежий воздух и освободить от загрязненной одежды. Также рекомендуется окатить пострадавшего водой, чтобы быстрее убрать остатки токсичного газа. Стационарное лечение подразумевает использование кислородной маски, контроль сердечного ритма и состояния печени, лечение отека легких. За больным необходимо следить минимум 2-3 суток, даже если видимых признаков отравления уже нет. Некоторые симптомы могут проявляться лишь через несколько суток после контакта с фосфином.
Физико-химические свойства
– бесцветный газ без вкуса и без запаха.[14]
По другим литературным источникам,[6] фосфин – бесцветный газ, обладающий неприятным запахом. Некоторые соединения с карбаматом аммония формируют запах аммиака, который служит сигнальным агентом.[6]
В водных растворах в реакции с некоторыми кислотами вещество образует нестойкие соли фосфония.[6]
Фосфин имеет низкий молекулярный вес и низкую точку кипения. Он в 1,2 раза тяжелее, чем воздух, поэтому легко смешивается с ним, не наслаиваясь. Молекула фосфина маленькая и неполярная, вследствие чего газ быстро проникает в предметы потребления и сквозь препятствия типа упаковочных бумаг и пленки.
. После фумигации фосфин быстро выветривается из продукции, практически не оставляя никаких следов.[14]
. В смеси с воздухом взрывоопасен, вследствие нередко присутствующей примеси Р2Н4 склонен к самовозгоранию.[6] Воспламенение может произойти, если твердые металлические формы фосфина войдут в контакт с водой, кислотами или другими химикатами. Стандартные концентрации при фумигации намного ниже, поэтому фосфин, применяемый должным образом, не представляет опасности для взрыва или пожара. Во избежание любого риска, гранулы или таблетки нужно распределять равномерно и все остатки препаратов следует закапывать.[14][4]
Физические характеристики
- Молекулярная масса 34,04;
- Температура плавления – 133,8 °C;
- Температура кипеня – – 87,8 °C;
- Температура замерзания – 133,5 °C;
- Плотность 1,529;
- Растворимость в воде 27 мл на 100 г (20 °C);
- Коэффициент растворимости в воде 0,276 (17 °C);
- Растворимость в крови практически та же, что и растворимость в воде;
- Нижний порог самовозгорания составляет 26-28 мг/л.[6][7]
При высоких концентрациях фосфин вызывает коррозию меди, латуни, медных сплавов, драгоценных металлов типа серебра и золота. Может вступать в реакцию с металлическими солями на фотографической пленке. По этой причине фосфин редко используется в строениях с электропроводкой, электрическими приборами, телефонным оборудованием, компьютерами.[14] Вещество не действует на сталь, белую и оцинкованную жесть, хлопчатобумажные и шелковые ткани, дерево, брезент, мешковину.[7]

Выделение фосфина
Выделение фосфина

Таблетка алюминия фосфида (слева) и образовавшийся через 3 суток оксид аллюминия (справа).
Пестициды на основе фосфина
В практике борьбы с вредными организмами используют 3 действующих вещества, выделяющих газ фосфин:
- Алюминия фосфид, выделяет фосфин при взаимодействии с атмосферной влагой:
АlР + 3Н2O → Аl(ОН)3 + PH3
- Магния фосфид, выделяет фосфин при взаимодействии с атмосферной влагой, реакция протекает быстрее, нежели у алюминия фосфида:
P2Mg3 + 6H2O →2PH3 + 3Mg(OH)2
- Цинка фосфид, выделяет фосфин при взамодействии с кислотами в желудке грызунов:
Zn3P2 + 6НСl → 3ZnCl2 + 2РН3
Пестициды, содержащие
Фосфин
для сельского хозяйства:
| Алфос, ТАБ *C | ||
| Альфин, ТАБ C | 1250.00 | ₽ |
 Дакфосал, ТАБ C Дакфосал, ТАБ C | 1611.03 | ₽ |
| Джинн, ТАБ C | ||
| Катфос, ТАБ C | 26.00 | $ |
| Квикфос, ТАБ C | ||
| Фоском, ТАБ C | 27.00 | $ |
| Фостоксин, ТАБ C | ||
| Фосфин, ТАБ, Г C | 17.00 | $ |
| Фумифаст, ТАБ C | ||
 Фумифос, ТАБ C Фумифос, ТАБ C | ||
| Фумишанс, ТАБ C |
* — закончился срок регистрации
С — смесевой пестицид
Действие на вредные организмы
Фосфин высокотоксичен для насекомых и животных.[14]
. Попадает в организм через органы дыхания. Яд преимущественно действует на нервную систему и нарушает обмен веществ. Также он влияет на кровеносные сосуды, печень, органы дыхания, почки.[6]
. Была обнаружена у ряда видов. Наиболее резистентными к этому препарату являются кожееды рода Troqoderma (в частности, Капровый жук), менее устойчив Амбарный долгоносик, еще менее – Суринамский мукоед, Фасолевая зерновка, Малый мучной хрущак, личинки Табачного жука.[7]
Популяции Зернового точильщика (Rhyzoperthadominika), резистентые к фосфину, обнаружены в Индии, ОАР, Сирии, Гвинеи, Ливии, Аргентине, Греции. Наличие резистентных популяций этого вредителя к фосфину в 90-х годах ХХ века было подтверждено в Азии и Австралии, а также в Индии. Уровни резистентности популяций Зернового точильщика устаналивали по имагинальной стадии. В экспериментах индийских исследователей было показано, что у резистентной популяции Зернового точильщика устойчивыми к действию фосфина оказались и яйца. Так, ЛД99 фосфина для яиц чувствительной расы и резистентной популяции составляли, соответственно, 0,56 и 3,25 г/л зерновой массы.[11]
В Австралии серьезными вредителями зерновых запасов при хранении являются сеноеды Psocoptera, особенно Liposcelis entomophila, Liposcelis bostrychophila, Liposcelis decolor. Для борьбы с этими вредителями применяется фумигация фосфином. В начале ХХI века зарегистрирована резистентность сеноедов к фосфину. Для ее преодоления рекомендовано применение комбинации спиносада с хлорпирифосметилом. Эта смесь была эффективна в течение трех месяцев.[11]
.
- Фумигант. Данные о резистентности грызунов к газу фосфину при поступлении его через дыхательные пути (при фумигации) отсутствуют, однако, в связи с тем, что при обработках помещений концентрация газа повышается в течение длительного времени (до двух суток), некоторые грызуны успевают покинуть обрабатываемую площадь.
- Приманка. При применении родентицидов, содержащих фосфид цинка, симптомы отравления у грызунов начинают проявляться через 1-3 часа после поедания приманки, поэтому поедание прекращается. Грызуны, не успевшие принять летальную дозу, остаются живыми и в дальнейшем избегают любых приманок.[12]
Токсикологические данные | |
| ДСД (мг/кг массы тела человека) | (нт) |
| ОДК в почве (мг/кг) | 0,4 |
| ОДУ в воде водоемов (мг/дм3) | 0,005 |
| ПДК в воздухе рабочей зоны (мг/м3) | 0,1 |
| ПДК в атмосферном воздухе (мг/м3) | 0,01 (м.р.) |
| МДУ в продукции (мг/кг): | |
в арахисе | 0,01 |
в зерне хлебных злаков | 0,1 |
в зернопродуктах | 0,01 |
в какао-бобах | 0,01 |
в овощах и фруктах сухих | 0,01 |
в орехах | 0,01 |
в сахаре | 0,01 |
в специях | 0,01 |
в чае | 0,01 |
| ВМДУ в продукции (мг/кг): | |
в сое (бобы) | 0,05 |
Токсикологические характеристики
Газ фосфин очень ядовит для животных и человека, поэтому при работке с ним нужно соблюдать все меры по обеспечению безопасности.[4]
. Обработка фосфином не наносит вреда предметам потребления. Запах, вкус, внешний вид, качество помола и выпечки не меняются. Фосфин может использоваться при карантинной обработке для контроля плодовых мух на свежих плодах и овощах. Вещество не препятствует прорастанию и может быть использовано для обработки семян.[4]
Симптомы отравления
. Обычно фумигант быстро проходит через дыхательные пути. Повреждение глаз может быть вызвано пылью твердых продуктов фосфина. Характерные признаки отравления отсутствуют и могут быть перепутаны с состоянием гриппа, пищевого отравления или алкогольного опьянения. Часто наблюдаемые признаки отравления следующие:
- затрудненное дыхание,
- тошнота,
- рвота
- головная боль,
- головокружение,
- усталость,
- конвульсии.
В легких случаях возможны боли в верхней части живота, отдающие в спину, появление чувства холода, кашля. При отравлении средней тяжести возникают страх, озноб, тошнота, рвота, стеснение в груди, шум в ушах. В случае серьезного отравления может произойти потеря сознания, остановка дыхания и сердцебиения.[14][6]
Стоит обратить внимание на то, что признаки отравления могут появиться до 48 часов после использования фумиганта. При подозрении на отравление пострадавший должен находиться под медицинским наблюдением как минимум в течение двух дней, чтобы избежать серьезного ущерба для здоровья и смерти.
Меры оказания первой помощи:
- самозащита человека, оказывающего первую помощь (ношение аппаратов респираторной защиты при входе в комнату, обрабатываемую газом);
- перемещение человека с признаками отравления из опасной области на свежий воздух;
- вызов врача;
- освобождение пострадавшего от одежды, поскольку она может содержать значительные количества газа, который можно случайно вдохнуть;
- если человек с признаками отравления в сознании, его надо успокоить, обеспечить тишину и тепло.
- если человек с признаками отравления без сознания, то необходимо проверить пульс, дыхание и уложить его в удобное место;
- в случае остановки дыхания необходимо начать реанимационные мероприятия.[14]
Для защиты органов дыхания нужно использовать противогазы, имеющие защитные коробки, рекомендуемые для фосфина.[4]
. При небольших концентрациях токсиканта наблюдается вялость, реже – судороги, рвота; при действии высоких доз яда возникает беспокойство, вялость. У кошек взъерошивается шерсть, появляется неверная походка, одышка. Дыхание вначале более глубокое и замедленное, затем учащенное и поверхностное. Происходит сильное падение артериального давления.[6]
. Наблюдается расстройство зрения, нарушение аккомодации, шаткость походки, нечеткость речи, слабость, нарушения дыхания и пищеварения.[6]
. При повторном вдыхании невысоких доз яда (0,007 мг/л) у кошек, кроликов, морских свинок и белых крыс возникает сонливость, изменение дыхания, снижается аппетит, падает количество эритроцитов и гемоглобина в крови. Наблюдается апатия, жажда, ухудшается антитоксическая функция печени. Часть кошек погибает; перед смертью отмечаются слабые судороги.[6]
Фосфин выделенный фосфидом цинка
Фосфид цинка обладает средне выраженной кумуляцией, а также имеет кожно-резорбтивный эффект при использовании в виде масляных растворов. Не оказывает местно-раздражающего действия на кожу и сенсибилизирующего эффекта.[13]
. Жажда, понос, тошнота, рвота, головная боль в области затылка, слабость, озноб, затруднения дыхания, чувство страха, стеснение в груди.
. Пострадавшему необходимо дать внутрь 1%-ный раствор медного купороса (по чайной ложке через 5 минут) или 0,03% раствор марганцевокислого калия (через 5 минут по столовой ложке) до наступления рвоты; после чего предложить солевое слабительное, слизевые отвары и щелочные воды. В дальнейшем показано симптоматическое лечение. Жиры, касторовое масло, яйца и молоко применять недопустимо.[8][5]
Таблица Токсикологические данные составлена в соответствии с ГН 1.2.3111-13.[2]
История
Фосфористый водород (фосфин) впервые был применен в практике фумигации в 1934 году. Высокая пожароопасность ограничивала его использование, пока в 1953 году в Германии не разработали форму применения этого фумиганта в виде таблеток фосфида алюминия, из которых под воздействием влаги воздуха или продукции выделялся газ фосфин.[7]
При написании статьи также использовались источники:[1][3][10][9]
Запрос «pH» перенаправляется сюда; см. также другие значения.
Водоро́дный показа́тель, pH (лат. pondus Hydrogenii[1] — «вес водорода»; произносится «пэ-аш») — мера кислотности водных растворов. Ассоциирована с концентрацией ионов водорода, что эквивалентно активности ионов водорода в сильно разбавленных растворах.
Для водных растворов водородный показатель pH < 7 кислотному раствору, тогда как pH > 7 — осно́вному.
Может быть определён с помощью кислотно-основных индикаторов, измерен потенциометрически pH-метром или вычислен по формуле как величина, противоположная по знаку и равная по модулю десятичному логарифму активности водородных ионов, выраженной в молях на литр:
Точное измерение и регулирование pH необходимо в различных отраслях химии, биологии, наук о материалах, технологий, медицины и агрохимии.
История[править | править код]
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni — сила водорода, или pondus hydrogeni — вес водорода. Вообще в химии сочетанием pX принято обозначать величину, равную −lg X. Например, силу кислот часто выражают в виде pKa = −lg Ka.
В случае pH, буква H обозначает концентрацию ионов водорода (H+), или, точнее, термодинамическую активность гидроксоний-ионов.
Уравнения, связывающие pH и pOH[править | править код]
Вывод значения pH[править | править код]
В чистой воде концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и при 22 °C составляют по 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH−] и составляет 10−14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается (на самом деле увеличивается не концентрация собственно ионов — иначе как способность кислот «присоединять» ион водорода могла бы приводить к этому — а концентрация именно таких соединений с «присоединённым» к кислоте ионом водорода), а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH−], говорят, что раствор является кислотным, а при [OH−] > [H+] — осно́вным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентрации ионов водорода используют её взятый с обратным знаком десятичный логарифм, который, собственно, и является водородным показателем — pH.
pOH[править | править код]
Несколько меньшее распространение получила обратная pH величина — показатель осно́вности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−:
как в любом водном растворе при 25 °C , очевидно, что при этой температуре:
Значения pH в растворах различной кислотности[править | править код]
| Вещество | pH | Цвет индикатора |
|---|---|---|
| Геотермальная вода у вулкана Даллол | ≈ 0 | |
| Электролит в свинцовых аккумуляторах | <1,0 | |
| Желудочный сок | 1,0–2,0 | |
| Лимонный сок (5 % р-р лимонной кислоты) | 2,0±0,3 | |
| Пищевой уксус | 2,4 | |
| Яблочный сок | 3,0 | |
| Кока-кола | 3,0±0,3 | |
| Кофе | 5,0 | |
| Шампунь | 5,5 | |
| Чай | 5,5 | |
| Кожа здорового человека | 5,5 | |
| Кислотный дождь | < 5,6 | |
| Питьевая вода | 6,5–8,5 | |
| Молоко | 6,6–6,93 | |
| Слюна | 6,8–7,4 [2] | |
| Чистая вода при 25 °C | 7,0 | |
| Кровь | 7,36–7,44 | |
| Морская вода | 8,0 | |
| Мыло (жировое) для рук | 9,0–10,0 | |
| Нашатырный спирт | 11,5 | |
| Отбеливатель (хлорная известь) | 12,5 | |
| Концентрированные растворы щелочей | >13 |
Так как при 25 °C (стандартных условиях) [H+] · [OH−] = 10−14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислотных растворах [H+] > 10−7, то у кислотных растворов pH < 7, аналогично, у осно́вных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH−); при понижении температуры, напротив, нейтральная pH возрастает.
Методы определения значения pH[править | править код]
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-осно́вного титрования.
- Для грубой оценки концентрации водородных ионов широко используются кислотно-осно́вные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в осно́вной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы.
- Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислотной области в осно́вную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
- Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
- Аналитический объёмный метод — кислотно-осно́вное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
- Влияние температуры на значения pH
Влияние температуры на значения pH объясняется различной диссоциацией ионов водорода (H+) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
Роль pH в химии и биологии[править | править код]
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-осно́вных свойств различных биологических сред.
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-осно́вного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем организма.
В человеческом организме в различных органах водородный показатель различен. Нормальный рН крови составляет 7,36, то есть кровь имеет слабоосновную реакцию (с колебаниями от 7,34 у венозной крови до 7,40 у артериальной). В зависимости от биохимических изменений в крови может наблюдаться ацидоз (увеличение кислотности) или алкалоз (увеличение осно́вности), однако совместимый с жизнью диапазон pH крови невелик, поскольку уже при уменьшении pH до 6,95 наступает потеря сознания, а смещение реакции крови в щелочную сторону до pH = 7,7 вызывает тяжелейшие судороги. Поддержание кислотно-основного баланса крови в допустимых пределах осуществляется буферными системами крови, главной из которых является гемоглобиновая[3]. Нормальный водородный показатель желудочного сока (в просвете тела желудка натощак) равен 1,5…2,0[4]. У сока тонкой кишки pH в норме составляет 7,2…7,5, при усилении секреции достигает 8,6. У сока толстой кишки в норме pH равен 8,5…9,0[5].
См. также[править | править код]
- Ионное произведение воды
- Электролитическая диссоциация
- Константа диссоциации кислоты
- Гидролиз
- Индикаторы
- pH-метр
- Стеклянный электрод
- Титрование
- Буферные растворы
- Основность
Примечания[править | править код]
Литература[править | править код]
- Бейтс Р. Определение рН. Теория и практика / пер. с англ. под ред. акад. Б. П. Никольского и проф. М. М. Шульца. — 2 изд. — Л. : Химия, 1972.
Ссылки[править | править код]
- Водородный показатель pH. Таблицы показателей pH.
