Какими свойствами обладает ионная связь
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 октября 2016;
проверки требуют 26 правок.
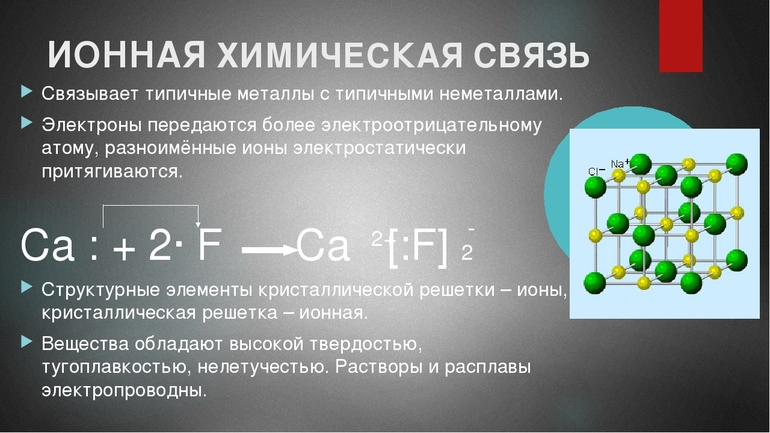
Атомы натрия и фтора подвергающиеся окислительно-восстановительной реакции с образованием фторида натрия. Натрий теряет свой внешний электрон, приобретая стабильную электронную конфигурацию, и этот электрон переходит в атом фтора. Противоположно заряженные ионы притягиваются друг к другу с образованием стабильного соединения.
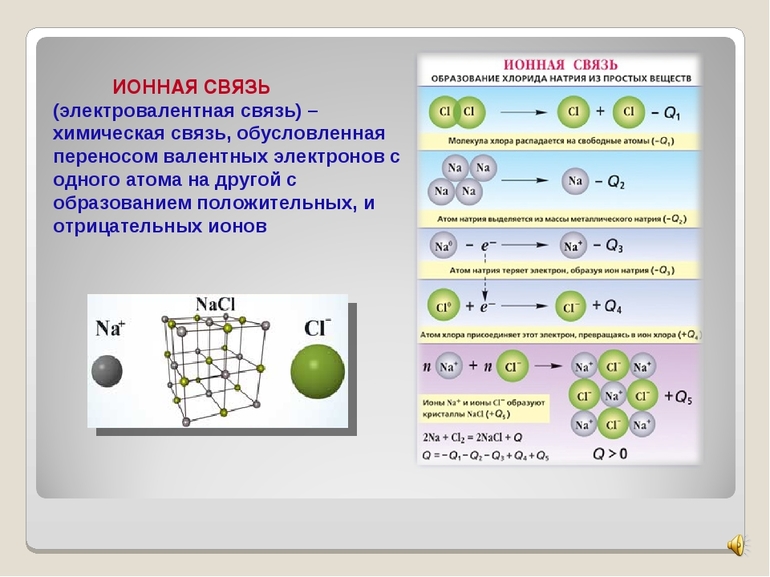
Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов. Возникает между атомами с большой разностью (>1,7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Это притяжение ионов как разноимённо заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу, образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1,7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью.
Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы, окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии.
Взаимодействие ионов
Если атом теряет один или несколько электронов, то он превращается в положительный ион — катион (в переводе с греческого — «идущий вниз). Так образуются катионы водорода Н+, лития Li+, бария Ва2+. Приобретая электроны, атомы превращаются в отрицательные ионы — анионы (от греческого «анион» — идущий вверх). Примерами анионов являются фторид ион F−, сульфид-ион S2−.
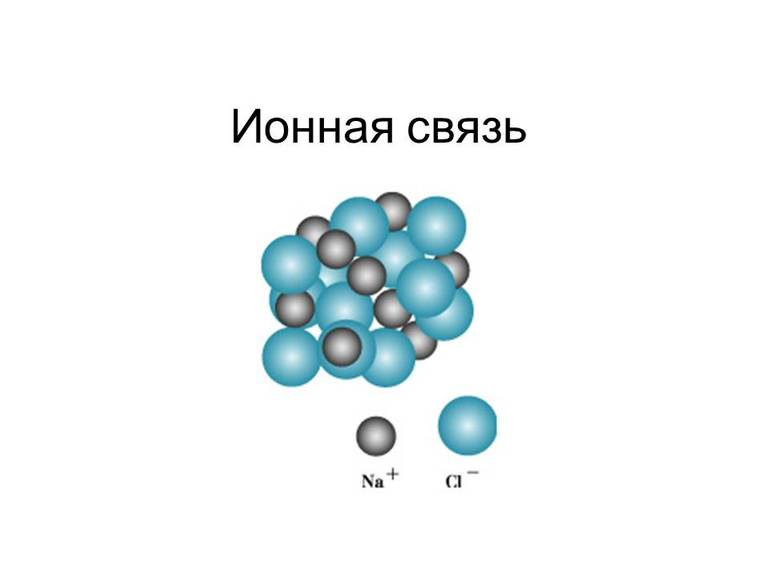
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью:
Ионная связь — это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
Пример образования ионной связи[править | править код]
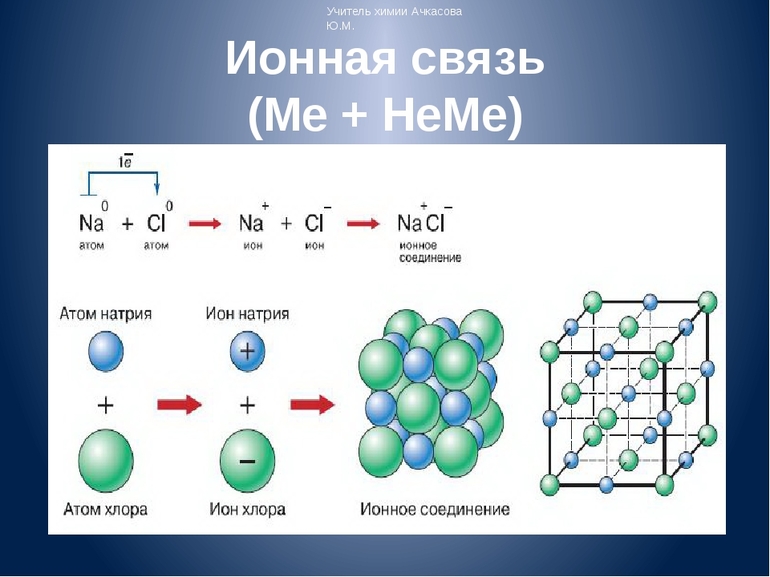
Рассмотрим способ образования на примере «хлорида натрия» NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: и . Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его.
Схематично это можно записать так:
— ион натрия, устойчивая восьмиэлектронная оболочка () за счет второго энергетического уровня. — ион хлора, устойчивая восьмиэлектронная оболочка.
Между ионами и возникают силы электростатического притяжения, в результате чего образуется соединение.
Ключевая информация
В химической науке существует четыре основных типа связи — ковалентная, ионная, металлическая и водородная. Металлическая возникает между элементами-металлами, водородная — между молекулами, состоящими из водорода и атомов с высокой электроотрицательностью (азотом, кислородом, фтором).
Самые разнообразные соединения относятся к ковалентной и ионной связям, которые представляют по своему составу смешанный тип. Для ионной связи ковалентная в определенном смысле выполняет материнскую функцию.
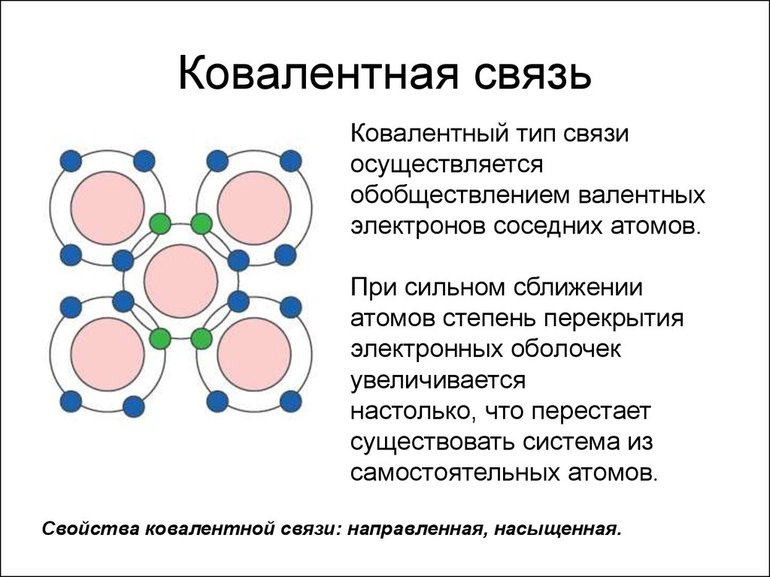
Наиболее частым и распространенным видом химической связи считается именно ковалентная. Это соединение, в процессе формирования которого обобществляется (перекрывается) пара валентных электронных облаков. Количество таких связей, образованных атомом элемента, — это показатель ковалентности.
Ковалентная связь бывает двух типов — неполярная и полярная. Определяющими факторами для типа связи служат значения электроотрицательности взаимодействующих атомов химических элементов. Если эти показатели у атомов:
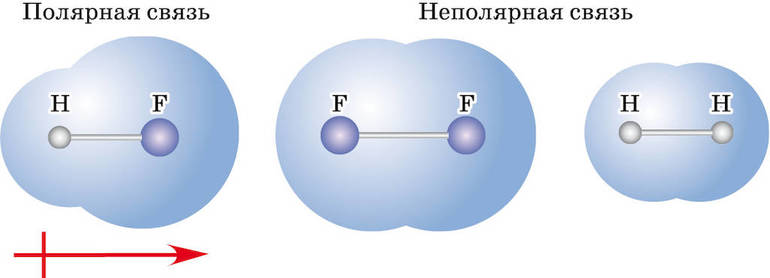
- равны или примерно равны (разница между значениями по шкале Полинга — до 0,4) — это ковалентная неполярная связь (общая электронная пара не смещается ни к одному из атомов);
- отличаются, но не сильно (разница от 0,4 до 1,7) — это ковалентная полярная связь (электронная пара смещается к одному из участвующих атомов);
- отличаются сильно (разница более 1,7) — это ионная связь (один или несколько электронов не просто смещаются, а почти полностью переходят к другому атому, причем всегда к тому, у которого значение электроотрицательности больше, при этом оба атома-участника превращаются в ионы).
Электростатическое притяжение частиц в ионной связи очень сильное. Эта особенность обусловливает высокие температуры плавления и кипения для веществ с такой связью. Однако стопроцентного ионного соединения не существует. Электронная пара не переходит к более электроотрицательному атому полностью. В качестве яркого примера наиболее сильного смещения электронов стоит привести фторид цезия CsF. Так называемая «степень ионности» в этом соединении достигает 97%.
Заряды частиц и их классификация
По определению ионная химическая связь — это соединение ионов с разным зарядом (положительным и отрицательным). Это частный случай ковалентной полярной связи или, иначе говоря, крайний случай поляризации.
Положительно заряженные ионы называются катионами. Примеры: K+ (ион калия), Fe 2 + (ион железа) и так далее. Катионы образуются в результате отдачи (потери) атомом одного электрона или нескольких. У них положительный заряд ядра превышает число отрицательно заряженных электронов.

Отрицательно заряженные ионы — это анионы. Примеры: Cl- (хлорид-ион), N 3 — (нитрид-ион) и так далее. Образование анионов происходит в результате получения (приобретения) атомом электрона (или электронов). У них ядерный заряд уступает количеству электронов.
По значению заряда ионы классифицируются на соответствующие категории (в скобках приведены примеры ионов, входящих в группу):
- однозарядную (K+, Cl- и так далее);
- двухзарядную (Ca2 +, O2 — и прочие);
- трехзарядную (Al3 + и другие).
Одна из особенностей связи разноименных ионов — при их взаимодействии друг с другом их заряды полностью разделяются. Это связано с большой разностью электроотрицательностей атомов в паре.
Процесс взаимодействия
В отличие от металлической связи, где соединение образуется парой элементов-металлов, в процессе образования ионного соединения в качестве участников выступают атомы металлов и неметаллов. Типичные металлы охотно делятся электронами, а типичные неметаллы не менее охотно их принимают. Отдающий атом называется донорным, а принимающий — акцепторным.
При возникновении соединения атом неметалла забирает электроны на свой внешний энергетический уровень, достраивая его таким методом. В результате он приобретает устойчивую конфигурацию из восьми электронов (согласно правилу октета). То есть суть механизма образования ионной связи заключается в следующем: после взаимного притяжения друг к другу противоположно заряженные ионы образуют стабильное соединение.

Атомы с почти полной или почти пустой внешней (валентной) оболочкой вступают в химические реакции максимально охотно. Заполненность этого слоя играет ключевую роль в электронном обмене. Малое количество пустых орбиталей на внешней оболочке повышает шансы атома на получение электронов извне. А мизерное количество электронов, расположенных на валентной оболочке, напротив, увеличивает вероятность отдачи атомом электрона.
Электроотрицательность атома химического элемента выражается в его способности к притяжению электронов к своему внешнему слою. Именно поэтому чем полнее заполнена валентная оболочка атома, тем больше значение его электроотрицательности. Показатели электроотрицательности связаны с расположением элементов в периодической таблице Менделеева — чем дальше они находятся друг от друга (расстояние оценивают в основном по группе), тем больше разница между показателями. По этой причине ионные соединения особенно характерны для металлов и неметаллов, расположенных в системе наиболее удаленно (например, в I и VII группах).
Помимо простой связи ионов, стоит особо отметить ее молекулярную разновидность. Главная особенность такого соединения заключается в том, что в качестве ионов в ней выступают целые молекулы, а не отдельные атомы, как в обычной связи.
Примеры возникновения
Подробно рассмотреть, как взаимодействие атомов с разноименными зарядами приводит к образованию связи ионов, стоит на нескольких простых примерах.
Первый пример — общее описание механизма возникновения. Для этого подойдет химическая реакция формирования такого соединения, как хлорид натрия или, проще говоря, поваренная соль. В процессе участвуют атомы щелочного металла (натрий Na) и галогена (хлор Cl). У первого на внешнем энергетическом уровне находится один электрон, а у второго — семь, то есть ему как раз нужен один электрон для завершения своего внешнего слоя.
Единственный валентный электрон атома металла имеет слабую связь с его ядром, поэтому Na легко отдает эту частицу. В результате у него освобождается место на внешнем энергетическом уровне. Таким образом оба участника соединения получили полностью заполненные внешние оболочки. После отдачи электрона атом металла превращается в катион натрия Na+, а принявший этот электрон атом неметалла преображается в хлорид-ион Cl-. Образовавшиеся ионы притягиваются друг к другу — возникает ионное соединение.
Схема процесса превращения атомов натрия и хлора в ионы соответствующих элементов и образование ими ионного соединения выглядит следующим образом (скобками отмечены электронные слои строения атома): Na0 )2e)8e)1e + Cl0 )2e)8e)7e = [Na+)2e)8e] + [Cl-)2e)8e)8e] = [Na+)2e)8e][Cl-)2e)8e)8e]. Этот же процесс в виде формулы выглядит так: Na0 + Cl0 = Na+ + Cl- = Na+Cl-
Таким образом, формула вещества с ионной связью (в приведенном примере это поваренная соль) имеет следующий вид: Na+Cl- (то есть один участник в ходе взаимодействия приобретает положительный заряд, а другой, наоборот, отрицательный). Ионные вещества всегда имеют сложный состав — они не состоят из одного элемента. Это соединение характерно для следующих веществ:
- солей;
- щелочей;
- оксидов некоторых металлов.
Они обладают кристаллическими решетками ионного типа.
Что касается элементов, то для примера ионной связи натрий — один из самых подходящих элементов периодической таблицы Менделеева. Это связано с его низкой электроотрицательностью и наличием на внешней оболочке единственного электрона. Второй пример формирования ионного соединения также будет с натрием. Рассматриваемое вещество — фторид натрия. Участники процесса — натрий Na и фтор F.
По наиболее важным для изучаемого процесса характеристикам фтор схож с хлором — у него высокая электроотрицательность и семь электронов на внешнем слое. Поэтому он также очень подходит для рассмотрения эталонной связи ионов.
Фторид натрия образуется в результате окислительно-восстановительной реакции между атомами натрия и фтора. Металл отдает свой внешний электрон неметаллу. Последняя внешняя орбиталь атома фтора заполняется, валентный слой натрия освобождается. Оба атома, превращаясь в ионы с разноименными зарядами, приобретают стабильную электронную конфигурацию. Затем между ними возникает электростатическое притяжение, в результате чего они образуют ионное соединение.
Особенности связи

Для соединений ионов характерна кристаллическая структура. Яркий пример типичной формы таких веществ — это поваренная соль NaCl.
Эти соединения очень прочные — настолько, что их крайне проблематично разрушить посредством тепловой энергии. Однако из-за довольно низкого радиуса ионного взаимодействия эти соединения получили такую незавидную характеристику, как ломкость. Что касается энергии самой связи, то она прямо пропорциональна кратности соединения, то есть числу общих электронных пар.
Соединения ионов отлично растворяются в полярных растворителях — воде, кислотах и прочих. Эта особенность обусловлена заряженностью частей молекулы. Помимо растворимости, ионные соединения обладают такими характеристиками:

- прочность;
- длина;
- поляризуемость;
- полярность;
- ненасыщаемость;
- ненаправленность.
Два последних характерных свойства ионной связи отличают ее от прочих видов химических соединений. Эти особенности обусловливают факт тяготения кристаллов ионных веществ к различным плотнейшим упаковкам соответствующих ионов.
Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни.
Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженную частицу. Такие частицы называются ионами.
Ионы — заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной.
Ионная связь — связь между положительно и отрицательно заряженными ионами.
Рассмотрим механизм образования ионной связи на примере взаимодействия натрия и хлора.
Na0+Cl0→Na++Cl−→Na+Cl−
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов, электроотрицательности которых резко различаются.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов.
Рассмотрим другие примеры образования ионной связи.
Пример:
Взаимодействие кальция и фтора
1. Кальций — элемент главной подгруппы второй группы. Ему легче отдать два внешних электрона, чем принять недостающие.
2. Фтор — элемент главной подгруппы седьмой группы. Ему легче принять один электрон, чем отдать семь.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2). Определим число атомов фтора, которые примут два электрона от атома кальция: (2) (:) (1) (=) (2).
4. Составим схему образования ионной связи:
Ca0+2F0→Ca2+F2−.
Пример:
Взаимодействие натрия и кислорода
1. Натрий — элемент главной подгруппы первой группы. Он легко отдаёт один внешний электрон.
2. Кислород — элемент главной подгруппы шестой группы. Ему легче принять два электрона, чем отдать шесть.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2) (:) (1) (=) (2). Определим число атомов натрия, которые отдадут два электрона атому кислорода: (2).
4. Составим схему образования ионной связи:
2Na0+O0→Na2+O2−.
С помощью ионной связи образуются также соединения, в которых имеются сложные ионы:
NH4+,NO3−,OH−,SO42−,PO43−,CO32−.
Значит, ионная связь существует также в солях и основаниях.
Обрати внимание!
Соли аммония NH4NO3,NH4Cl,NH4SO42 не содержат металла, но образованы ионной связью.
Ионы создают вокруг себя электрическое поле, действующее во всех направлениях. Поэтому каждый ион окружён ионами противоположного знака. Такое соединение представляет собой огромную группу положительных и отрицательных частиц, расположенных в определённом порядке.
Притяжение между ионами довольно сильное, поэтому ионные вещества имеют высокие температуры кипения и плавления.
Обрати внимание!
Все ионные соединения при обычных условиях — твёрдые вещества.
Примеры веществ с ионной связью:
Питьевая сода
Железный купорос
Поваренная соль
Источники:
Габриелян О. С. Химия. 8 класс. Учебник для общеобразовательных учреждений. М.: Дрофа, 2013. — 63 с.
Ионная связь осуществляется в результате образования и электростатического взаимодействия противоположно заряженных ионов. Ионная связь может возникать лишь при больших различиях в значениях электроотрицательностей атомов.
Так как электрическое поле иона имеет сферическую симметрию, то в отличие от ковалентной ионная связь не обладает направленностью. Взаимодействие двух противоположно заряженных ионов не приводит к полной взаимной компенсации их полей, они сохраняют способность притягивать и другие ионы. Поэтому в отличие от ковалентной ионная связь не обладает насыщаемостью. Из-за отсутствия у ионной связи направленности и насыщаемости каждый ион окружен ионами противоположного знака, число которых определяется размерами и силой отталкивания одноименно заряженных ионов. Поэтому соединения с ионной связью представляют собой кристаллические вещества. Весь кристалл можно рассматривать как единую гигантскую молекулу, состоящую из очень большого числа ионов. Лишь при высоких температурах, когда вещество переходит в газообразное состояние, ионные соединения могут существовать в виде неассоциированных молекул.
Ионную связь можно рассматривать как предельную полярную химическую связь, для которой эффективный заряд атома близок к единице. В то же время для неполярной ковалентной связи эффективный заряд атомов равен нулю. Химическая связь большинства соединений является полярной, т. е. имеет промежуточный характер между неполярной ковалентной и ионной связями. Ковалентная связь имеет частично ионный характер. Долю ионного характера связи называют степенью ионности, которая количественно характеризуется эффективными зарядами атомов в молекуле. Степень ионности связи возрастает с увеличением разности электроотрицательности образующих ее атомов.
Водородная связь.
Помимо различных гетерополярных и го-меополярных связей, существует еще один особый вид связи, который в последние два десятилетия привлекает все большее внимание химиков. Это так называемая водородная связь. Оказалось, что атом водорода может образовывать связь между двумя электроотрицательными атомами (F, О, N, реже Сl и S). Известны случаи, когда эту связь образует водородный атом, связанный с атомом углерода в соединениях типа НСХ3, где X — электроотрицательный атом или группа (например, в HCN, фторуглеводородах). Хотя в настоящее время природа водородной связи еще до конца не выяснена, одна.ко определен-ное представление о ней уже можно составить.
Водородная связь образуется между электроотрицательными атомами, из которых хотя бы один имеет свободную электронную пару, например:
(водородная связь обозначается пунктиром из трех точек).
Таким образом, водородная связь по своему характеру является, по-видимому, электростатической; она образуется вследствие притяжения ковалентно связанного протона свободными электронами атома другой молекулы. При этом протон находится не посредине между связываемыми им атомами (даже если они одинаковы), а ближе к тому атому, с которым он связан ковалентно. Так, в случае воды
одно расстояние О—Н равно 0,99 А, а другое 1,76 А.
Вопрос о том, находится ли водород в фиксированном положении или он совершает колебания между двумя положениями равновесия, в общем случае еще неясен, хотя исследование хингидрона методом меченых атомов свидетельствует о фиксированном положении водорода водородной связи в этом соединении.
Энергия водородной связи мала; она имеет порядок 5—10 ккал/моль, в то время как, например, энергия нормальной связи О—Н равна 109 ккал/моль, а связи Н—F 148 ккал/моль. При плавлении льда рвется около 15% всех водородных связей, при нагревании воды до 40° С рвется около половины водородных связей. В парах воды водородных связей практически нет. При плавлении спиртов водородные связи почти не разрываются, однако они полностью рвутся при их испарении. В кар-боновых кислотах водородные связи не разрываются и при:
испарении, благодаря чему, например, муравьиная кислота и в паровой фазе существует в виде димера
Однако и в этом случае энергия водородной связи составляет всего около 7 ккал/моль.
Наличие водородных связей оказывает существенное влияние на физические свойства соединений. Именно водородные связи обусловливают ассоциацию воды и спиртов, а следовательно, и аномально высокие точки их кипения сравнительно, например, с сероводородом и меркаптанами. Способность спиртов, аминов, карбоновых кислот, амидов растворяться в воде вызвана образованием водородных связей с молекулами воды.
Некоторые соединения, подобно енольной форме ацетоуксус-ного эфира, о-нитрофенолу и др., образуют внутримолекулярные водородные связи с замыканием цикла.
Изучение водородных связей должно пролить дополнительный свет на строение и свойства многих органических веществ.
Билет 10.
